Dipolové momenty
Asymetrické rozložení náboje v polární látce, jako je HCl, vytváří dipólový moment, kde \( Qr \) v metrech (m). se zkracuje řeckým písmenem mu (µ). Dipólový moment je definován jako součin dílčího náboje Q na vázaných atomech a vzdálenosti r mezi dílčími náboji.
Když je molekula s dipólovým momentem umístěna do elektrického pole, má tendenci se orientovat podle elektrického pole, protože má asymetrické rozložení náboje (Obrázek \(\PageIndex{4}\)).
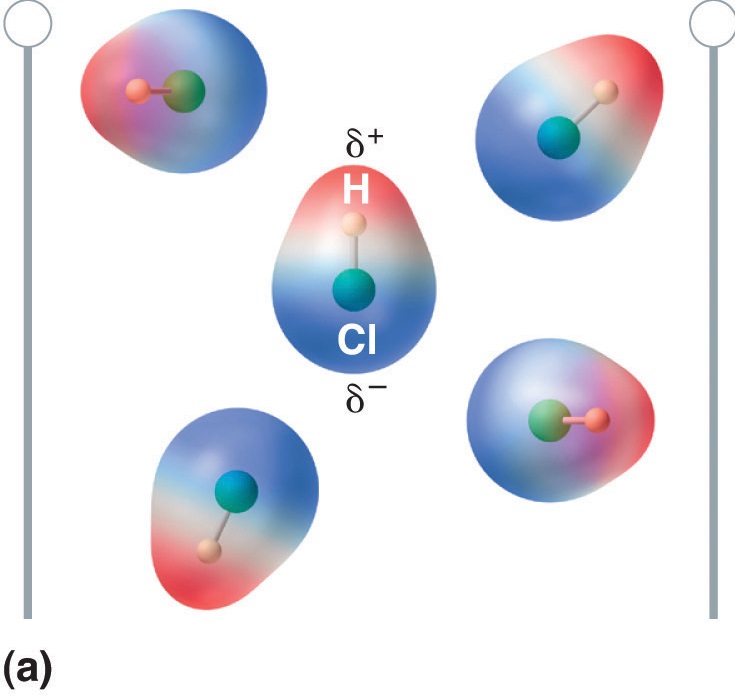
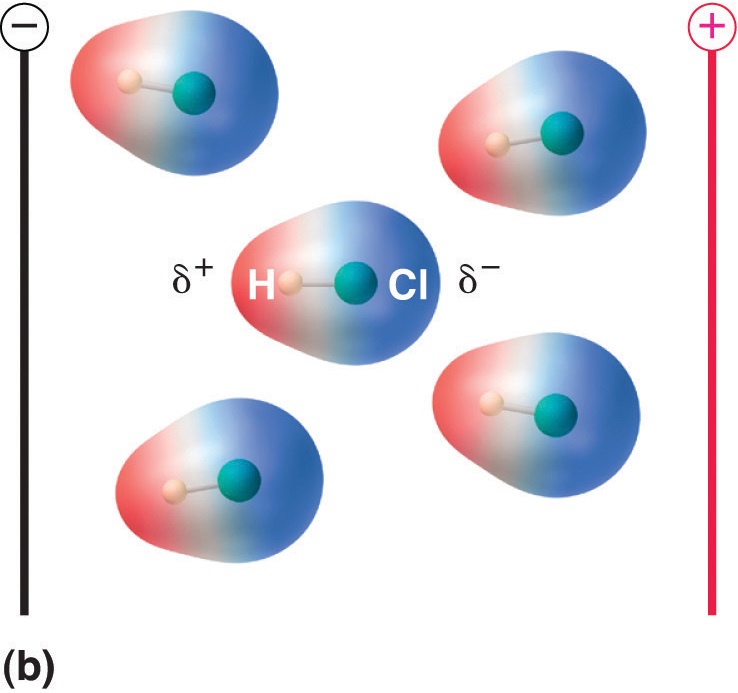
Obrázek \(\PageIndex{5}\): Molekuly, které mají dipólový moment, se částečně vyrovnávají s aplikovaným elektrickým polem. V nepřítomnosti pole (a) jsou molekuly HCl orientovány náhodně. Při aplikaci elektrického pole (b) mají molekuly tendenci se s polem vyrovnávat tak, že kladný konec molekulového dipólu směřuje k zápornému pólu a naopak.
Naměřený dipólový moment HCl ukazuje, že vazba H-Cl má přibližně 18% iontový charakter (0,1811 × 100) nebo 82% kovalentní charakter. Místo zápisu HCl jako
\
můžeme tedy oddělení nábojů kvantitativně označit jako
\
Naše vypočtené výsledky jsou ve shodě s rozdílem elektronegativity mezi vodíkem a chlorem χH = 2,20; χCl = 3,16, χCl – χH = 0,96), což je hodnota v mezích pro polární kovalentní vazby. Dipólový moment označujeme šipkou nad molekulou. Z matematického hlediska jsou dipólové momenty vektory a mají velikost i směr. Dipólový moment molekuly je vektorový součet dipólů jednotlivých vazeb. Například u HCl je dipólový moment vyznačen takto:
![]()
Šipka ukazuje směr toku elektronů tím, že směřuje k elektronegativnějšímu atomu.
Náboj atomů mnoha látek v plynné fázi lze vypočítat pomocí naměřených dipólových momentů a vzdáleností vazeb. Obrázek \(\PageIndex{6}\) ukazuje graf procentuálního iontového charakteru v závislosti na rozdílu elektronegativity vázaných atomů pro několik látek. Z grafu vyplývá, že vazba u druhů, jako je NaCl(g) a CsF(g), má podstatně méně než 100% iontový charakter. Při kondenzaci plynu do pevné látky však dipólově-dipólové interakce mezi polarizovanými druhy zvyšují nábojové separace. V krystalu tedy dochází k přenosu elektronu z kovu na nekov a tyto látky se chovají jako klasické iontové sloučeniny. Údaje na obrázku \(\PageIndex{6}\) ukazují, že diatomické druhy s rozdílem elektronegativit menším než 1,5 mají méně než 50% iontový charakter, což je v souladu s naším dřívějším popisem těchto druhů jako druhů obsahujících polární kovalentní vazby. Použití dipólových momentů k určení iontového charakteru polární vazby je znázorněno v příkladu \(\PageIndex{2}\).
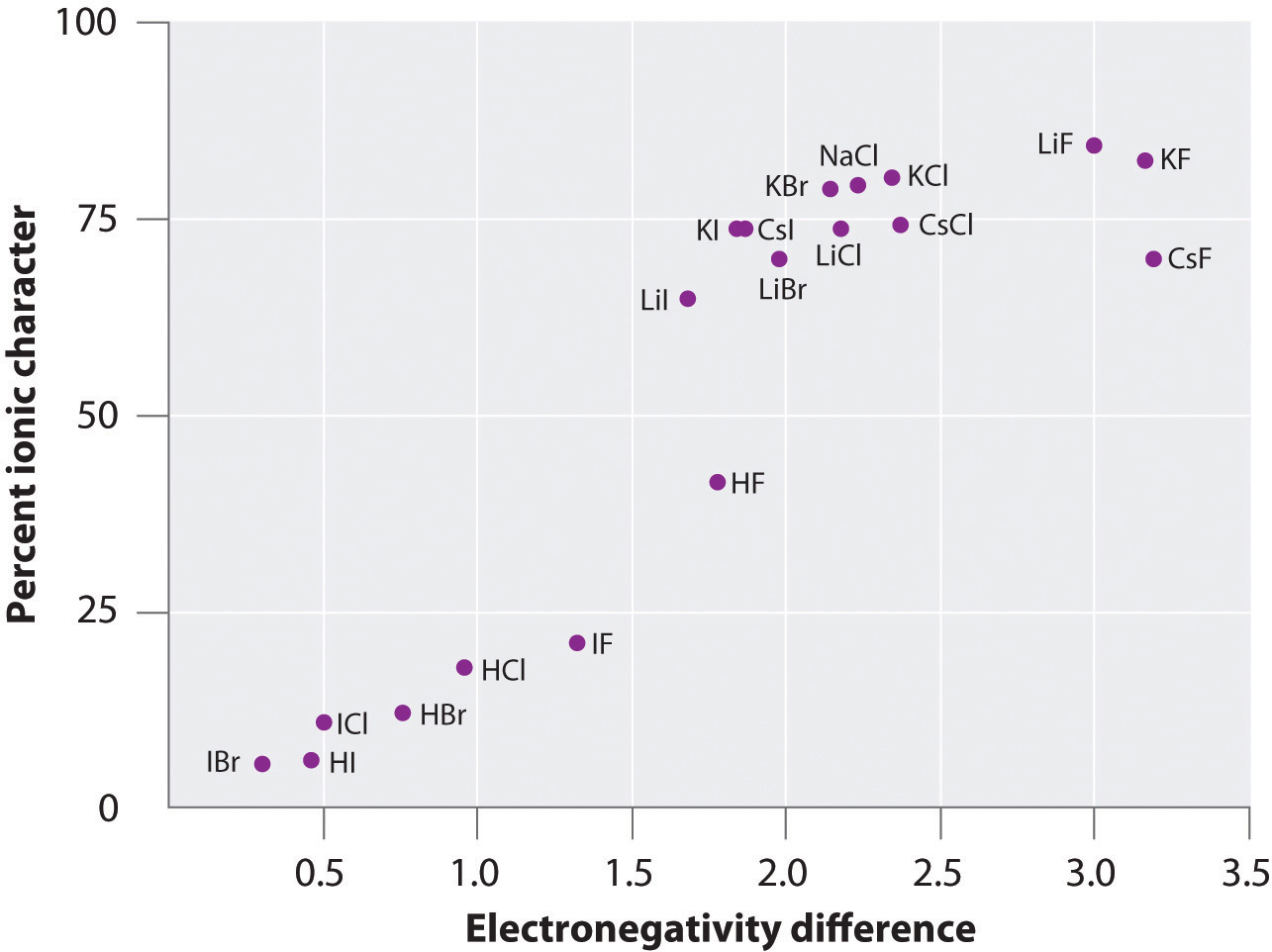
Obrázek \(\PageIndex{6}\): V plynné fázi není ani CsF, který má největší možný rozdíl elektronegativity mezi atomy, 100% iontový. Na pevný CsF je však nejlépe pohlížet jako na 100% iontový kvůli dodatečným elektrostatickým interakcím v mřížce
.
