Entalpie
Termodynamika je nauka o vztahu mezi teplem (nebo energií) a prací. Ústředním faktorem termodynamiky je entalpie. Je to obsah tepla v systému. Teplo, které při reakci přechází do systému nebo z něj odchází, je změna entalpie. To, zda se entalpie systému zvýší (tj. když se energie přidá) nebo sníží (protože se energie odevzdá), je rozhodujícím faktorem, který určuje, zda reakce může proběhnout.
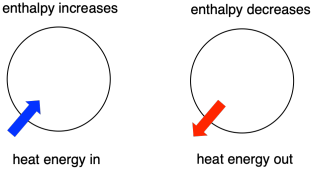
Někdy nazýváme energii molekul, které procházejí změnou, „vnitřní entalpií“. Někdy ji nazýváme „entalpie systému“. Tyto dva výrazy označují totéž. Podobně se energie molekul, které se reakce neúčastní, nazývá „vnější entalpie“ nebo „entalpie okolí“.
Hrubě řečeno, změny energie, kterými jsme se zabývali v úvodu do termodynamiky, byly změny entalpie. V další části uvidíme, že existuje ještě jeden energetický faktor, entropie, který musíme při reakcích také brát v úvahu. Prozatím se budeme zabývat pouze entalpií.
- Entalpie je tepelný obsah systému.
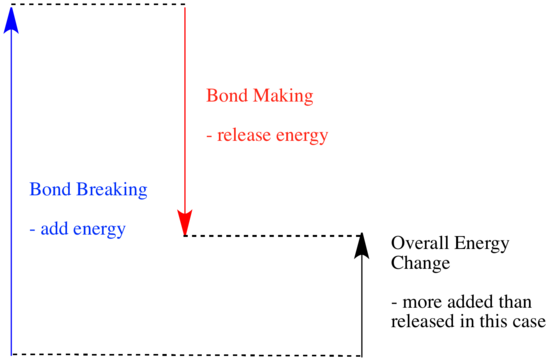
- Změna entalpie reakce zhruba odpovídá množství energie ztracené nebo získané během reakce.
- Reakce je zvýhodněná, jestliže entalpie systému v průběhu reakce klesá.
Toto poslední tvrzení se hodně podobá popisu energetiky na předchozí straně. Pokud systém prochází reakcí a odevzdává energii, jeho vlastní energetický obsah se snižuje. Pokud nějakou energii odevzdal, zbylo mu méně energie. Proč se při reakci mění energie souboru molekul? Abychom na to mohli odpovědět, musíme se zamyslet nad tím, co se děje při chemické reakci.
Při reakci dochází ke změně chemické vazby. Některé vazby v reaktantech se přeruší a vytvoří se nové vazby za vzniku produktů. Přerušení vazeb stojí energii, ale při vzniku nových vazeb se energie uvolňuje.
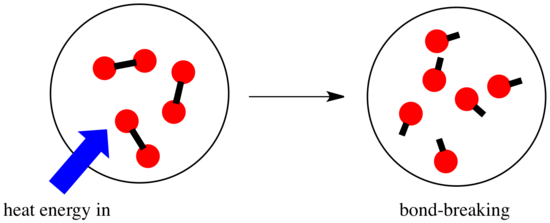
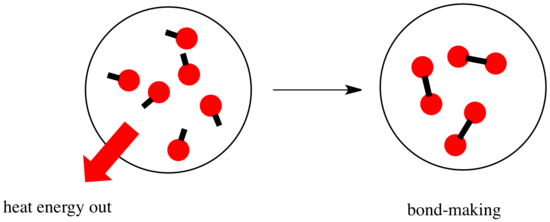
Zda bude reakce schopna pokračovat, může záviset na rovnováze mezi těmito kroky vytváření a rozbíjení vazeb.
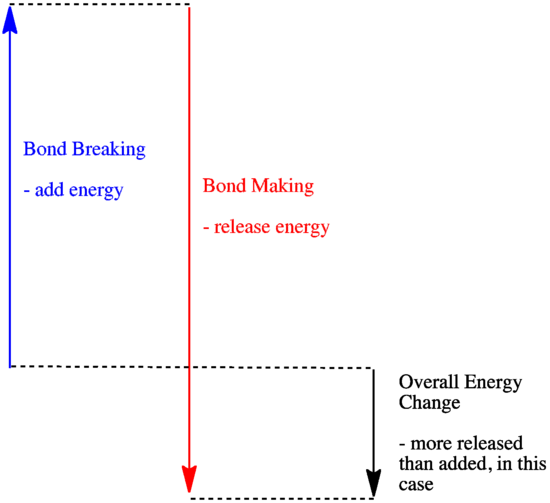
- Reakce je exotermická, pokud se při tvorbě nových vazeb uvolní více energie, než se spotřebuje při rozbíjení starých vazeb.
- Reakce je exotermická, jestliže se slabší vazby vyměňují za silnější.
- Reakce je endotermická, jestliže se na přerušení vazby spotřebuje více energie, než kolik se jí dodá při tvorbě vazby.
Energie vazby (množství energie, které je třeba dodat k přerušení vazby) jsou důležitým faktorem určujícím, zda k reakci dojde. Sílu vazby není vždy snadné předpovědět, protože síla vazby závisí na řadě faktorů. Mnoho lidí však odvedlo spoustu práce při měření pevnosti vazeb a tyto informace shromáždili v tabulkách, takže pokud potřebujete zjistit, jak silná je vazba, můžete si potřebné informace jednoduše vyhledat.
| Vazba | Energie vazby (kcal/mol) | Vazba | Energie vazby (kcal/mol) |
| H-H | 104 | O-H | 111 |
| C-C | 83 | C-H | 99 |
| O=O | 119 | N-H | 93 |
| N=N | 226 | C=O | 180 |
Např, Předpokládejme, že chcete zjistit, zda je spalování metanu exotermická nebo endotermická reakce. Budu hádat, že je exotermická, protože tato reakce (a jí podobné) se používá k zajištění tepla pro spoustu domácností spalováním zemního plynu v pecích.
„Spalování“ metanu znamená, že se spaluje na vzduchu, takže reaguje s kyslíkem. Produkty spalování uhlovodíků jsou většinou oxid uhličitý a voda. Atom uhlíku v metanu (CH4) se začlení do molekuly oxidu uhličitého. Atomy vodíku se začlení do molekul vody. V metanu jsou čtyři atomy vodíku, takže to stačí na vytvoření dvou molekul H2O.
- Při spalování metanu se musí přerušit čtyři vazby C-H.
- Čtyři nové vazby O-H se vytvoří, když se vodíky z metanu přidají do nových molekul vody.
- Dvě nové vazby C=O se vytvoří, když se uhlík z metanu přidá do molekuly CO2.
Druhým dílem skládačky je zdroj kyslíku pro reakci. Kyslík je v atmosféře přítomen převážně jako O2. Protože potřebujeme dva atomy kyslíku v molekule CO2 a další dva atomy kyslíku pro dvě molekuly vody, potřebujeme pro reakci celkem čtyři atomy kyslíku, které by mohly poskytnout dvě molekuly O2.
-
Dvě vazby O=O musí být přerušeny, aby se zajistily atomy kyslíku pro produkty.
Celkově to znamená čtyři přerušené vazby C-H a dvě vazby O=O plus dvě vytvořené vazby C=O a čtyři vazby O-H.
Přerušené vazby O=O a dvě vytvořené vazby O=O musí být odstraněny. To je 4 x 99 kcal/mol pro vazby C-H a 2 x 119 kcal/mol pro vazby O=O, celkem tedy přibylo 634 kJ/mol. Reakcí se uvolní 2 x 180 kcal/mol pro vazby C=O a 4 x 111 kcla/mol pro vazby OH, celkem 804 kcal/mol. Celkově se uvolní o 170 kcal/mol více, než se spotřebuje.
To znamená, že reakce je exotermická, takže při ní vzniká teplo. Je to pravděpodobně dobrý způsob vytápění vašeho domu.
