US Pharm. 2020;45(5)(Specialty&Oncology suppl):3-8.
ABSTRAKT: V posledních letech bylo vyvinuto několik nových možností cílené léčby v boji proti rezistenci na tradiční endokrinní terapii pokročilého karcinomu prsu. Tři inhibitory CDK4/6 (palbociklib, ribociklib a abemaciklib) byly schváleny pro pacienty s pozitivním hormonálním receptorem a negativním receptorem pro lidský epidermální růstový faktor 2 u pokročilého karcinomu prsu. Každý z těchto přípravků prokázal svou účinnost, ale mezi těmito třemi léčivy existují rozdíly, zejména v profilech nežádoucích účinků.
Karcinom prsu je nejčastějším typem rakoviny u žen, v roce 2020 se odhaduje více než 276 000 nových případů.1 Karcinom prsu s pozitivními hormonálními receptory (HR+), který tvoří více než 70 % těchto případů, byl v minulosti léčen endokrinní léčbou (ET), jako jsou selektivní inhibitory estrogenových receptorů a inhibitory aromatázy (AI). Přestože ET zůstává základem léčby HR+ karcinomu prsu, až u 50 % pacientek s pokročilým karcinomem prsu vzniká rezistence.2 Pro boj s rezistencí byla u HR+ karcinomu prsu schválena cílená léčba.3,4
Inhibitory cyklin-dependentní kinázy (CDK), nejnovější třída, která je předmětem zájmu u pokročilého karcinomu prsu, fungují tak, že specificky inhibují proteiny CDK4/6 a blokují přechod z G1 do S fáze buněčného cyklu. Tato třída léků inhibuje kinázovou aktivitu, která fosforyluje retinoblastomovou proteinovou dráhu. Blokováním této cesty jsou inhibitory CDK4/6 schopny zablokovat průběh buněčného cyklu uprostřed fáze G1 a zabránit progresi nádorových buněk. V posledních letech byly schváleny tři inhibitory CDK4/6 (palbociklib, ribociklib a abemaciklib) jako kombinovaná léčba HR+, lidského receptoru pro epidermální růstový faktor 2 negativního (HER2-), pokročilého nebo metastazujícího karcinomu prsu.5-8 V tomto článku jsou uvedeny rozdíly mezi těmito přípravky (TABULKA 1), klinické studie fáze III (TABULKA 2) a profily nežádoucích účinků (NÚ) (TABULKA 3).
Palbociklib
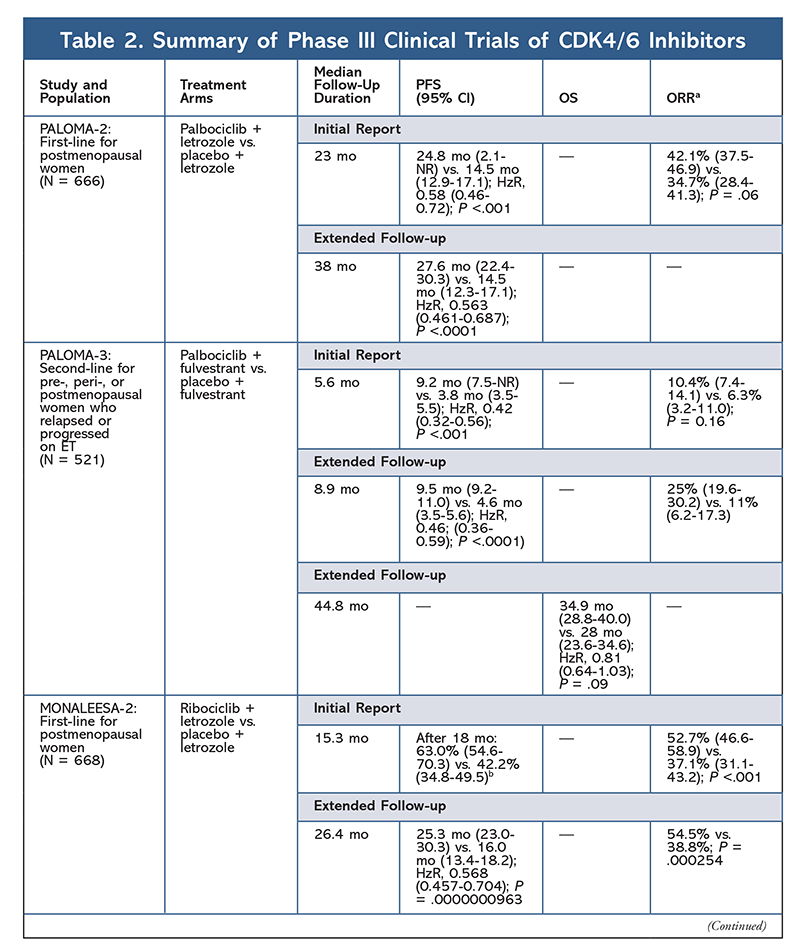
V roce 2015 se palbociklib stal prvním inhibitorem CDK4/6, který získal schválení FDA pro léčbu HR+, HER2- karcinomu prsu (v kombinaci s AI jako počáteční ET u postmenopauzálních žen nebo u mužů nebo v kombinaci s fulvestrantem u pacientek s progresí onemocnění po ET).6,9-14 Palbociklib byl původně schválen po pozitivních výsledcích studie fáze II PALOMA-1, která srovnávala palbociklib plus letrozol se samotným letrozolem jako počáteční léčbu pacientek s pokročilým karcinomem prsu, které jsou ET naivní.9
Tyto výsledky vedly ke dvěma studiím fáze III, které dále hodnotily účinek palbociklibu u této populace pacientek. První výsledky studie PALOMA-2 potvrdily účinek palbociklibu plus letrozolu a prokázaly lepší přežití bez progrese (PFS) ve srovnání se samotným letrozolem (24,8 měsíce vs. 14,5 měsíce; poměr rizik pro progresi onemocnění nebo úmrtí 0,58; 95% CI, 0,46-0,72; P <.001). Studie dlouhodobého sledování po 38 měsících dále potvrdila vliv palbociklibu na PFS, kdy došlo k prodloužení na 27,6 měsíce oproti 14,5 měsíce u samotného letrozolu (HzR, 0,563; 95% CI, 0,461-0,687; P <,0001). Následná studie rovněž zaznamenala konzistentní zlepšení PFS při léčbě palbociklibem plus letrozolem ve všech studovaných podskupinách, stejně jako zpoždění mediánu doby do zahájení následné léčby. Údaje o celkovém přežití (OS) v úvodní a následné zprávě však byly nezralé a zařazené pacientky jsou sledovány z hlediska přežití.10,11
Krátce po zahájení studie PALOMA-2 byla zahájena další studie fáze III, PALOMA-3, jejímž cílem bylo posoudit bezpečnost a účinnost palbociklibu plus fulvestrantu u premenopauzálních nebo postmenopauzálních žen s HR+ pokročilým karcinomem prsu, který progredoval na předchozí ET. Úvodní zpráva po 5,6 měsících sledování ukázala zlepšení mediánu PFS (9,2 měsíce vs. 3,8 měsíce) s 58% snížením progrese (HzR, 0,42; 95% CI, 0,32-0,56; P <,001).12 Předem specifikovaná analýza OS ve studii PALOMA-3 s použitím mediánu sledování 44 měsíců.8 měsíců, zjistila, že rozdíly v OS u celé intent-to-treat skupiny nedosáhly statistické významnosti, ale kombinace prodloužila OS o 10 měsíců u pacientů, kteří byli citliví na předchozí ET.14
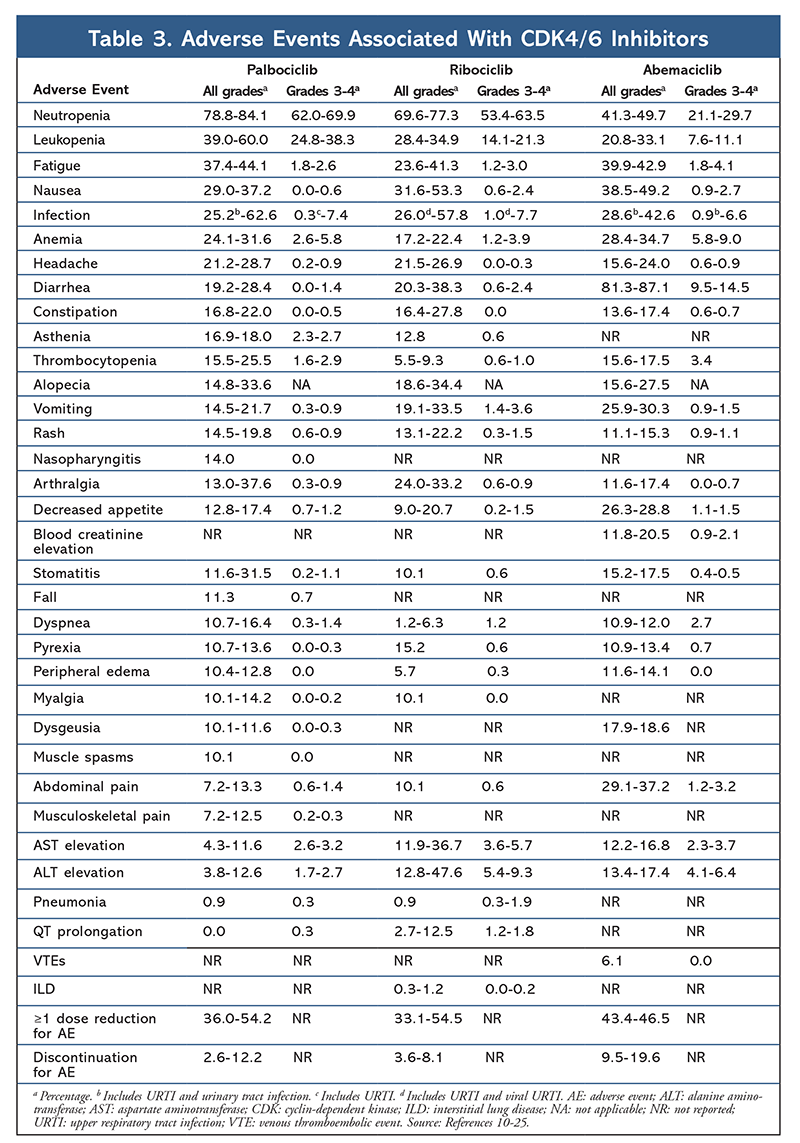
Profil nežádoucích účinků zůstal konzistentní ve všech hlášeních ze studií (TABULKA 3), přičemž nejčastěji hlášenými nežádoucími účinky byly neutropenie všech stupňů (78,8-84,1 %), leukopenie (39-60 %) a únava (37,4-44,1 %). Míra výskytu neutropenie byla vysoká; febrilní neutropenie však byla vzácná (do 2 %). Celková snášenlivost palbociklibu byla považována za zvládnutelnou a přípravek vedl k pozitivním údajům o kvalitě života při použití v kombinované léčbě ve srovnání s endokrinní monoterapií.9,14
Ribociklib
Druhý inhibitor CDK4/6, ribociklib, byl schválen FDA v roce 2017 s širší indikovanou populací pacientů. Ribociklib je schválen pro postmenopauzální a pre- nebo perimenopauzální ženy s HR+, HER2- pokročilým nebo metastazujícím karcinomem prsu (jako kombinovaná léčba s AI jako počáteční ET nebo u postmenopauzálních žen v kombinaci s fulvestrantem jako počáteční ET nebo po progresi onemocnění na ET).7
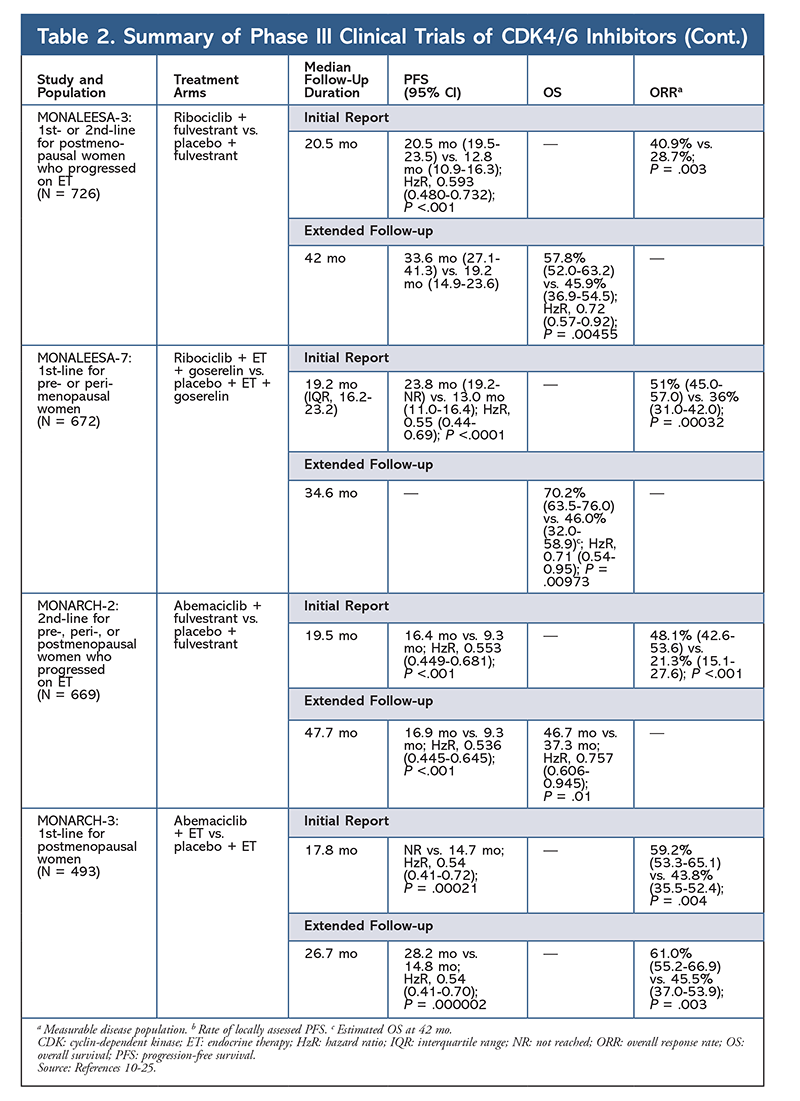
Ribociklib byl poprvé schválen FDA poté, co studie MONALEESA-2 zjistila, že při podávání léku v kombinaci s letrozolem oproti samotnému letrozolu došlo ke zlepšení PFS. Míra lokálně hodnoceného PFS oproti samotnému letrozolu po 18 měsících byla 63,0 % (95% CI, 54,6-70,3), resp. 42,2 % (95% CI, 34,8-49,5).15 Zpráva o prodlouženém sledování po 26,4 měsících dále prokázala účinnost a snášenlivost kombinace.16 Navzdory zlepšení PFS zůstávají údaje o OS pro MONALEESA-2 nezralé.
Ribociklib je také zkoumán (ve studii MONALEESA-3) v kombinaci s fulvestrantem u pacientek naivních k léčbě a u pacientek, které relabovaly po ET. První zpráva odhalila zlepšení PFS u této kombinace ve srovnání se samotným fulvestrantem (20,5 měsíce vs. 12,8 měsíce, v tomto pořadí; HzR, 0,593; 95% CI, 0,480-0,732; P <,001), což vedlo ke schválení této kombinace FDA.17 Druhá a nejnovější zpráva o inhibitorech CDK4/6, která měla dalších 21,6 měsíce sledování, dále prokázala konzistentní zlepšení PFS. Tato zpráva rovněž prokázala přínos OS ribociklibu plus fulvestrantu ve srovnání se samotným fulvestrantem, s odhadovaným OS po 42 měsících 57,8 % oproti 45,9 %, resp. s 28% snížením relativního rizika úmrtí (HzR, 0,72; 95% CI, 0,57-0.92; P = .00455).18
Třetí klinická studie, MONALEESA-7, je v současné době jedinou studií fáze III, která hodnotí účinnost a bezpečnost inhibitoru CDK4/6 jako léčby první linie u pre- nebo perimenopauzálních žen, které mají metastazující karcinom prsu. V této studii ribociklib plus tamoxifen nebo nesteroidní AI (NSAI) – jako je letrozol nebo anastrozol – plus goserelin významně zlepšily PFS o 23,8 měsíce oproti 13 měsícům u skupiny s placebem (HzR, 0,55; 95% CI, 0,44-0,69; P <,0001) a tato kombinace vedla k rozšíření indikace, která zahrnuje ženy před a v perimenopauze.19 Zpráva z rozšířeného sledování prokázala přínos kombinace ribociklib plus tamoxifen nebo NSAI plus goserelin ve srovnání s placebem, s odhadovaným 42měsíčním OS 70,2 % oproti 46,0 %.20
Profil toxicity ribociklibu je velmi podobný profilu palbociklibu, přičemž neutropenie a leukopenie jsou nejčastěji hlášenými nežádoucími účinky všech stupňů a závažnými (stupně 3/4) nežádoucími účinky, i když v nižší míře než u palbociklibu (TABULKA 3).15-20 Febrilní neutropenie byla vzácná a při delší expozici ribociklibu se v žádném z hlášení o prodlouženém sledování neobjevily nové bezpečnostní problémy.
Abemaciklib
Třetím inhibitorem CDK4/6, který byl schválen FDA, je abemaciklib. Tento přípravek je indikován v kombinaci s AI jako počáteční ET u postmenopauzálních žen s pokročilým karcinomem prsu nebo v kombinaci s fulvestrantem u pre-, peri- nebo postmenopauzálních žen s progresí onemocnění po ET. Abemaciklib je rovněž schválen jako monoterapie u mužů a žen s progresí onemocnění po ET a předchozí chemoterapii v metastatickém terénu.6 Přípravek byl původně schválen na základě výsledků studie MONARCH-1, která prokázala slibnou klinickou aktivitu po 12 měsících s celkovou mírou odpovědi (ORR) 19,7 % (95% CI, 13,3-27,5) a mediánem PFS 6 měsíců.5,21 V této době byl abemaciklib rovněž zkoumán v rámci studie MONARCH-2 u pre-, peri- a postmenopauzálních žen, u nichž došlo k progresi po ET. Tato studie prokázala statisticky významný přínos PFS při kombinaci abemaciklibu a fulvestrantu oproti samotnému fulvestrantu (16,4 měsíce vs. 9,3 měsíce; HzR, 0,553; 95% CI, 0,449-0,681; P <,001).22 Rozšířená studie sledování s mediánem trvání 47.7 měsíců zaznamenala mírně lepší výsledky PFS a přínos OS u kombinace abemaciklibu ve srovnání s placebem oproti fulvestrantu (46,7 mo vs. 37,3 mo; 95% CI, 0,606-0,945; P = .01).23
Krátce po zahájení obou studií s abemaciklibem byla zahájena studie MONARCH-3. V této studii bylo zjištěno, že kombinace abemaciklibu a fulvestrantu je přínosná pro pacienty, kteří se na ní podíleli. Tato studie zjistila statisticky významné zlepšení PFS a ORR u abemaciklibu plus NSAI ve srovnání s ramenem placebo plus NSAI jako léčby první linie u postmenopauzálních žen. Aktualizovaná zpráva s 8,9 měsíci dalšího sledování dále potvrdila výsledky PFS a ORR z počáteční analýzy; údaje o OS však zůstávají nezralé a konečná analýza OS bude provedena po 315 událostech.24,25
Obecně bylo zjištěno, že abemaciklib je nejsilnějším inhibitorem CDK4/6, který má díky své struktuře vynikající aktivitu v centrálním nervovém systému, což mu umožňuje procházet hematoencefalickou bariérou a zůstat déle v cíli.5 To může být výhodné pro pacientky s mozkovými metastázami. Ačkoli má abemaciklib také vysoké procento hematologických nežádoucích účinků, je toto procento mnohem nižší než u jiných inhibitorů CDK4/6. Abemaciklib je spojen s větším výskytem gastrointestinálních toxicit, jako je průjem, než ostatní inhibitory CDK4/6 (všechny stupně: 81,3-87,1 %; stupně 3-4: 9,5-14,5 %).22-25
Úloha lékárníka
Celkově jsou profily AE různých inhibitorů CDK 4/6 podobné, ale každý lék má jedinečné AE. Nejčastějšími AE hlášenými u inhibitorů CDK4/6 jsou neutropenie, leukopenie, únava, nevolnost, infekce, artralgie, anémie, bolest hlavy a průjem (TABULKA 3). Kromě neutropenie a leukopenie většina pacientů hlásila nežádoucí účinky 1. nebo 2. stupně. Neutropenie a leukopenie stupně 3 nebo 4, které byly velmi časté u všech inhibitorů CDK, zejména palbociklibu a ribociklibu, byly většinou řešeny přerušením a/nebo snížením dávky. CBC pacienta by měl být monitorován na začátku, každé 2 týdny během prvních dvou cyklů, na začátku každých následujících čtyř cyklů a podle klinické potřeby při supresi kostní dřeně.6-8 S palbociklibem jsou spojeny pády, svalové křeče a nazofaryngitida, které však mají ve většině případů mírný průběh.10,11,14 U ribociklibu byl hlášen nízký výskyt prodloužení QT intervalu.15-20 Abemaciklib byl spojen s významně vyšším výskytem průjmu ve srovnání s palbociklibem a ribociklibem; případy se vyskytovaly většinou během prvního cyklu a mohly být zvládnuty antidiarhoickou léčbou.22-25 Abemaciklib byl spojen se zvýšením sérového kreatininu a žilními tromboembolickými příhodami (většinou mírnými), které nebyly hlášeny u palbociklibu a ribociklibu, a s vyšším výskytem bolestí břicha.22-25 Je pozoruhodné, že v září 2019 FDA varovala, že u pacientů léčených inhibitory CDK4/6 se může objevit vzácné, ale závažné, život ohrožující nebo fatální intersticiální plicní onemocnění (ILD) a pneumonitida.26 Pacienti by proto měli být pravidelně sledováni kvůli plicním příznakům svědčícím pro ILD a/nebo pneumonitidu.
Závěr
Schválení palbociklibu, ribociklibu a abemaciklibu v posledních letech rozšířilo možnosti léčby pacientů s pokročilým karcinomem prsu. Přestože všechny mají stejný mechanismus účinku, tyto léky se mírně liší v účinnosti a bezpečnosti. Řada probíhajících studií nad rámec studií uvedených v tomto přehledu se nadále zabývá zkoumáním těchto inhibitorů u různých populací pacientek a s různými léčebnými kombinacemi. Potenciál těchto látek rozšířit použití inhibitorů CDK4/6 i do jiných situací než HR+, HER2- pokročilý karcinom prsu se zdá být slibný.27
1. Siegel RL, Miller KD, Jemal A. Cancer statistics, 2020. CA Cancer J Clin. 2020;70(1):7-30.
2. Preusser M, De Mattos-Arruda L, Thill M, et al. Inhibitory CDK4/6 v léčbě pacientek s karcinomem prsu: shrnutí multidisciplinární diskuse u kulatého stolu. ESMO Open. 2018;3(5):e000368.
3. Tripathy D, Bardia A, Sellers WR. Ribociklib (LEE011): mechanismus účinku a klinický dopad tohoto selektivního inhibitoru cyklin-dependentní kinázy 4/6 u různých solidních nádorů. Clin Cancer Res. 2017;23(13):3251-3262.
4. Portman N, Alexandrou S, Carson E, et al. Overcoming CDK4/6 inhibitor resistance in ER-positive breast cancer. Endocr Relat Cancer. 2019;26(1):R15-R30.
5. Sobhani N, D’Angelo A, Pittacolo M, et al. Updates on the CDK4/6 inhibitory strategy and combinations in breast cancer. Cells. 2019;8(4):E321.
6. Ibrance (palbociclib) příbalový leták. New York, NY: Pfizer Inc; září 2019.
7. Kisqali (ribociclib) příbalová informace. East Hanover, NJ: Novartis Pharmaceuticals Corp; září 2019.
8. Verzenio (abemaciclib) příbalová informace. Indianapolis, IN: Eli Lilly and Co; září 2019.
9. Finn RS, Crown JP, Lang I, et al. The cyclin-dependent kinase 4/6 inhibitor palbociclib in combination with letrozole versus letrozole alone as first-line treatment of oestrogen receptor-positive, HER2-negative, advanced breast cancer (PALOMA-1/TRIO-18): a randomized phase 2 study. Lancet Oncol. 2015;16(1):25-35.
10. Finn RS, Martin M, Rugo HS, et al. Palbociclib a letrozol u pokročilého karcinomu prsu. N Engl J Med. 2016;375(20):1925-1936.
11. Rugo HS, Finn RS, Diéras V, et al. Palbociklib plus letrozol jako léčba první linie u estrogen receptor-pozitivního/human epidermal growth factor receptor 2-negativního pokročilého karcinomu prsu s prodlouženým sledováním. Breast Cancer Res Treat. 2019;174(3):719-729.
12. Turner NC, Ro J, André F, et al. Palbociclib in hormone-receptor-positive advanced breast cancer. N Engl J Med. 2015;373(3):209-219.
13. Cristofanilli M, Turner NC, Bondarenko I, et al. Fulvestrant plus palbociklib versus fulvestrant plus placebo pro léčbu metastatického karcinomu prsu s pozitivními hormonálními receptory a HER2 negativním výsledkem, který progredoval při předchozí endokrinní léčbě (PALOMA-3): závěrečná analýza multicentrické, dvojitě zaslepené, randomizované kontrolované studie fáze 3. Lancet Oncol. 2016;17(4):425-439.
14. Turner NC, Slamon DJ, Ro J, et al. Celkové přežití s palbociklibem a fulvestrantem u pokročilého karcinomu prsu. N Engl J Med. 2018;379(20):1926-1936.
15. Hortobagyi GN, Stemmer SM, Burris HA, et al. Ribociklib jako léčba první linie HR pozitivního, pokročilého karcinomu prsu. N Engl J Med. 2016;375(18):1738-1748.
16. Hortobagyi GN, Stemmer SM, Burris HA, et al. Updated results from MONALEESA-2, a phase III trial of first-line ribociclib plus letrozole versus placebo plus letrozol in hormone receptor-positive, HER2-negative advanced breast cancer. Ann Oncol. 2018;29(7):1541-1547.
17. Slamon DJ, Neven P, Chia S, et al. Randomizovaná studie fáze III ribociklibu a fulvestrantu u pokročilého karcinomu prsu s pozitivními hormonálními receptory a negativním receptorem pro lidský epidermální růstový faktor 2-: MONALEESA-3. J Clin Oncol. 2018;36(24):2465-2472.
18. Slamon DJ, Neven P, Chia S, et al. Overall survival with ribociclib plus fulvestrant in advanced breast cancer. N Engl J Med. 2020;382(6):514-524.
19. Tripathy D, Im SA, Colleoni M, et al. Ribociklib plus endokrinní léčba u premenopauzálních žen s pokročilým karcinomem prsu pozitivním na hormonální receptory (MONALEESA-7): randomizovaná studie fáze 3. Lancet Oncol. 2018;19(7):904-915.
20. Im SA, Lu YS, Bardia A, et al. Overall survival with ribociclib plus endocrine therapy in breast cancer. N Engl J Med. 2019;381(4):307-316.
21. Dickler MN, Tolaney SM, Rugo HS, et al. MONARCH 1, studie fáze II abemaciklibu, inhibitoru CDK4 a CDK6, jako jediné látky u pacientek s refrakterním HR+/HER2- metastatickým karcinomem prsu. Clin Cancer Res. 2017;23(17):5218-5224.
22. Sledge GW Jr, Toi M, Neven P, et al. MONARCH 2: abemaciklib v kombinaci s fulvestrantem u žen s HR+/HER2- pokročilým karcinomem prsu, které progredovaly při endokrinní léčbě. J Clin Oncol. 2017;35(25):2875-2884.
23. Sledge GW Jr, Toi M, Neven P, et al. The effect of abemaciclib plus fulvestrant on overall survival in hormone receptor-positive, ERBB2-negative breast cancer that progressed on endocrine therapy-MONARCH 2: a randomized clinical trial. JAMA Oncol. 2020;6(1):116-124.
24. Goetz MP, Toi M, Campone M, et al. MONARCH 3: abemaciclib jako počáteční léčba pokročilého karcinomu prsu. J Clin Oncol. 2017;35(32):3638-3646.
25. Johnston S, Martin M, Di Leo A, et al. MONARCH 3 final PFS: a randomized study of abemaciclib as initial therapy for advanced breast cancer. NPJ Breast Cancer. 2019;17(5):5.
26. FDA (ÚŘAD PRO KONTROLU POTRAVIN A LÉČIV). FDA varuje před vzácnými, ale závažnými záněty plic při léčbě karcinomu prsu přípravky Ibrance, Kisqali a Verzenio. www.fda.gov/drugs/drug-safety-and-availability/fda-warns-about-rare-severe-lung-inflammation-ibrance-kisqali-and-verzenio-breast-cancer. Přístup 15. ledna 2020.
27. Shah M, Nunes MR, Stearns V. Inhibitory CDK4/6: změna hry v léčbě pokročilého karcinomu prsu s pozitivními hormonálními receptory? Onkologie (Williston Park). 2018;32(5):216-222.
Obsah obsažený v tomto článku má pouze informativní charakter. Obsah nemá sloužit jako náhrada odborného poradenství. Spoléhání se na jakékoli informace uvedené v tomto článku je výhradně na vaše vlastní riziko.
