Dipolmomente
Die asymmetrische Ladungsverteilung in einer polaren Substanz wie HCl erzeugt ein Dipolmoment, wobei \( Qr \) in Metern (m). mit dem griechischen Buchstaben mu (µ) abgekürzt wird. Das Dipolmoment ist definiert als das Produkt aus der Teilladung Q an den gebundenen Atomen und dem Abstand r zwischen den Teilladungen.
Wenn ein Molekül mit einem Dipolmoment in ein elektrisches Feld gebracht wird, neigt es aufgrund seiner asymmetrischen Ladungsverteilung dazu, sich mit dem elektrischen Feld auszurichten (Abbildung \(\PageIndex{4}\)).
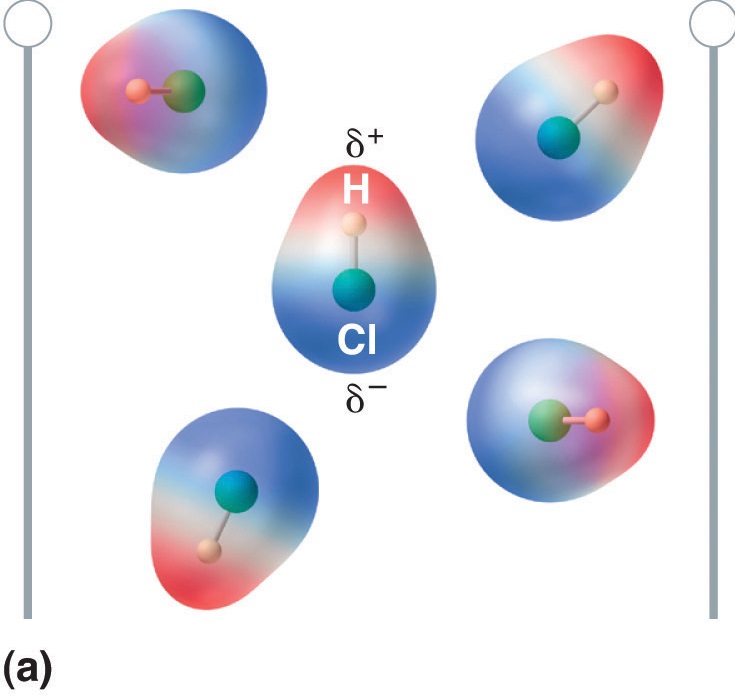
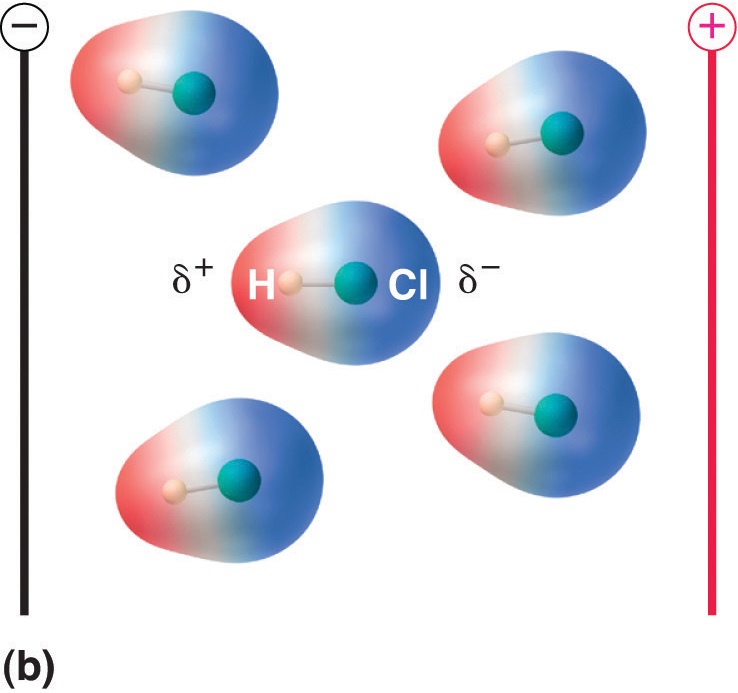
Abbildung \(\PageIndex{5}\): Moleküle, die ein Dipolmoment besitzen, richten sich in einem angelegten elektrischen Feld teilweise aus. In Abwesenheit eines Feldes (a) sind die HCl-Moleküle willkürlich ausgerichtet. Wenn ein elektrisches Feld angelegt wird (b), neigen die Moleküle dazu, sich nach dem Feld auszurichten, so dass das positive Ende des molekularen Dipols zum negativen Pol zeigt und umgekehrt.
Das gemessene Dipolmoment von HCl zeigt an, dass die H-Cl-Bindung etwa 18 % ionischen Charakter (0,1811 × 100) oder 82 % kovalenten Charakter hat. Anstatt HCl als
\
zu schreiben, können wir daher die Ladungstrennung quantitativ als
\
angeben. Unsere berechneten Ergebnisse stimmen mit der Elektronegativitätsdifferenz zwischen Wasserstoff und Chlor χH = 2,20; χCl = 3,16, χCl – χH = 0,96) überein, ein Wert, der gut im Bereich für polare kovalente Bindungen liegt. Das Dipolmoment wird durch einen Pfeil oberhalb des Moleküls angezeigt. Mathematisch gesehen sind Dipolmomente Vektoren, die sowohl einen Betrag als auch eine Richtung haben. Das Dipolmoment eines Moleküls ist die Vektorsumme der Dipole der einzelnen Bindungen. In HCl zum Beispiel ist das Dipolmoment wie folgt angegeben:
![]()
Der Pfeil zeigt die Richtung des Elektronenflusses, indem er auf das elektronegativere Atom zeigt.
Die Ladung der Atome vieler Stoffe in der Gasphase kann anhand gemessener Dipolmomente und Bindungsabstände berechnet werden. Abbildung \(\PageIndex{6}\) zeigt eine Darstellung des prozentualen Ionencharakters gegenüber dem Unterschied in der Elektronegativität der gebundenen Atome für mehrere Stoffe. Aus dem Diagramm geht hervor, dass die Bindungen in Stoffen wie NaCl(g) und CsF(g) zu deutlich weniger als 100 % ionisch sind. Wenn das Gas jedoch zu einem Festkörper kondensiert, erhöhen Dipol-Dipol-Wechselwirkungen zwischen polarisierten Spezies die Ladungstrennungen. Im Kristall wird daher ein Elektron vom Metall auf das Nichtmetall übertragen, und diese Substanzen verhalten sich wie klassische ionische Verbindungen. Die Daten in Abbildung \(\PageIndex{6}\) zeigen, dass zweiatomige Spezies mit einem Elektronegativitätsunterschied von weniger als 1,5 zu weniger als 50 % ionischen Charakter haben, was mit unserer früheren Beschreibung dieser Spezies als polare kovalente Bindungen übereinstimmt. Die Verwendung von Dipolmomenten zur Bestimmung des ionischen Charakters einer polaren Bindung wird in Beispiel \(\PageIndex{2}\) dargestellt.
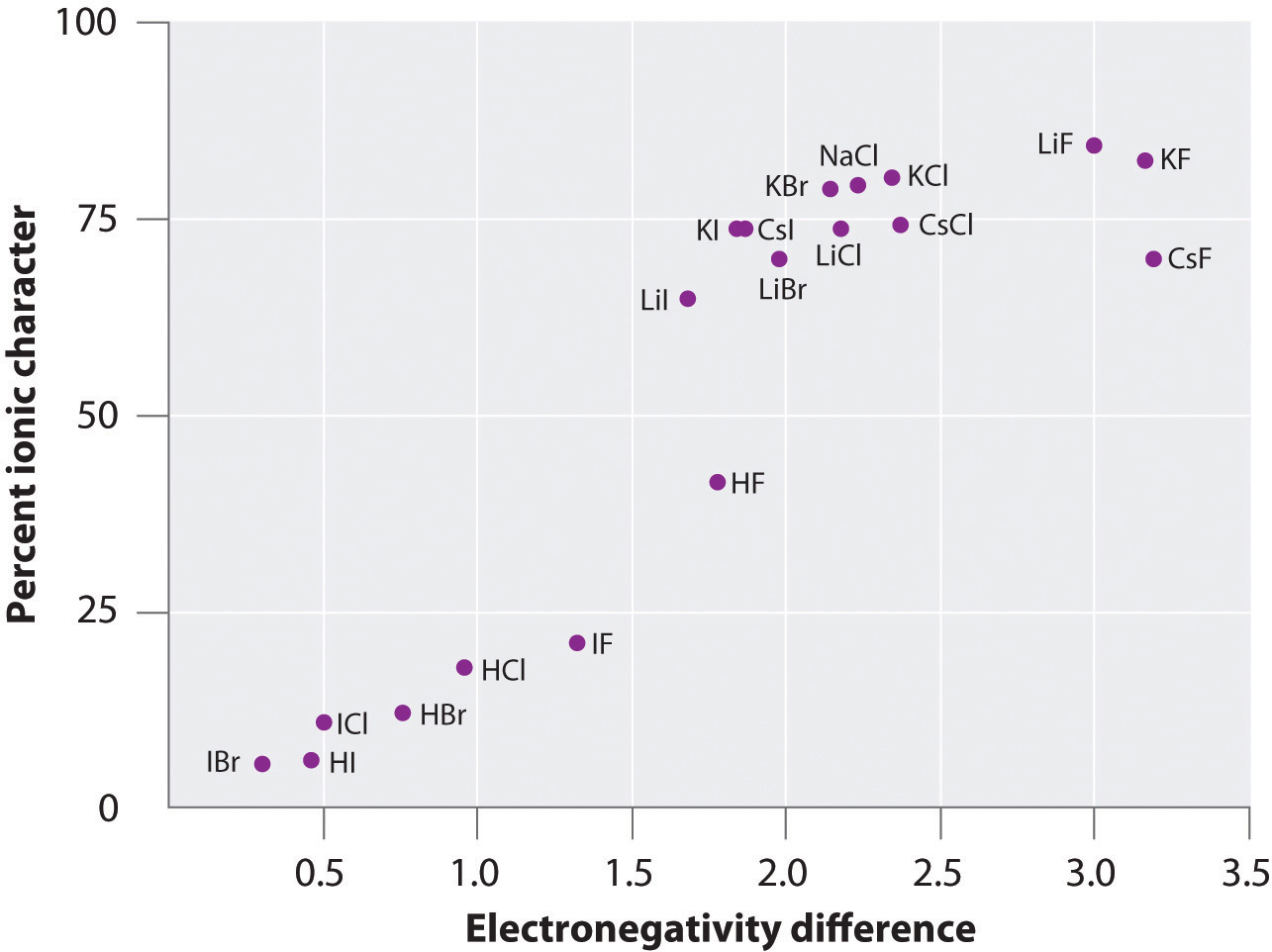
Abbildung \(\PageIndex{6}\): Ein Diagramm des prozentualen ionischen Charakters einer Bindung, wie er aus gemessenen Dipolmomenten gegenüber der Differenz der Elektronegativität der gebundenen Atome bestimmt wird.
In der Gasphase ist selbst CsF, das die größtmögliche Differenz der Elektronegativität zwischen den Atomen aufweist, nicht zu 100 % ionisch. Festes CsF ist jedoch aufgrund der zusätzlichen elektrostatischen Wechselwirkungen im Gitter am besten als 100% ionisch zu betrachten.
