Enthalpie
Die Thermodynamik ist die Lehre von der Beziehung zwischen Wärme (oder Energie) und Arbeit. Die Enthalpie ist ein zentraler Faktor in der Thermodynamik. Sie ist der Wärmeinhalt eines Systems. Die Wärme, die während einer Reaktion in das System hinein oder aus ihm heraus geht, ist die Enthalpieänderung. Ob die Enthalpie des Systems zunimmt (d.h. wenn Energie zugeführt wird) oder abnimmt (weil Energie abgegeben wird), ist ein entscheidender Faktor, der bestimmt, ob eine Reaktion stattfinden kann.
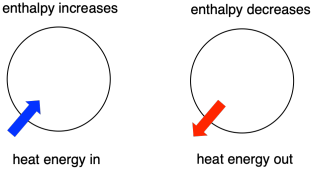
Manchmal nennen wir die Energie der Moleküle, die sich verändern, die „innere Enthalpie“. Manchmal nennen wir sie auch die „Enthalpie des Systems“. Diese beiden Ausdrücke beziehen sich auf dieselbe Sache. In ähnlicher Weise wird die Energie der Moleküle, die nicht an der Reaktion beteiligt sind, als „externe Enthalpie“ oder „Enthalpie der Umgebung“ bezeichnet.
Grob gesagt waren die Energieänderungen, die wir in der Einführung in die Thermodynamik betrachtet haben, Änderungen der Enthalpie. Wir werden im nächsten Abschnitt sehen, dass es einen weiteren energetischen Faktor gibt, die Entropie, die wir bei Reaktionen ebenfalls berücksichtigen müssen. Für den Moment werden wir nur die Enthalpie betrachten.
- Enthalpie ist der Wärmeinhalt eines Systems.
- Die Enthalpieänderung einer Reaktion entspricht in etwa der Menge an Energie, die während der Reaktion verloren oder gewonnen wird.
- Eine Reaktion ist begünstigt, wenn die Enthalpie des Systems während der Reaktion abnimmt.
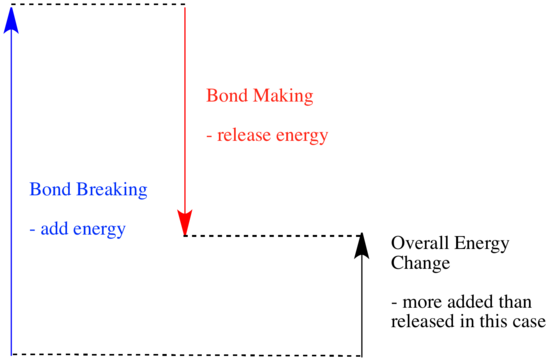
Diese letzte Aussage ähnelt sehr der Beschreibung der Energetik auf der vorherigen Seite. Wenn ein System eine Reaktion durchläuft und Energie abgibt, nimmt sein eigener Energiegehalt ab. Es hat weniger Energie übrig, wenn es etwas abgegeben hat. Warum ändert sich die Energie einer Gruppe von Molekülen, wenn eine Reaktion stattfindet? Um diese Frage zu beantworten, müssen wir uns überlegen, was bei einer chemischen Reaktion passiert.
Bei einer Reaktion kommt es zu einer Veränderung der chemischen Bindung. Einige der Bindungen in den Reaktanten werden gebrochen, und neue Bindungen werden gebildet, um die Produkte zu bilden. Es kostet Energie, Bindungen zu brechen, aber es wird Energie freigesetzt, wenn neue Bindungen gebildet werden.
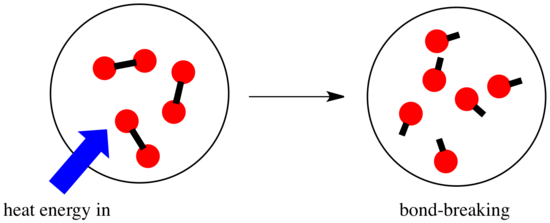
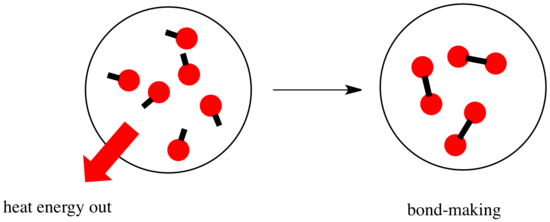
Ob eine Reaktion ablaufen kann, kann vom Gleichgewicht zwischen diesen Schritten des Bindungsaufbaus und des Bindungsabbaus abhängen.
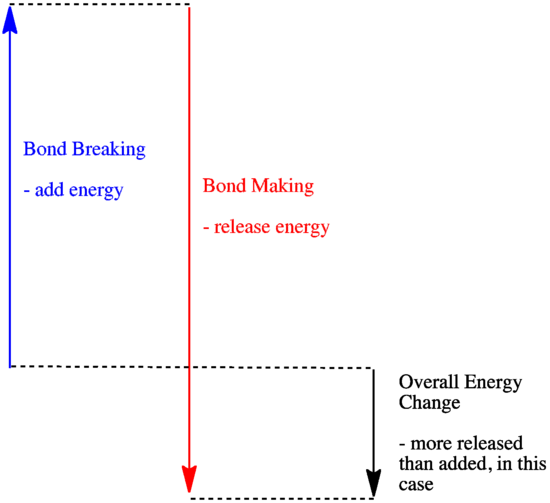
- Eine Reaktion ist exotherm, wenn durch die Bildung neuer Bindungen mehr Energie freigesetzt wird als durch das Aufbrechen alter Bindungen verbraucht wird.
- Eine Reaktion ist exotherm, wenn schwächere Bindungen gegen stärkere ausgetauscht werden.
- Eine Reaktion ist endotherm, wenn das Aufbrechen von Bindungen mehr Energie kostet, als beim Herstellen von Bindungen bereitgestellt wird.
Bindungsenergien (die Menge an Energie, die zugeführt werden muss, um eine Bindung aufzubrechen) sind ein wichtiger Faktor bei der Bestimmung, ob eine Reaktion stattfinden wird. Bindungsstärken sind nicht immer leicht vorherzusagen, weil die Stärke einer Bindung von einer Reihe von Faktoren abhängt. Viele Menschen haben jedoch viel Arbeit in die Messung von Bindungsstärken gesteckt und die Informationen in Tabellen gesammelt, so dass man, wenn man wissen will, wie stark eine Bindung ist, einfach die benötigten Informationen nachschlagen kann.
| Bindung | Bindungsenergie (kcal/mol) | Bindung | Bindungsenergie (kcal/mol) |
| H-H | 104 | O-H | 111 |
| C-C | 83 | C-H | 99 |
| O=O | 119 | N-H | 93 |
| N=N | 226 | C=O | 180 |
zum Beispiel, Angenommen, Sie möchten wissen, ob die Verbrennung von Methan eine exotherme oder endotherme Reaktion ist. Ich vermute, dass es sich um eine exotherme Reaktion handelt, denn diese Reaktion (und andere ähnliche) wird zur Wärmeversorgung vieler Haushalte durch die Verbrennung von Erdgas in Öfen genutzt.
Die „Verbrennung“ von Methan bedeutet, dass es an der Luft verbrannt wird, so dass es mit Sauerstoff reagiert. Die Produkte der Verbrennung von Kohlenwasserstoffen sind hauptsächlich Kohlendioxid und Wasser. Das Kohlenstoffatom in Methan (CH4) wird in ein Kohlendioxidmolekül eingebaut. Die Wasserstoffatome werden in Wassermoleküle eingebaut. Da Methan vier Wasserstoffatome enthält, reicht das aus, um zwei H2O-Moleküle zu bilden.
- Vier C-H-Bindungen müssen bei der Verbrennung von Methan gebrochen werden.
- Vier neue O-H-Bindungen werden gebildet, wenn die Wasserstoffatome aus Methan in neue Wassermoleküle eingebaut werden.
- Zwei neue C=O-Bindungen entstehen, wenn der Kohlenstoff aus Methan in ein CO2-Molekül eingebaut wird.
Das andere Teil des Puzzles ist die Sauerstoffquelle für die Reaktion. Sauerstoff ist in der Atmosphäre meist als O2 vorhanden. Da wir zwei Sauerstoffatome im CO2-Molekül und zwei weitere Sauerstoffatome für die beiden Wassermoleküle benötigen, brauchen wir insgesamt vier Sauerstoffatome für die Reaktion, die von zwei O2-Molekülen bereitgestellt werden könnten.
-
Zwei O=O-Bindungen müssen gebrochen werden, um die Sauerstoffatome für die Produkte bereitzustellen.
Insgesamt sind das vier gebrochene C-H- und zwei O=O-Bindungen, plus zwei C=O- und vier O-H-Bindungen. Das sind 4 x 99 kcal/mol für die C-H-Bindungen und 2 x 119 kcal/mol für die O=O-Bindungen, insgesamt also 634 kJ/mol. Die Reaktion setzt 2 x 180 kcal/mol für die C=O-Bindungen und 4 x 111 kcla/mol für die OH-Bindungen frei, insgesamt 804 kcal/mol. Insgesamt werden 170 kcal/mol mehr freigesetzt als verbraucht.
Das bedeutet, dass die Reaktion exotherm ist, also Wärme erzeugt. Das ist wahrscheinlich eine gute Möglichkeit, um dein Haus zu heizen.
