US Pharm. 2020;45(5)(Specialty&Oncology suppl):3-8.
ABSTRACT: In den letzten Jahren wurden mehrere neue zielgerichtete Therapieoptionen entwickelt, um die Resistenz gegen die traditionelle endokrine Therapie bei fortgeschrittenem Brustkrebs zu bekämpfen. Drei CDK4/6-Inhibitoren (Palbociclib, Ribociclib und Abemaciclib) wurden für Patientinnen mit Hormonrezeptor-positivem, humanem epidermalem Wachstumsfaktor-Rezeptor-2-negativem fortgeschrittenem Brustkrebs zugelassen. Jeder Wirkstoff hat seine Wirksamkeit unter Beweis gestellt, aber es gibt Unterschiede zwischen den drei Medikamenten, insbesondere in ihren Nebenwirkungsprofilen.
Brustkrebs ist die häufigste Krebsart bei Frauen, mit schätzungsweise mehr als 276.000 neuen Fällen im Jahr 2020.1 Hormonrezeptor-positiver (HR+) Brustkrebs, der mehr als 70 % dieser Fälle ausmacht, wurde in der Vergangenheit mit endokrinen Therapien (ET) wie selektiven Östrogenrezeptor-Hemmern und Aromatase-Inhibitoren (AIs) behandelt. Obwohl die ET nach wie vor das Rückgrat der Behandlung von HR+-Brustkrebs ist, entwickeln bis zu 50 % der Patientinnen mit fortgeschrittenem Brustkrebs eine Resistenz.2 Zur Bekämpfung der Resistenz wurden zielgerichtete Therapien für HR+-Brustkrebs zugelassen.3,4
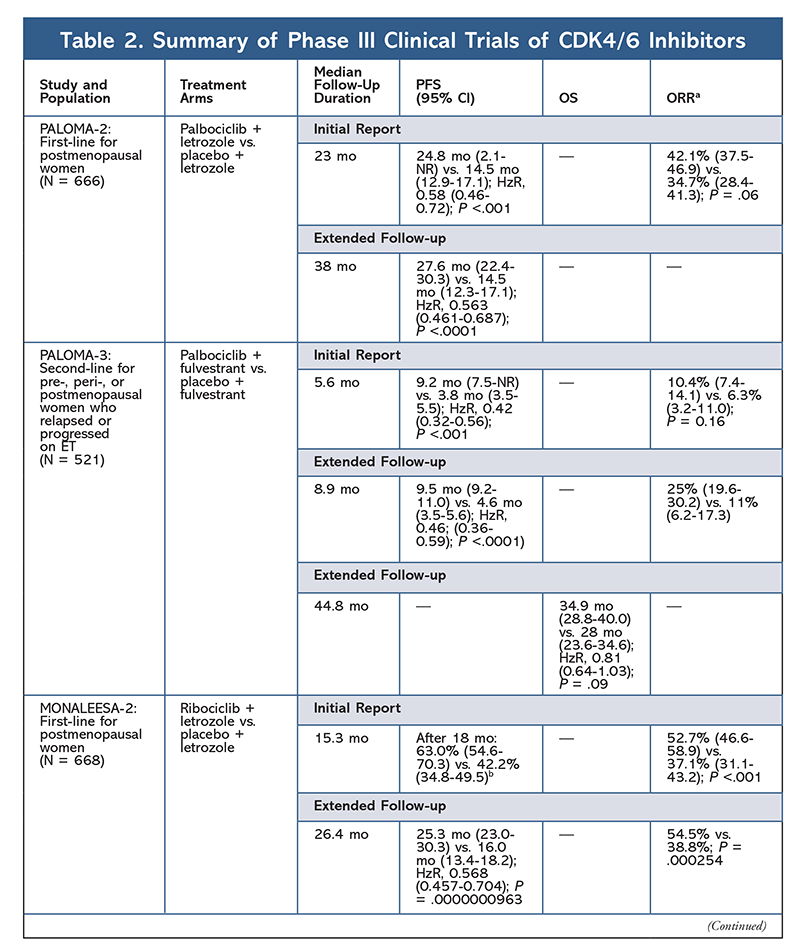
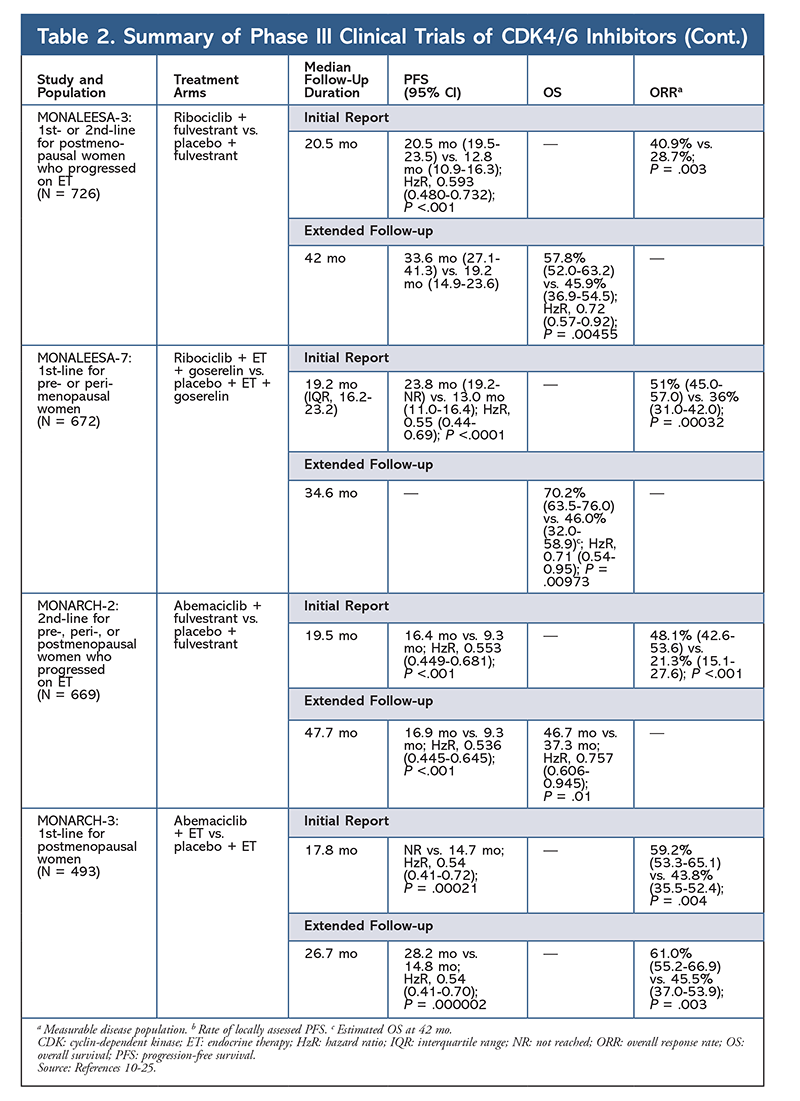
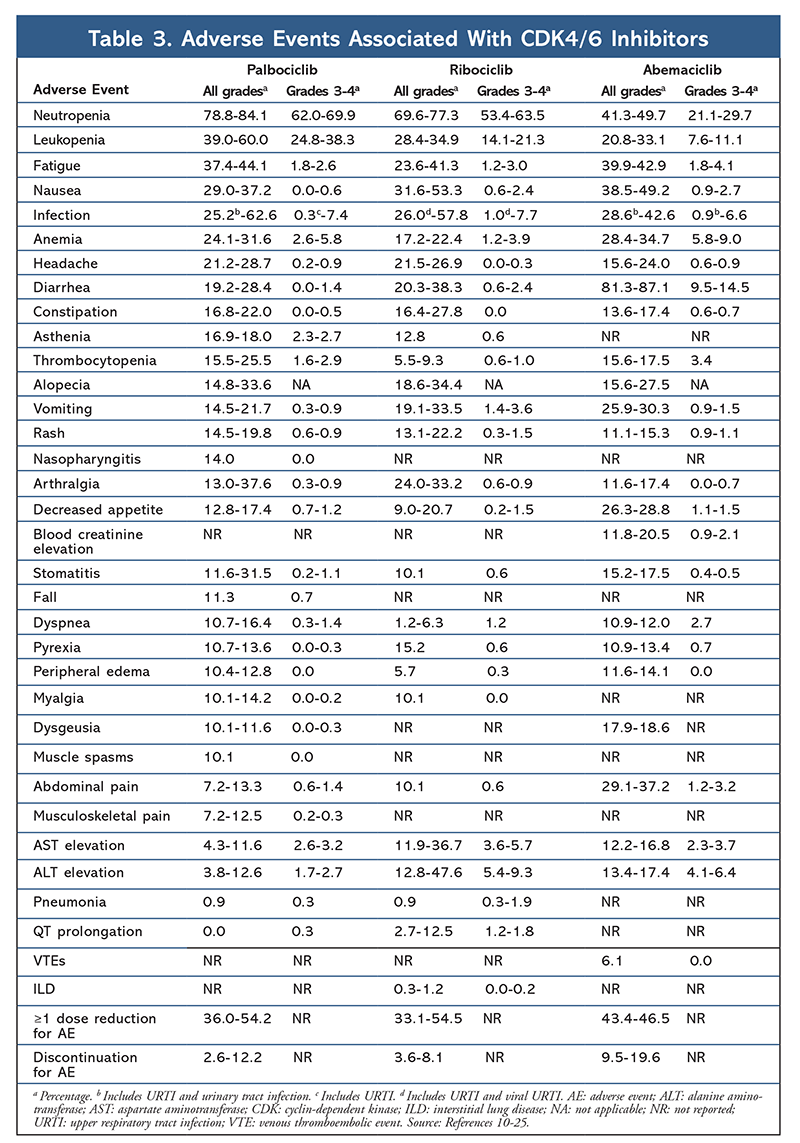
Cyclin-abhängige Kinase (CDK)-Inhibitoren, die neueste Wirkstoffklasse für fortgeschrittenen Brustkrebs, hemmen spezifisch CDK4/6-Proteine und blockieren den Übergang von der G1- zur S-Phase des Zellzyklus. Diese Medikamentenklasse hemmt die Kinaseaktivität, die den Retinoblastom-Proteinweg phosphoryliert. Durch die Blockierung dieses Weges sind CDK4/6-Inhibitoren in der Lage, die Zellzyklusprogression in der Mitte der G1-Phase zu blockieren und das Fortschreiten der Krebszellen zu verhindern. In den letzten Jahren wurden drei CDK4/6-Inhibitoren (Palbociclib, Ribociclib und Abemaciclib) als Kombinationstherapien für HR+, humanen epidermalen Wachstumsfaktor-Rezeptor 2-negativen (HER2-), fortgeschrittenen oder metastasierten Brustkrebs zugelassen.5-8 In diesem Artikel werden die Unterschiede zwischen diesen Wirkstoffen (TABELLE 1), die klinischen Studien der Phase III (TABELLE 2) und die Profile der unerwünschten Ereignisse (AE) (TABELLE 3) beschrieben.
Palbociclib
Im Jahr 2015 erhielt Palbociclib als erster CDK4/6-Inhibitor die FDA-Zulassung für die Behandlung von HR+, HER2-Brustkrebs (in Kombination mit einem AI als initiale ET bei postmenopausalen Frauen oder bei Männern oder in Kombination mit Fulvestrant bei Patientinnen mit Krankheitsprogression nach ET).6,9-14 Palbociclib wurde zunächst nach positiven Ergebnissen der Phase-II-Studie PALOMA-1 zugelassen, in der Palbociclib plus Letrozol mit Letrozol allein als Ersttherapie für ET-naive Patientinnen mit fortgeschrittenem Brustkrebs verglichen wurde.9
Diese Ergebnisse führten zu zwei Phase-III-Studien, in denen die Wirkung von Palbociclib in dieser Patientengruppe weiter untersucht wurde. Die ersten Ergebnisse der PALOMA-2-Studie bestätigten die Wirkung von Palbociclib plus Letrozol und zeigten ein verbessertes progressionsfreies Überleben (PFS) im Vergleich zu Letrozol allein (24,8 Monate bzw. 14,5 Monate; Hazard Ratio für Krankheitsprogression oder Tod 0,58; 95 % CI, 0,46-0,72; P <.001). Eine Langzeit-Follow-up-Studie nach 38 Monaten bestätigte die Wirkung von Palbociclib auf das PFS mit einem Anstieg auf 27,6 Monate gegenüber 14,5 Monaten unter Letrozol allein (HzR, 0,563; 95% CI, 0,461-0,687; P <.0001). Die Folgestudie berichtete auch über eine konsistente Verbesserung des PFS durch Palbociclib plus Letrozol in allen untersuchten Untergruppen sowie über eine Verzögerung der medianen Zeit bis zum Beginn einer nachfolgenden Therapie. Die Daten zum Gesamtüberleben (OS) für die Erst- und Folgestudie waren jedoch unausgereift, und die eingeschlossenen Patientinnen werden weiter beobachtet.10,11
Kurz nach dem Start von PALOMA-2 wurde eine weitere Phase-III-Studie, PALOMA-3, begonnen, um die Sicherheit und Wirksamkeit von Palbociclib plus Fulvestrant bei prä- oder postmenopausalen Frauen mit fortgeschrittenem HR+-Brustkrebs zu untersuchen, der unter der vorherigen ET fortgeschritten war. Der erste Bericht nach 5,6 Monaten Nachbeobachtung zeigte eine Verbesserung des medianen PFS (9,2 Monate vs. 3,8 Monate) mit einer 58%igen Verringerung der Progression (HzR, 0,42; 95% CI, 0,32-0,56; P <.001).12 Eine vordefinierte Analyse des OS in der PALOMA-3-Studie mit einer medianen Nachbeobachtung von 44.8 Monaten ergab, dass die Unterschiede im OS für die gesamte Intent-to-treat-Gruppe keine statistische Signifikanz erreichten, aber die Kombination verlängerte das OS um 10 Monate bei Patienten, die empfindlich auf vorherige ET reagierten.14
Das AE-Profil blieb in allen Studienberichten konsistent (TABELLE 3), wobei Neutropenie (78,8%-84,1%), Leukopenie (39%-60%) und Müdigkeit (37,4%-44,1%) die am häufigsten berichteten AEs waren. Die Rate der Neutropenien war hoch; febrile Neutropenien waren jedoch selten (bis zu 2 %). Die Gesamtverträglichkeit von Palbociclib wurde als überschaubar eingestuft, und der Wirkstoff führte zu positiven Daten zur Lebensqualität, wenn er in der Kombinationstherapie im Vergleich zur endokrinen Monotherapie eingesetzt wurde.9,14
Ribociclib
Ein zweiter CDK4/6-Inhibitor, Ribociclib, wurde 2017 von der FDA für eine breitere Patientengruppe zugelassen. Ribociclib ist für postmenopausale und prä- oder perimenopausale Frauen mit HR+, HER2-fortgeschrittenem oder metastasiertem Brustkrebs zugelassen (als Kombinationstherapie mit einem AI als initiale ET oder, bei postmenopausalen Frauen, in Kombination mit Fulvestrant als initiale ET oder nach Fortschreiten der Erkrankung unter ET).7
Ribociclib erhielt zunächst die FDA-Zulassung, nachdem in der MONALEESA-2-Studie festgestellt wurde, dass sich das PFS verbesserte, wenn das Medikament in Kombination mit Letrozol gegenüber Letrozol allein gegeben wurde. Die Raten des lokal bewerteten PFS gegenüber Letrozol allein betrugen nach 18 Monaten 63,0 % (95 % KI, 54,6-70,3) bzw. 42,2 % (95 % KI, 34,8-49,5).15 Ein erweiterter Follow-up-Bericht nach 26,4 Monaten belegte die Wirksamkeit und Verträglichkeit der Kombination weiter.16 Trotz der Verbesserung des PFS sind die OS-Daten für MONALEESA-2 noch nicht ausgereift.
Ribociclib wird auch (in MONALEESA-3) in Kombination mit Fulvestrant bei therapienaiven Patientinnen und solchen, die nach ET einen Rückfall erlitten haben, untersucht. Der erste Bericht zeigte ein verbessertes PFS für die Kombination im Vergleich zu Fulvestrant allein (20,5 Monate bzw. 12,8 Monate; HzR, 0,593; 95% CI, 0,480-0,732; P <.001), was zur FDA-Zulassung dieser Kombination führte.17 Ein zweiter und jüngster Bericht über CDK4/6-Inhibit, der 21,6 zusätzliche Monate Nachbeobachtung umfasste, zeigte die konsistente PFS-Verbesserung weiter. Dieser Bericht belegte auch den OS-Vorteil von Ribociclib plus Fulvestrant im Vergleich zu Fulvestrant allein, mit einem geschätzten OS nach 42 Monaten von 57,8 % bzw. 45,9 % und einer 28-prozentigen Verringerung des relativen Sterberisikos (HzR, 0,72; 95% CI, 0,57-0.92; P = .00455).18
Eine dritte klinische Studie, MONALEESA-7, ist derzeit die einzige Phase-III-Studie, in der die Wirksamkeit und Sicherheit eines CDK4/6-Hemmers als Erstlinientherapie bei prä- oder perimenopausalen Frauen mit metastasiertem Brustkrebs untersucht wird. In dieser Studie verbesserte Ribociclib plus Tamoxifen oder eine nichtsteroidale AI (NSAI) – wie Letrozol oder Anastrozol – plus Goserelin das PFS signifikant um 23,8 Monate gegenüber 13 Monaten in der Placebogruppe (HzR, 0,55; 95% CI, 0,44-0,69; P <.0001), und die Kombination führte zur Erweiterung der Indikation auf prä- und perimenopausale Frauen.19 Ein Bericht über eine erweiterte Nachbeobachtung zeigte den Vorteil der Kombination von Ribociclib plus Tamoxifen oder einem NSAI plus Goserelin im Vergleich zu Placebo mit einer geschätzten 42-monatigen Gesamtüberlebenszeit von 70,2 % gegenüber 46,0 %.20
Das Toxizitätsprofil von Ribociclib ist dem von Palbociclib sehr ähnlich, wobei Neutropenie und Leukopenie die am häufigsten gemeldeten schwerwiegenden (Grad 3/4) Nebenwirkungen sind, wenn auch in geringerem Umfang als bei Palbociclib (TABELLE 3).15-20 Febrile Neutropenien waren selten, und in keinem der Berichte über die erweiterte Nachbeobachtung traten bei längerer Exposition gegenüber Ribociclib neue Sicherheitsbedenken auf.
Abemaciclib
Der dritte CDK4/6-Inhibitor, der von der FDA zugelassen wurde, ist Abemaciclib. Dieser Wirkstoff ist in Kombination mit einem AI als initiale ET bei postmenopausalen Frauen mit fortgeschrittenem Brustkrebs oder in Kombination mit Fulvestrant bei prä-, peri- oder postmenopausalen Frauen mit Fortschreiten der Erkrankung nach ET angezeigt. Abemaciclib ist auch als Monotherapie bei Männern und Frauen mit Fortschreiten der Erkrankung nach ET und vorheriger Chemotherapie im metastasierten Stadium zugelassen.6 Die Zulassung des Wirkstoffs basierte zunächst auf den Ergebnissen der MONARCH-1-Studie, die nach 12 Monaten eine vielversprechende klinische Aktivität mit einer Gesamtansprechrate (ORR) von 19,7 % (95 % KI, 13,3-27,5) und einem medianen PFS von 6 Monaten zeigte.5,21 Während dieser Zeit wurde Abemaciclib auch in der MONARCH-2-Studie für prä-, peri- und postmenopausale Frauen mit Fortschreiten der Erkrankung nach ET untersucht. Diese Studie zeigte einen statistisch signifikanten PFS-Vorteil für die Kombination von Abemaciclib plus Fulvestrant im Vergleich zu Fulvestrant allein (16,4 Monate vs. 9,3 Monate; HzR, 0,553; 95% CI, 0,449-0,681; P <.001).22 Eine erweiterte Follow-up-Studie mit einer medianen Dauer von 47.7 Monaten berichtete über leicht verbesserte PFS-Ergebnisse und einen OS-Vorteil der Abemaciclib-Kombination im Vergleich zu Placebo und Fulvestrant (46,7 Monate vs. 37,3 Monate; 95% CI, 0,606-0,945; P = .01).23
Kurz nach Beginn der beiden Abemaciclib-Studien wurde MONARCH-3 gestartet. Diese Studie ergab eine statistisch signifikante Verbesserung des PFS und der ORR mit Abemaciclib plus einem NSAI im Vergleich zum Placebo-plus-NSAI-Arm als Erstlinienbehandlung für postmenopausale Frauen. Ein aktualisierter Bericht mit 8,9 Monaten zusätzlicher Nachbeobachtungszeit bestätigte die PFS- und ORR-Ergebnisse der ersten Analyse; die OS-Daten sind jedoch noch nicht ausgereift, und die endgültige OS-Analyse wird nach 315 Ereignissen durchgeführt.24,25
Insgesamt wurde festgestellt, dass Abemaciclib der wirksamste CDK4/6-Hemmer ist, der aufgrund seiner Struktur eine ausgezeichnete Aktivität im zentralen Nervensystem aufweist, die es ihm ermöglicht, die Blut-Hirn-Schranke zu überwinden und länger am Zielort zu verbleiben.5 Dies kann für Patienten mit Hirnmetastasen von Vorteil sein. Obwohl Abemaciclib auch einen hohen Prozentsatz an hämatologischen Nebenwirkungen aufweist, sind diese Raten viel niedriger als bei anderen CDK4/6-Hemmern. Abemaciclib wird mit mehr gastrointestinalen Toxizitäten, wie z. B. Durchfall, in Verbindung gebracht als andere CDK4/6-Hemmer (alle Grade: 81,3 %-87,1 %; Grade 3-4: 9,5 %-14,5 %).22-25
Die Rolle des Apothekers
Insgesamt sind die AE-Profile der verschiedenen CDK4/6-Hemmer ähnlich, aber jedes Medikament hat einzigartige AEs. Die häufigsten Nebenwirkungen von CDK4/6-Inhibitoren sind Neutropenie, Leukopenie, Müdigkeit, Übelkeit, Infektionen, Arthralgie, Anämie, Kopfschmerzen und Diarrhö (TABELLE 3). Abgesehen von Neutropenie und Leukopenie berichteten die meisten Patienten über SARs des Grades 1 oder 2. Neutropenie und Leukopenie des Grades 3 oder 4, die bei allen CDK-Inhibitoren, insbesondere bei Palbociclib und Ribociclib, sehr häufig auftraten, wurden meist mit einer Dosisunterbrechung und/oder -reduktion behandelt. Das Blutbild des Patienten sollte zu Beginn der Behandlung, alle zwei Wochen während der ersten beiden Zyklen, zu Beginn der folgenden vier Zyklen und bei klinischer Notwendigkeit zur Knochenmarksuppression kontrolliert werden.6-8 Stürze, Muskelkrämpfe und Nasopharyngitis werden mit Palbociclib in Verbindung gebracht, sind aber in den meisten Fällen harmlos.10,11,14 Unter Ribociclib wurde eine geringe Häufigkeit von QT-Verlängerungen berichtet.15-20 Abemaciclib wurde mit einer signifikant höheren Häufigkeit von Durchfall im Vergleich zu Palbociclib und Ribociclib in Verbindung gebracht; die Fälle traten meist während des ersten Zyklus auf und konnten mit einer antidiarrhoischen Therapie behandelt werden.22-25 Abemaciclib wurde mit einer Erhöhung des Serumkreatinins und venösen thromboembolischen Ereignissen (meist leicht) in Verbindung gebracht, die für Palbociclib und Ribociclib nicht berichtet wurden, sowie mit einer höheren Inzidenz von Bauchschmerzen.22-25 Insbesondere warnte die FDA im September 2019, dass bei Patienten, die mit CDK4/6-Hemmern behandelt werden, seltene, aber schwere, lebensbedrohliche oder tödliche interstitielle Lungenerkrankungen (ILD) und Pneumonitis auftreten können.26 Daher sollten die Patienten regelmäßig auf pulmonale Symptome, die auf ILD und/oder Pneumonitis hinweisen, überwacht werden.
Schlussfolgerung
Die Zulassungen von Palbociclib, Ribociclib und Abemaciclib in den letzten Jahren haben die Behandlungsmöglichkeiten für Patienten mit fortgeschrittenem Brustkrebs erweitert. Obwohl sie alle den gleichen Wirkmechanismus besitzen, weisen diese Medikamente leichte Unterschiede in der Wirksamkeit und Sicherheit auf. In einer Reihe laufender Studien, die über die in dieser Übersichtsarbeit genannten hinausgehen, werden diese Inhibitoren in verschiedenen Patientengruppen und mit unterschiedlichen Behandlungskombinationen weiter untersucht. Das Potenzial dieser Wirkstoffe, den Einsatz von CDK4/6-Inhibitoren auf andere Indikationen als HR+, HER2-fortgeschrittenen Brustkrebs auszuweiten, erscheint vielversprechend.27
1. Siegel RL, Miller KD, Jemal A. Cancer statistics, 2020. CA Cancer J Clin. 2020;70(1):7-30.
2. Preusser M, De Mattos-Arruda L, Thill M, et al. CDK4/6 inhibitors in the treatment of patients with breast cancer: summary of a multidisciplinary round-table discussion. ESMO Open. 2018;3(5):e000368.
3. Tripathy D, Bardia A, Sellers WR. Ribociclib (LEE011): Wirkmechanismus und klinische Auswirkungen dieses selektiven Cyclin-abhängigen Kinase 4/6-Inhibitors bei verschiedenen soliden Tumoren. Clin Cancer Res. 2017;23(13):3251-3262.
4. Portman N, Alexandrou S, Carson E, et al. Overcoming CDK4/6 inhibitor resistance in ER-positive breast cancer. Endocr Relat Cancer. 2019;26(1):R15-R30.
5. Sobhani N, D’Angelo A, Pittacolo M, et al. Updates on the CDK4/6 inhibitory strategy and combinations in breast cancer. Cells. 2019;8(4):E321.
6. Ibrance (Palbociclib) package insert. New York, NY: Pfizer Inc; September 2019.
7. Kisqali (ribociclib) package insert. East Hanover, NJ: Novartis Pharmaceuticals Corp; September 2019.
8. Verzenio (Abemaciclib) package insert. Indianapolis, IN: Eli Lilly and Co; September 2019.
9. Finn RS, Crown JP, Lang I, et al. The cyclin-dependent kinase 4/6 inhibitor palbociclib in combination with letrozole versus letrozole alone as first-line treatment of oestrogen receptor-positive, HER2-negative, advanced breast cancer (PALOMA-1/TRIO-18): a randomised phase 2 study. Lancet Oncol. 2015;16(1):25-35.
10. Finn RS, Martin M, Rugo HS, et al. Palbociclib and letrozole in advanced breast cancer. N Engl J Med. 2016;375(20):1925-1936.
11. Rugo HS, Finn RS, Diéras V, et al. Palbociclib plus Letrozol als Erstlinientherapie bei Östrogenrezeptor-positivem/humanem epidermalem Wachstumsfaktor-Rezeptor-2-negativem fortgeschrittenem Brustkrebs mit erweitertem Follow-up. Breast Cancer Res Treat. 2019;174(3):719-729.
12. Turner NC, Ro J, André F, et al. Palbociclib in hormone-receptor-positive advanced breast cancer. N Engl J Med. 2015;373(3):209-219.
13. Cristofanilli M, Turner NC, Bondarenko I, et al. Fulvestrant plus Palbociclib versus Fulvestrant plus Placebo zur Behandlung von Hormonrezeptor-positivem, HER2-negativem metastasiertem Brustkrebs, der unter vorheriger endokriner Therapie fortgeschritten ist (PALOMA-3): abschließende Analyse der multizentrischen, doppelblinden, randomisierten kontrollierten Phase-3-Studie. Lancet Oncol. 2016;17(4):425-439.
14. Turner NC, Slamon DJ, Ro J, et al. Gesamtüberleben mit Palbociclib und Fulvestrant bei fortgeschrittenem Brustkrebs. N Engl J Med. 2018;379(20):1926-1936.
15. Hortobagyi GN, Stemmer SM, Burris HA, et al. Ribociclib als Erstlinientherapie bei HR-positivem, fortgeschrittenem Brustkrebs. N Engl J Med. 2016;375(18):1738-1748.
16. Hortobagyi GN, Stemmer SM, Burris HA, et al. Aktualisierte Ergebnisse von MONALEESA-2, einer Phase-III-Studie zur Erstlinientherapie von Ribociclib plus Letrozol gegenüber Placebo plus Letrozol bei Hormonrezeptor-positivem, HER2-negativem fortgeschrittenem Brustkrebs. Ann Oncol. 2018;29(7):1541-1547.
17. Slamon DJ, Neven P, Chia S, et al. Randomisierte Phase-III-Studie von Ribociclib und Fulvestrant bei Hormonrezeptor-positivem, humanem epidermalem Wachstumsfaktor-Rezeptor-2-negativem fortgeschrittenem Brustkrebs: MONALEESA-3. J Clin Oncol. 2018;36(24):2465-2472.
18. Slamon DJ, Neven P, Chia S, et al. Overall survival with ribociclib plus fulvestrant in advanced breast cancer. N Engl J Med. 2020;382(6):514-524.
19. Tripathy D, Im SA, Colleoni M, et al. Ribociclib plus endokrine Therapie für prämenopausale Frauen mit Hormonrezeptor-positivem, fortgeschrittenem Brustkrebs (MONALEESA-7): eine randomisierte Phase-3-Studie. Lancet Oncol. 2018;19(7):904-915.
20. Im SA, Lu YS, Bardia A, et al. Overall survival with ribociclib plus endocrine therapy in breast cancer. N Engl J Med. 2019;381(4):307-316.
21. Dickler MN, Tolaney SM, Rugo HS, et al. MONARCH 1, a phase II study of abemaciclib, a CDK4 and CDK6 inhibitor, as a single agent, in patients with refractory HR+/HER2- metastatic breast cancer. Clin Cancer Res. 2017;23(17):5218-5224.
22. Sledge GW Jr, Toi M, Neven P, et al. MONARCH 2: Abemaciclib in Kombination mit Fulvestrant bei Frauen mit HR+/HER2- fortgeschrittenem Brustkrebs, der unter endokriner Therapie fortgeschritten war. J Clin Oncol. 2017;35(25):2875-2884.
23. Sledge GW Jr, Toi M, Neven P, et al. The effect of abemaciclib plus fulvestrant on overall survival in hormone receptor-positive, ERBB2-negative breast cancer that progressed on endocrine therapy-MONARCH 2: a randomized clinical trial. JAMA Oncol. 2020;6(1):116-124.
24. Goetz MP, Toi M, Campone M, et al. MONARCH 3: Abemaciclib als Ersttherapie bei fortgeschrittenem Brustkrebs. J Clin Oncol. 2017;35(32):3638-3646.
25. Johnston S, Martin M, Di Leo A, et al. MONARCH 3 final PFS: a randomized study of abemaciclib as initial therapy for advanced breast cancer. NPJ Breast Cancer. 2019;17(5):5.
26. FDA. FDA warnt vor seltener, aber schwerer Lungenentzündung unter Ibrance, Kisqali und Verzenio bei Brustkrebs. www.fda.gov/drugs/drug-safety-and-availability/fda-warns-about-rare-severe-lung-inflammation-ibrance-kisqali-and-verzenio-breast-cancer. Accessed January 15, 2020.
27. Shah M, Nunes MR, Stearns V. CDK4/6-Inhibitoren: Wendepunkte in der Behandlung von Hormonrezeptor-positivem fortgeschrittenem Brustkrebs? Oncology (Williston Park). 2018;32(5):216-222.
Der in diesem Artikel enthaltene Inhalt dient nur zu Informationszwecken. Der Inhalt ist nicht als Ersatz für eine professionelle Beratung gedacht. Das Vertrauen in die in diesem Artikel enthaltenen Informationen erfolgt ausschließlich auf eigenes Risiko.
