Generischer Name: Indocyanin Grün
Dosierungsform: Injektion, Pulver, lyophilisiert, für Lösung
Medizinisch geprüft von Drugs.com. Last updated on Oct 1, 2020.
- Nebenwirkungen
- Dosierung
- Fachkundige
- Interaktionen
- Schwangerschaft
- Mehr
Indikationen und Anwendung für IC-Green
IC-Green® ist indiziert:
Zur Bestimmung des Herzzeitvolumens, der Leberfunktion und des Leberblutflusses
IC-Green Dosierung und Verabreichung
Indikatorverdünnungsstudien
Bei der Durchführung von Farbstoffverdünnungskurven wird eine bekannte Farbstoffmenge als einmaliger Bolus so schnell wie möglich über einen Herzkatheter in ausgewählte Stellen im Gefäßsystem injiziert. Ein Aufzeichnungsgerät (Oximeter oder Densitometer) wird an einer Nadel oder einem Katheter befestigt, um das Farbstoff-Blut-Gemisch an einer systemischen arteriellen Entnahmestelle zu entnehmen.
Unter sterilen Bedingungen sollte das IC-Green®-Pulver mit dem für dieses Produkt vorgesehenen sterilen Wasser für Injektionszwecke (USP) aufgelöst und die Lösung innerhalb von 6 Stunden nach ihrer Herstellung verwendet werden. Wenn ein Präzipitat vorhanden ist, ist die Lösung zu verwerfen.
Die üblichen Dosen von IC-Green® für Verdünnungskurven sind wie folgt:
Erwachsene – 5,0 mg
Kinder – 2,5 mg
Kleinkinder – 1,25 mg
Diese Dosen des Farbstoffs werden normalerweise in 1 ml Volumen injiziert. Bei der Durchführung einer diagnostischen Herzkatheteruntersuchung werden durchschnittlich fünf Verdünnungskurven empfohlen. Die Gesamtdosis des injizierten Farbstoffs sollte unter 2 mg/kg gehalten werden.
Während steriles Wasser für Injektionszwecke zum Spülen der Spritze verwendet werden kann, sollte isotonische Kochsalzlösung verwendet werden, um den restlichen Farbstoff aus dem Herzkatheter in den Kreislauf zu spülen, um eine Hämolyse zu vermeiden. Mit Ausnahme der Spülung der Farbstoffinjektionsspritze sollte bei allen anderen Teilen des Katheterisierungsverfahrens Kochsalzlösung verwendet werden.
Kalibrierung der Farbstoffkurven: Um die Verdünnungskurven zu quantifizieren, werden Standardverdünnungen von IC-Green® in Vollblut wie folgt hergestellt. Es wird dringend empfohlen, für die Herstellung dieser Standardverdünnungen denselben Farbstoff zu verwenden, der auch für die Injektionen verwendet wurde. Die am stärksten konzentrierte Farbstofflösung wird durch genaues Verdünnen von 1 mL des 5 mg/mL Farbstoffs mit 7 mL destilliertem Wasser hergestellt. Diese Konzentration wird dann sukzessive halbiert, indem 4 mL der vorherigen Konzentration mit 4 mL destilliertem Wasser verdünnt werden.
Wurde für die Verdünnungskurven eine Konzentration von 2,5 mg/mL verwendet, so wird 1 mL des 2,5 mg/mL-Farbstoffs zu 3 mL destilliertem Wasser gegeben, um die höchstkonzentrierte „Standard“-Lösung herzustellen. Diese Konzentration wird dann sukzessive halbiert, indem 2 mL der vorherigen Konzentration mit 2 mL destilliertem Wasser verdünnt werden.
Dann werden 0,2 mL dieser Farbstofflösungen (genau abgemessen mit einer kalibrierten Spritze) zu 5 mL Aliquots des Blutes der Versuchsperson hinzugefügt, wodurch sich Endkonzentrationen des Farbstoffs im Blut ergeben, die ungefähr bei 24,0 mg/Liter beginnen (die tatsächliche Konzentration hängt von der genauen Menge des zugegebenen Farbstoffs ab). Diese Konzentration wird natürlich in den folgenden Aliquoten des Blutes der Testperson sukzessive halbiert. Diese Blutaliquots mit bekannten Farbstoffmengen sowie eine Leerprobe, der 0,2 ml Kochsalzlösung ohne Farbstoff zugesetzt wurde, werden dann durch das Detektionsgerät geleitet, und aus den aufgezeichneten Ausschlägen wird eine Kalibrierungskurve erstellt.
Untersuchungen der Leberfunktion
Aufgrund seines Absorptionsspektrums können wechselnde Konzentrationen von IC-Green® (Indocyaningrün für Injektionszwecke) im Blut durch Ohrdichtemessung oder durch Entnahme von Blutproben in zeitlichen Abständen überwacht werden. Die Technik für beide Methoden ist wie folgt:
Der Patient sollte nüchtern und im Grundzustand untersucht werden. Der Patient sollte gewogen und die Dosierung auf der Basis von 0,5 mg/kg Körpergewicht berechnet werden.
Unter sterilen Bedingungen sollte das IC-Green®-Pulver mit dem mitgelieferten sterilen Wasser für Injektionszwecke, USP, aufgelöst werden. Genau 5 mL steriles Wasser für Injektionszwecke, USP, sollten zu der 25-mg-Flasche hinzugefügt werden, um 5 mg Farbstoff pro mL Lösung zu erhalten.
Die berechnete Farbstoffmenge (0,5 mg/kg Körpergewicht) so schnell wie möglich in das Lumen einer Armvene injizieren, ohne dass der Farbstoff aus der Vene austritt. (Bei der photometrischen Methode werden vor der Injektion von IC-Green® 6 ml venöses Blut aus dem Arm des Patienten entnommen, um einen Serumleerwert und eine Standardkurve zu erstellen, und durch dieselbe Nadel wird die korrekte Farbstoffmenge injiziert.)
Ohrendichtemessung: Die Ohrdichtemessung wurde ebenfalls eingesetzt und ermöglicht die Überwachung des Auftretens und Verschwindens von IC-Green®, ohne dass zur Kalibrierung Blutproben entnommen und spektrophotometrisch analysiert werden müssen. Es sollte ein Ohr-Densitometer verwendet werden, das über eine kompensatorische photoelektrische Zelle zur Korrektur von Änderungen des Blutvolumens und des Hämatokrits sowie über eine Detektionsphotozelle verfügt, die die Werte registriert. Dieses Gerät ermöglicht die gleichzeitige Messung des Herzzeitvolumens, des Blutvolumens und der hepatischen Clearance von IC-Green®*. Diese Technik wurde bei Neugeborenen, gesunden Erwachsenen sowie bei Kindern und Erwachsenen mit Lebererkrankungen eingesetzt. Der normale Proband hat eine Ausscheidungsrate von 18 bis 24 % pro Minute. Da keine extrahepatische Entnahme stattfindet, wurde IC-Green® als geeignet für die serielle Untersuchung schwerer chronischer Lebererkrankungen und für die stabile Messung des Leberblutflusses befunden. In höheren Dosen kann IC-Green® zum Nachweis von arzneimittelinduzierten Veränderungen der Leberfunktion und zum Nachweis einer leichten Leberschädigung verwendet werden.
Bei Verwendung des Ohr-Densitometers ergibt eine Dosis von 0,5 mg/kg bei normalen Probanden das folgende Clearance-Muster.
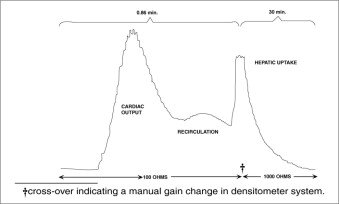
*Dichromatisches Ohrstück-Densitometer, geliefert von The Waters Company, Rochester, Minnesota.
Photometrische Methode –
Bestimmung anhand der prozentualen Retention des Farbstoffs:
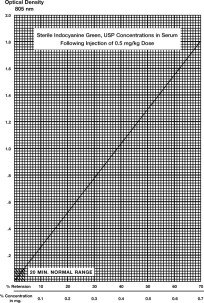
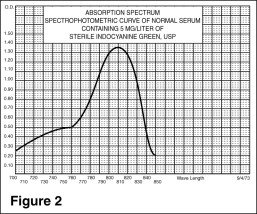
Eine typische Kurve, die durch Auftragen der Farbstoffkonzentration gegen die optische Dichte erhalten wird, ist dargestellt. Die prozentuale Retention kann an dieser Kurve abgelesen werden. Wenn genauere Ergebnisse erwünscht sind, kann eine Kurve mit dem Blut des Patienten und dem Fläschchen mit IC-Green®, das für die Bestimmung verwendet wird, wie folgt erstellt werden:
- Entnehmen Sie 6 ml nicht farbstoffhaltiges venöses Blut aus dem Arm des Patienten. In ein Reagenzglas geben und das Blut gerinnen lassen. Das Serum sollte durch Zentrifugation abgetrennt werden.
- 1 mL des Serums in eine Mikroküvette pipettieren.
- 1 Lambda (λ) der 5 mg/mL wässrigen IC-Green®-Lösung (steriles Indocyaningrün) zum Serum geben, was eine Verdünnung von 5 mg/Liter ergibt, dem Standard für 50 % Retention. (Die Zugabe von 2 lambda (λ) der 5 mg/mL IC-Green®-Lösung würde eine 100%ige Retention ergeben; diese Konzentration kann jedoch nicht auf dem Spektralphotometer abgelesen werden.)
- Die optische Dichte dieser Lösung sollte bei 805 nm abgelesen werden, wobei normales Serum als Blindwert verwendet wird.
- Mit Hilfe von Millimeterpapier, das dem in der Abbildung verwendeten ähnelt, wird der in Schritt 4 erhaltene Wert von 50 % aufgetragen und eine Linie gezogen, die diesen Punkt mit den Nullkoordinaten verbindet.
Prozentuale Retention: Eine einzelne 20-Minuten-Probe (aus einer Vene des gegenüberliegenden Arms entnommen) wird entnommen, gerinnen gelassen, zentrifugiert und die optische Dichte bei 805 nm bestimmt, wobei das normale Serum des Patienten als Blindprobe verwendet wird. Die Farbstoffkonzentration kann an der obigen Kurve abgelesen werden. Eine einzelne 20-Minuten-Probe des Serums gesunder Personen sollte nicht mehr als 4 % der ursprünglichen Farbstoffkonzentration enthalten. Die Verwendung der prozentualen Retention ist weniger genau als die prozentuale Verschwindungsrate. Es ist nicht zu erwarten, dass eine Hämolyse die Messung stört.
Bestimmung anhand der Verschwindungsrate des Farbstoffs: Zur Berechnung der prozentualen Verschwindungsrate werden 5, 10, 15 und 20 Minuten nach Injektion des Farbstoffs Proben entnommen. Bereiten Sie die Probe wie im vorherigen Abschnitt beschrieben vor und messen Sie die optischen Dichten bei 805 nm, wobei das normale Serum des Patienten als Leerwert verwendet wird. Die IC-Green®-Konzentration in jeder zeitlich festgelegten Probe sollte anhand der abgebildeten Konzentrationskurve bestimmt werden. Die Werte sollten auf semilogarithmischem Papier aufgetragen werden.
Proben, die IC-Green® enthalten, sollten bei derselben Temperatur abgelesen werden, da die optische Dichte durch Temperaturschwankungen beeinflusst wird.
Normalwerte: Die prozentuale Verschwindungsrate bei gesunden Personen beträgt 18 bis 24 % pro Minute. Die normale biologische Halbwertszeit beträgt 2,5 bis 3,0 Minuten.
Ophthalmologische Angiographiestudien
Die Anregungs- und Emissionsspektren (Abbildung 1) und die Absorptionsspektren (Abbildung 2) von IC-Green® machen es für die ophthalmologische Angiographie nützlich.
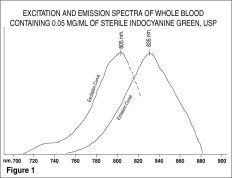
Abhängig von der verwendeten Bildgebungsausrüstung und -technik sollten Dosierungen von bis zu 40 mg IC-Green®-Farbstoff in 2 ml sterilem Wasser für Injektionszwecke, USP, verwendet werden. Ein IC-Green®-Farbstoffbolus kann in die Vena antekubitalis injiziert werden und sollte sofort von einem 5-mL-Bolus normaler Kochsalzlösung gefolgt werden.
Dosierungsformen und Stärken
IC-Green® ist ein steriles, lyophilisiertes grünes Pulver, das 25 mg Indocyaningrün mit nicht mehr als 5% Natriumiodid enthält.
Kontraindikationen
IC-Green® enthält Natriumjodid und sollte bei Patienten, die in der Vergangenheit auf Jodide allergisch reagiert haben, wegen des Risikos einer Anaphylaxie nur mit Vorsicht angewendet werden.
Warnungen und Vorsichtsmaßnahmen
Anaphylaxie
Todesfälle durch Anaphylaxie wurden nach der Verabreichung von IC-Green® während einer Herzkatheterisierung berichtet.
Instabilität des Arzneimittels
IC-Green® ist in wässriger Lösung instabil und muss innerhalb von 6 Stunden verwendet werden. Der Farbstoff ist jedoch in Plasma und Vollblut stabil, so dass Proben, die mit diskontinuierlichen Entnahmetechniken gewonnen wurden, Stunden später abgelesen werden können. Sowohl bei der Handhabung der Farbstofflösung als auch bei der Erstellung der Verdünnungskurven sollten sterile Verfahren angewandt werden. Falls ein Präzipitat auftritt, ist die Lösung zu verwerfen.
Wechselwirkungen zwischen Arzneimitteln und Labortests
Radioaktive Jodaufnahmestudien sollten frühestens eine Woche nach der Anwendung von IC-Green® durchgeführt werden.
Nebenwirkungen
Anaphylaktische oder urtikarielle Reaktionen wurden bei Patienten mit oder ohne Allergie gegen Jodide berichtet. Falls solche Reaktionen auftreten, sind sie mit den entsprechenden Mitteln zu behandeln, z. B.,
Arzneimittelinteraktionen
Natriumbisulfit-haltige Präparate, einschließlich einiger Heparinprodukte, vermindern die Absorptionsspitze von IC-Green® im Blut und sollten daher nicht als Antikoagulans bei der Entnahme von Proben zur Analyse verwendet werden.
VERWENDUNG IN BESONDEREN POPULATIONEN
Schwangerschaft
Tierreproduktionsstudien wurden mit IC-Green® nicht durchgeführt. Es ist auch nicht bekannt, ob IC-Green® bei Verabreichung an eine schwangere Frau den Fötus schädigen oder die Fortpflanzungsfähigkeit beeinträchtigen kann. IC-Green® sollte einer schwangeren Frau nur bei eindeutiger Indikation verabreicht werden.
Stillende Mütter
Es ist nicht bekannt, ob dieses Arzneimittel in die menschliche Milch ausgeschieden wird. Da viele Arzneimittel in die Muttermilch ausgeschieden werden, ist bei der Verabreichung von IC-Green® an eine stillende Frau Vorsicht geboten.
Anwendung bei Kindern
Die Sicherheit und Wirksamkeit bei pädiatrischen Patienten ist nachgewiesen. Siehe ANWENDUNG UND VERABREICHUNG (2) für spezifische Dosierungsinformationen bei pädiatrischen Patienten.
Geriatrische Anwendung
Es wurden keine allgemeinen Unterschiede in der Sicherheit oder Wirksamkeit zwischen älteren und jüngeren Patienten beobachtet.
Überdosierung
Es liegen keine Daten vor, die die Anzeichen, Symptome oder Laborbefunde einer Überdosierung beschreiben. Die LD50 nach intravenöser Verabreichung liegt zwischen 60 und 80 mg/kg bei Mäusen, 50 und 70 mg/kg bei Ratten und 50 und 80 mg/kg bei Kaninchen. Bezogen auf die Körperoberfläche entsprechen diese Dosen dem 2,4- bis 13-fachen der maximal empfohlenen Humandosis (MRHD) von 2 mg/kg für Indikatorverdünnungsstudien, dem 10- bis 52-fachen der MRHD von 0,5 mg/kg für Leberfunktionsstudien und dem 7- bis 39-fachen der MRHD von 0.
IC-Green Beschreibung
IC-Green® ist ein steriles, lyophilisiertes grünes Pulver, das 25 mg Indocyaningrün mit nicht mehr als 5% Natriumiodid enthält. Es ist mit sterilem Wasser für Injektionszwecke, USP, verpackt, das zum Auflösen des Indocyaningrüns verwendet wird. IC-Green® wird intravenös verabreicht.
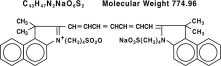
Indocyaningrün ist ein wasserlöslicher Tricarbocyanin-Farbstoff mit einer spektralen Absorptionsspitze bei 800 nm. Die chemische Bezeichnung für Indocyaningrün ist 1 H-Benzindolium, 2-indol-2-yliden]-1,3,5-heptatrienyl]-1,1-dimethyl-3-(4-sulfobutyl)-,hydroxid, inneres Salz, Natriumsalz. IC-Green® hat nach der Rekonstituierung einen pH-Wert von etwa 6,5. Jedes Fläschchen IC-Green® enthält 25 mg Indocyaningrün als steriles lyophilisiertes Pulver.
IC-Green – Klinische Pharmakologie
IC-Green® ermöglicht die Aufzeichnung der Indikator-Verdünnungskurven sowohl für diagnostische als auch für Forschungszwecke unabhängig von Schwankungen der Sauerstoffsättigung. Nach intravenöser Injektion wird IC-Green® schnell an Plasmaproteine gebunden, von denen Albumin der Hauptträger ist (95 %). IC-Green® durchläuft keinen nennenswerten extrahepatischen oder enterohepatischen Kreislauf; gleichzeitige arterielle und venöse Blutbestimmungen haben eine vernachlässigbare renale, periphere, lungen- oder zerebrospinale Aufnahme des Farbstoffs ergeben. IC-Green® wird fast ausschließlich von den Zellen des Leberparenchyms aus dem Plasma aufgenommen und vollständig in die Galle ausgeschieden. Nach einem Gallenverschluss erscheint der Farbstoff unabhängig von der Galle in der hepatischen Lymphe, was darauf hindeutet, dass die Gallenschleimhaut ausreichend intakt ist, um die Diffusion des Farbstoffs zu verhindern, jedoch die Diffusion von Bilirubin ermöglicht. Diese Eigenschaften machen IC-Green® zu einem hilfreichen Index für die Leberfunktion.
Die Spitzenabsorption und -emission von IC-Green® liegen in einem Bereich (800 bis 850 nm), in dem die Energieübertragung durch das Pigmentepithel effizienter ist als im Bereich des sichtbaren Lichts. IC-Green® hat außerdem die Eigenschaft, zu fast 98 % an Blutproteine gebunden zu sein, so dass es in den stark gefensterten Aderhautgefäßen nicht zu einer übermäßigen Extravasation des Farbstoffs kommt. Es ist daher sowohl bei der Absorptions- als auch bei der Fluoreszenz-Infrarotangiographie der Aderhautgefäße nützlich, wenn geeignete Filter und Filme in einer Funduskamera verwendet werden.
Die Plasmafraktionsverschwindungsrate bei der empfohlenen Dosis von 0,5 mg/kg ist Berichten zufolge bei Frauen signifikant höher als bei Männern, obwohl kein signifikanter Unterschied im berechneten Wert für die Clearance festgestellt wurde.
Nichtklinische Toxikologie
Kanzerogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Es wurden keine Studien zur Bewertung der Karzinogenität, Mutagenität oder Beeinträchtigung der Fruchtbarkeit durchgeführt.
Lieferumfang/Lagerung und Handhabung
IC-Green® wird in einem Kit (NDC 17478-701-02) geliefert, das sechs Durchstechflaschen mit 25 mg IC-Green® und sechs Ampullen mit 10 mL sterilem Wasser für Injektionszwecke, USP, enthält:
NDC 17478-701-25 IC-Green® Durchstechflasche. 25 mg Füllung in 20-mL-Fläschchen.
NDC 17478-701-10 Steriles Wasser für Injektionszwecke, USP-Ampulle. 10 mL Füllung in 10 mL Ampulle.
Lagerung: Bei 20° bis 25°C (68° bis 77°F) lagern.
AKORN
Hergestellt von: Akorn, Inc.
Lake Forest, IL 60045
IG00N Rev. 06/16
Hauptanzeigetext für Behälteretikett:
NDC 17478-701-25
IC-Green®
(Indocyaningrün
für Injektionen, USP)
25 mg Sterile Rx only

Hauptanzeigetext für Kartonetikett:
Akorn Logo NDC 17478-701-02
IC-Green®
(Indocyaningrün
für Injektionszwecke, USP)
25 mg Kit
Nur steriles Rx

Hauptanzeigetafeltext für Behälteretikett:
NDC 17478-701-10
Steriles Wasser
zur Injektion, USP
für IC-Green® (Indocyanin
grün zur Injektion, USP)
10 mL Nur steriles Rx

Hauptanzeigetafeltext für Kartonetikett:
NDC 17478-701-10
Akorn Logo
Steriles Wasser
für Injektion, USP
für IC-Green®
(Indocyaningrün
für Injektion, USP)
Steril
6 Ampullen
(je 10 mL) nur Rx

| IC-Grün Indocyaningrün-Kit |
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
Teil 1 von 2 IC-Grün
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
Teil 2 von 2 WÄSSRIGE LÖSUNG
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
Etikettierer – Akorn, Inc. (117696770)
Registrant – Akorn Operating Company LLC (117693100)
| Establishment | |||
| Name | Adresse | ID/FEI | Operations |
| Akorn, Inc. | 117696790 | LABEL(17478-701), PACK(17478-701) | |
| Establishment | |||
| Name | Adresse | ID/FEI | Operations |
| Akorn, Inc. | 117696832 | MANUFACTURE(17478-701), ANALYSIS(17478-701), STERILIZE(17478-701) | |
