Einführung
Die chronisch obstruktive Lungenerkrankung (COPD) ist eine bedeutende Ursache für Mortalität und Morbidität in der modernen Welt. Die Sterblichkeitsrate dieser Krankheit nimmt zu, und es wird vorhergesagt, dass sie bis 2020 weltweit die dritthäufigste Todesursache sein wird.1 Es ist nicht möglich, COPD ausschließlich anhand des forcierten exspiratorischen 1s-Volumens (FEV1) zu definieren, daher hat die Global Initiative for Chronic Obstructive Lung Disease (GOLD) eine multidimensionale Definition zur Beurteilung von COPD entwickelt.2 Die neue Definition umfasst neben dem FEV1-Wert auch das Vorhandensein von Symptomen und die Vorgeschichte von Exazerbationen und betont auch die Beurteilung von Komorbiditäten. Für die Beurteilung der Symptome wird entweder der modifizierte Medical Research Council (mMRC) oder der COPD Assessment Test (CAT) empfohlen. Zusätzlich wurde eine krankheitsspezifische Lebensqualitätsskala (SGRQ, SF-36, CCQ) verwendet, um die Auswirkungen der Krankheit auf das tägliche Leben zu bewerten. Einige Studien haben einen engen Zusammenhang zwischen dem CAT und dem St. George’s Respiratory Questionnaire (SGRQ) nachgewiesen.3,4 Ladeira et al.5 zeigten, dass der CAT mit dem BODE-Index korreliert war.
COPD ist eine komplexe Erkrankung und umfasst genetische, zelluläre und molekulare Komponenten. Es gibt viele verschiedene Zellen und Moleküle, die an den Entzündungsvorgängen beteiligt sind. Es wurden mehrere Indikatoren verwendet, um eine mögliche krankheitsbedingte systemische Entzündung nachzuweisen.6-9 Die Entzündung der Atemwege und des Lungenparenchyms ist ein wichtiger pathogener Mechanismus der COPD. Darüber hinaus kann eine anhaltende systemische Entzündung mit verschiedenen extrapulmonalen Komorbiditäten und pulmonalen Effekten in Verbindung gebracht werden.10 Jüngste Forschungsarbeiten haben die Existenz eines neuartigen systemischen entzündlichen COPD-Phänotyps“ belegt. 7 In einer neueren Studie wurde gezeigt, dass kardiovaskuläre Komorbiditäten und Diabetes mit höheren Werten für einige Marker der systemischen Entzündung verbunden waren.11 Daher sind genetische Belastung, systemische Entzündung und komorbide Krankheiten mit verschiedenen Phänotypen bei COPD verbunden. Es ist von entscheidender Bedeutung, dass neue Perspektiven für die Behandlung dieser Krankheit entwickelt werden.
Zurzeit wird CAT zunehmend für die Bewertung und Überwachung von COPD eingesetzt. Obwohl mehrere Serum-Biomarker bei COPD definiert wurden, gibt es nicht einen einzigen ausreichenden und wirksamen Biomarker, der zur Beurteilung des Status von COPD-Patienten verwendet werden kann. Es hat sich gezeigt, dass Biomarker mit verschiedenen Parametern wie Entzündung, Krankenhausaufenthalt und Sterblichkeit in Verbindung stehen.7-13 Der Zusammenhang zwischen CAT und Biomarkern wurde jedoch nicht eindeutig nachgewiesen. Daher zielt die vorliegende Studie darauf ab, den Grad der systemischen Entzündung bei COPD zu untersuchen und die Beziehung zwischen CAT und Entzündungsmarkern sowie der Lebensqualität zu bestimmen.
Materialien und MethodenStudiendesign
Es handelte sich um eine Querschnittsbeobachtungsstudie mit einmaligem Besuch. Einhundertzehn Patienten mit COPD, die nach den GOLD-Kriterien14 diagnostiziert wurden, und fünfundsechzig Kontrollpersonen wurden zwischen Februar 2013 und August 2013 rekrutiert. Die Kontrollpersonen wurden aus den Patienten ausgewählt, die zu Routineuntersuchungen in eine Klinik für Pulmologie und Innere Medizin am Universitätskrankenhaus Balikesir überwiesen wurden. Von allen Teilnehmern wurde eine schriftliche Einverständniserklärung eingeholt, und die Studie wurde von der Ethikkommission der Medizinischen Fakultät der Universität Balikesir genehmigt.
Alle Patienten wurden einer körperlichen Untersuchung, einer Röntgenaufnahme des Brustkorbs, einem Atemfunktionstest und routinemäßigen Blutuntersuchungen unterzogen. Die Anzahl der Exazerbationen im vergangenen Jahr und die Vorgeschichte des Rauchens wurden erfasst. Der CAT- und mMRC-Dyspnoe-Score wurde in persönlichen Gesprächen mit einem Lungenfacharzt ermittelt. Die SGRQ-Scores wurden von den Patienten angegeben. Bei der gesunden Kontrollgruppe wurden nur ein Atemfunktionstest und routinemäßige Blutuntersuchungen durchgeführt.
Die Population der Studie
Einschlusskriterien: Patienten wurden eingeschlossen, wenn sie: (1) älter als 40 Jahre waren; (2) aktuelle oder ehemalige Raucher mit einer Rauchergeschichte von ≥10 Packungsjahren waren; (3) einen FEV1
80% nach Bronchodilatation und einen FEV1/FVC0,7 aufwiesen. Kontrollpersonen wurden eingeschlossen, wenn sie: (1) älter als 40 Jahre waren; (2) nach ärztlicher Feststellung keine Lungenerkrankung hatten; (3) eine normale Spirometrie aufwiesen (FEV1>85% und FEV1/FVC>0,7); und (4) eine Rauchanamnese von
Ausschlusskriterien hatten: Ausgeschlossen wurden Patienten, die (1) innerhalb der letzten 6 Wochen eine Exazerbation der COPD hatten; (2) eine andere Atemwegserkrankung als COPD oder ein bösartiges Tumorleiden hatten; (3) eine chronisch entzündliche Erkrankung hatten (Vaskulitis, entzündliche Darmerkrankung, rheumatoide Arthritis usw.)); (4) eine unkontrollierte oder schwere Begleiterkrankung (Herzinfarkt, Herzrhythmusstörungen usw.).
Messungen
Demografische Merkmale, Alter, Geschlecht, Rauchgewohnheiten, Einweisungen in die Notaufnahme oder Krankenhausaufenthalte im letzten Jahr, Begleiterkrankungen und bestehende Behandlungen wurden entsprechend erfasst. Wir definierten eine Exazerbation als Verschlimmerung der Symptome, die orale Kortikosteroide und/oder Antibiotika und/oder einen Krankenhausaufenthalt erforderlich machte. Komorbide Erkrankungen wurden anhand der klinischen Anamnese und der körperlichen Untersuchungsergebnisse während des Besuchs ermittelt und durch eine Überprüfung der verfügbaren medizinischen Unterlagen belegt. Die derzeitige Medikamenteneinnahme, einschließlich Inhalatoren, Blutdrucksenkern oder anderen Medikamenten, wurde dokumentiert. Größe, Gewicht und BMI-Index wurden gemessen, und es wurde auch eine Spirometrie gemäß den internationalen Richtlinien (ATS/ERS) durchgeführt.15 Die Krankheit wurde nach der alten und neuen Version des GOLD-Stagings klassifiziert.14 Zum einen nach dem spirometrischen GOLD-Staging (FEV1-basiertes (1-4) Staging) und zum anderen nach dem GOLD-Staging (Klasse A-D). Die Dyspnoe wurde anhand der mMRC-Dyspnoe-Skala bewertet.16 Die COPD-Patienten wurden in die Klassen A, B, C und D eingeteilt, wobei die Symptombewertung anhand der mMRC-Dyspnoe-Scores und des Exazerbationsrisikos kombiniert wurde.
CAT: Die Gültigkeit und Zuverlässigkeit der türkischen Version dieser Skala wurde bereits früher überprüft.17 Der CAT umfasst 8 Items und ergibt Gesamtwerte zwischen 0 und 40; höhere Werte weisen auf eine schwerere Beeinträchtigung des Gesundheitszustands oder eine weniger erfolgreiche Kontrolle der COPD hin.3
Fragebogen zur Lebensqualität: Die Lebensqualität wurde mit Hilfe der türkischen Übersetzung des St. George’s Respiratory Diseases Questionnaire (SGRQ) bewertet.18
Biomarker
Wir wählten die Biomarker auf der Grundlage früherer Studien aus.7,9-13 Die von allen Probanden entnommenen Blutproben wurden zentrifugiert und bei -80°C gelagert. Alle Proben wurden nach Abschluss der Studie analysiert. Das Serum wurde in einem Diagnosegerät (BioTek, ELx 800, USA) unter Verwendung kommerzieller Kits (eBioscience, Human TNF-α und Human IL-6 Platinum ELISA, Österreich) und mit den Methoden des Tumornekrose-alpha (TNF-α) und eines Interleukin-6 (IL-6) Level Enzyme Linked Immunosorbent Assay (ELISA) untersucht. Die Werte des C-reaktiven Proteins (CRP) wurden mit einem klinisch-chemischen Analysegerät (Cobes Integra 800, Roche Diagnostics) unter Verwendung eines kommerziellen Kits bestimmt. Der Referenzwert für CRP liegt bei 0-0,5mg/L, während der niedrigste analysierte Wert für IL-6 bei 0,92pg/ml liegt. Der analysierte niedrigste Wert von TNF-α liegt bei 2,3 pg/ml. Die TNF-α- und IL-6-Konzentrationen einiger Proben lagen unter der unteren Bestimmungsgrenze (LLQ). Bei der Analyse von Personen mit Werten unterhalb der LLQ wurde ein nominaler Wert von der Hälfte des LLQ-Wertes verwendet, um eine Verzerrung der Populationsdaten nach unten zu vermeiden.19
Statistische Analyse
Die durchschnittlichen CRP-Werte von COPD- und Kontrollgruppen (3,2 (1,5,7,1), 1,3 (0,6,2,7)) wurden aus ähnlichen Studien ermittelt.7 Danach wurde in jeder Gruppe die Stichprobengröße mit Hilfe einer Durchschnittsberechnungsformel mit 80 % Genauigkeit und 5 % Fehler berechnet. Dementsprechend wurde eine Stichprobengröße von mindestens 55 Probanden in jeder Gruppe ermittelt. Die Ergebnisse werden je nach Fall als Mittelwert±SD, Median oder Prozentsatz angegeben. Der Student’s t-Test und die ANOVA wurden für parametrische Tests verwendet; der Mann-Whitney U-Test, Kruskal-Wallis und die Chi-Quadrat-Statistik wurden für nicht-parametrische Tests für Gruppenvergleiche verwendet. Mit dem exakten Test von Fisher wurden die Unterschiede zwischen den Prozentsätzen der Komorbiditäten und die Unterschiede zwischen den Geschlechtern bewertet. Mit dem Chi-Quadrat-Test wurden die Unterschiede zwischen den prozentualen Anteilen der Komorbiditäten ausgewertet. Die paarweise Korrelation der kontinuierlichen Variablen bei Patienten mit COPD wurde mit der Pearson-Korrelation untersucht. Ein Wert von p
0,05 wurde als statistisch signifikant angesehen. Alle statistischen Analysen wurden mit der Software SPSS (Version 20.0) durchgeführt.ErgebnisseKlinische Charakterisierung der Probanden
Die Studie umfasste 110 Patienten (Durchschnittsalter 64±8,9 Jahre; 100 Männer (90,9%)) und 65 Kontrollpersonen (Durchschnittsalter 61,5±9,2 Jahre, 55 Männer (84,6%)). Die demografischen und klinischen Merkmale der Patienten- und Kontrollgruppen sind in Tabelle 1 aufgeführt. Fünfundvierzig (40,9 %) Patienten mit COPD hatten eine Begleiterkrankung (ischämische Herzkrankheit (n=21), Bluthochdruck (n=13), Diabetes mellitus (n=8), andere (n=3)). Der mittlere FEV1-Wert lag bei 48,8 % des vorhergesagten Wertes und der mittlere FEV1/FVC-Wert bei 55,4 % in der COPD-Gruppe. Der mittlere CAT-Score lag bei 22,6 (±9,2), der mMRC-Wert bei 1,9 (±0,9) und der Gesamt-SGRQ bei 58,4 (±22,2). Von den 110 Patienten befanden sich 9,1 % im Stadium 1, 37,3 % im Stadium 2, 42,7 % im Stadium 3 und 10,9 % im Stadium 4 gemäß der spirometrischen GOLD-Einstufung. Bei der Klassifizierung der Patienten nach der GOLD-Einteilung gehörten 27,3 % der Gruppe A, 30,9 % der Gruppe B, 7,3 % der Gruppe C und 34,5 % der Gruppe D an.
Demographische, funktionelle und klinische Merkmale der Patienten- und Kontrollgruppen.
| Patient (n=110) | Kontrolle (n=65) | p-value | ||
|---|---|---|---|---|
| Alter | 64.0±8.9 | 61.5±9.2 | 0,080 | |
| Männer n, (%) | 100 (90,9) | 55 (84.6) | 0.224 | |
| BMI, kg/m2 | 26,5±5,6 | 25±2,6 | 0.064 | |
| Pack-Jahre | 38,9±23 | 0,1±1,2 | ||
| Ko-Morbiditäten, n (%) | ||||
| Alle | 65 (59.1) | 42 (64.6) | 0.95 | |
| Ischämische Herzkrankheit | 21(19.1) | 11 (16.9) | ||
| HT | 13 (11.8) | 6 (9.2) | ||
| DM | 8 (7.3) | 4 (6.2) | ||
| Andere | 3 (2.7) | 2 (3.1) | ||
| mMRC | 1.94±0.9 | 0.04±0.2 | ||
| FEV1, % vorhergesagt | 48.8±17.8 | 89,4±5,6 | ||
| FVC, % vorhergesagt | 68,7±17,8 | 92,1±5,8 | ||
| FEV1/FVC, % | 55.4±12.9 | 89.6±4.7 | ||
| GOLD spirometrisches Stadium, n (%) | ||||
| 1 | 10 (9.1) | |||
| 2 | 41 (37.3) | |||
| 3 | 47 (42.7) | |||
| 4 | 12 (10.9) | |||
| GOLD-Stadium, n (%) | ||||
| A | 30 (27.3) | |||
| B | 34 (30.9) | |||
| C | 8 (7.3) | |||
| D | 38 (34.5) | |||
| SGRQ-Gesamtscore | 58.4±22.2 | |||
| CAT-Score | 22.6±9.2 | |||
| TNFα (pg/ml) | 109.5±58 | 14.6±18 | ||
| IL-6 (pg/ml) | 10.3±18 | 2,14±1,9 | ||
| CRP (mg/L) | 1,6±1,7 | 0,4±0,3 | ||
Abkürzungen: BMI, Body Mass Index, HT: Hypertonie, DM: Diabetes, FEV1: forciertes Exspirationsvolumen in 1 Sekunde, FVC: forcierte Vitalkapazität, CAT: COPD assessment test.
COPD/Kontrollvergleiche
Es gab keinen signifikanten Unterschied zwischen dem Alter (p=0,080, Student’s t-test) und dem Geschlecht der beiden Gruppen (p=0,453, fisher’s exact test) (Tabelle 1). Die Gruppen wiesen ähnliche Häufigkeiten von Komorbiditäten auf (p=0,095, χ2-Test). Wie erwartet wiesen COPD-Patienten im Vergleich zu den Kontrollen signifikant niedrigere Lungenfunktionsparameter (FEV1, FVC, FEV1/FVC) auf (p
0,001, Student’s t-test). Im Allgemeinen wiesen COPD-Patienten höhere Serumspiegel von CRP (1,6±1,7mg/L) und TNF-α (109,5±58pg/ml) sowie IL-6 (10,3±18pg/ml) auf als gesunde Kontrollen (CRP: 0,4±0,3mg/L, p0,001; TNF-α: 14,6±18pg/ml, p0,001; IL-6: 2,14±1,9pg/ml, p0,001, Student’s t-test) (Tabelle 1).Assoziation von CAT-Fragebögen und Patientencharakteristika
Es bestand eine Korrelation zwischen dem CAT-Score und dem GOLD-Spirometrie-Stadium (Pearson’s r=0,43; p
0,001). Der CAT-Score stieg parallel zum Schweregrad der Erkrankung an. Es bestand ein statistisch signifikanter Zusammenhang zwischen dem CAT-Score und der Anzahl der Exazerbationen im letzten Jahr (Pearson’s r=0,35, p0,001), der Krankheitsdauer (Pearson’s r=0,29, p0,001), dem Rauchen (pack-year) (Pearson’s r=0,27, p=0,014) und dem mMRC (Pearson’s r=0,59, p0,001). Es wurde festgestellt, dass der CAT-Score signifikant mit FEV1 (Pearson’s r=-0,39, p0,001) und FVC (Pearson’s r=-42, p=0,003) korreliert. Gleichzeitig wurde eine starke Korrelation zwischen dem CAT-Score und den SGRQ-Symptom-, Aktivitäts-, Belastungs- und Gesamtscores beobachtet (Pearson’s r=0,72; p0,001).Assoziation zwischen Biomarkern und Patientenmerkmalen
Es wurden Entzündungsmarker und Lungenfunktionsparameter verglichen. Mit abnehmendem FEV1 stiegen die Werte der Biomarker signifikant an. Die CRP-Werte korrelierten mit FEV1 (Pearson’s r=-0,39, p
0,001), FVC (Pearson’s r=-0,33, p0,001) und FEV1/FVC (Pearson’s r=-0,38, p0,001). Die TNF-α-Werte korrelierten auch mit FEV1 (Pearson’s r=-0,57, p0,001), FVC (Pearson’s r=-0,37, p0,001) und FEV1/FVC (Pearson’s r=-0,66, p0,001). Die IL-6-Werte korrelierten auch mit FEV1 (Pearson’s r=-0,31, p0,001), FVC (Pearson’s r=-0,32, p0,001) und FEV1/FVC (Pearson’s r=-0,34, p0,001). Ein signifikanter Zusammenhang wurde zwischen CRP, TNF-α, IL-6 und Rauchen (Packungsjahr) festgestellt (Pearson’s r=0,35, r=0,44, r=0,27, p0,001, jeweils). COPD-Patienten mit kardiovaskulären Erkrankungen wiesen einen erhöhten CRP-Wert auf (2,98±2.4mg/L) im Vergleich zu Patienten ohne Begleiterkrankungen (1,56±1,5mg/L, p=0,008 ANOVA-Test gefolgt von LSD-Post-Hoc-Test). Es bestand kein signifikanter Zusammenhang mit anderen Biomarkern und Komorbiditäten. Mit dem Anstieg von IL-6 stieg auch der mMRC-Score an, doch war dieser Zusammenhang statistisch nicht signifikant (p=0,06). Beim Vergleich von Entzündungsmarkern mit dem CAT-Score zeigte sich eine signifikante Korrelation zwischen CRP-Spiegeln (r=0,43, p0,001) (Abb. 1), während keine Korrelation mit TNF-α und IL-6 beobachtet wurde. Es bestand eine Korrelation zwischen CRP-Spiegeln und TNF-α (r=0,48, p0,001). Es wurde kein direkter Zusammenhang zwischen den Biomarkern und der A-D-Klasse oder den spirometrischen Stadien festgestellt.
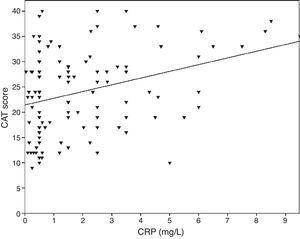
Die Beziehung zwischen CAT-Scores und CRP (r=0,43, p0,001).
Diskussion
Zur Bewertung der COPD werden einige Bewertungsinstrumente wie klinische Tests (CAT, BODE), Entzündungsmarker und Fragebögen zur Lebensqualität verwendet. Es ist allgemein anerkannt, dass eine multidimensionale Bewertung erforderlich ist, um die Krankheit zu verstehen und zu behandeln. Die COPD ist eine komplexe Erkrankung mit einer systemischen Komponente, und einige Patienten scheinen einen entzündlichen Phänotyp zu haben. In dieser Studie wurde die CAT als neuer klinischer Test durchgeführt und die Beziehung der CAT zu anderen COPD-Komponenten untersucht.
Eine dieser Komponenten ist die systemische Entzündung. Die bei COPD am häufigsten untersuchten Biomarker, die auf systemische Entzündungen hinweisen, sind CRP, IL-6, TNF-α, IL-8 und Fibrinogen. In mehreren Studien wurde bereits über erhöhte zirkulierende Spiegel dieser Marker bei Patienten mit stabiler COPD berichtet.6-9,20-23 In einer neueren Studie zeigten Agustí et al., dass 30 % der COPD-Patienten keine Anzeichen einer systemischen Entzündung aufwiesen und 16 % der Patienten eine anhaltende systemische Entzündung hatten.7 Interessanterweise waren in dieser Studie die Serumspiegel von TNF-α und IL-8 bei Rauchern mit normalen Spirometriewerten höher als bei COPD-Patienten. Die anderen Marker wie weiße Blutkörperchen, IL-6, CRP und Fibrinogen waren bei COPD-Patienten höher als bei Rauchern mit normalem Spirometriewert und Nichtrauchern. In unserer Studie waren die Werte von CRP, TNF-α und IL-6 bei allen COPD-Patienten im Vergleich zur Kontrollgruppe signifikant höher. Es wurde festgestellt, dass alle Biomarker mit der kumulativen Rauchexposition und der Verringerung der Lungenfunktionstestparameter (FEV1, FVC und FEV1/FVC) korreliert sind. Die Höhe der Biomarker hängt mit dem Grad der Atemwegsobstruktion zusammen. Diese Ergebnisse stimmen mit denen überein, die in früheren Querschnittsstudien berichtet wurden.13 In einer anderen Studie, die die Ergebnisse von ECLIPSE untersuchte, wurden kardiovaskuläre Begleiterkrankungen und Diabetes mit einigen systemischen Entzündungsmarkern korreliert.9 In unserer Studie wiesen COPD-Patienten mit kardiovaskulären Erkrankungen im Vergleich zu Patienten ohne Begleiterkrankungen einen erhöhten CRP-Wert auf. Erhöhte systemische Entzündungen bei COPD und kardiovaskulären Erkrankungen sprechen für einen pathophysiologischen Mechanismus zwischen COPD und diesen Begleiterkrankungen.
Der Zusammenhang zwischen CAT und systemischen Entzündungen ist in den bisher durchgeführten Studien nicht geklärt worden. In einer Studie wurde eine signifikante Korrelation zwischen LCN1, LCN2 und CAT nachgewiesen.8 In unserer Studie wurde eine signifikante Beziehung zwischen CAT und CRP nachgewiesen. Eine ähnliche Korrelation konnte jedoch nicht mit TNF-α und IL-6 nachgewiesen werden.
In der vorliegenden Studie wurden die COPD-Patienten in vier Gruppen (A-D) und Stadien (1-4) gemäß der alten und neuen Version der GOLD-Klassifikation eingeteilt. Es ist zu beobachten, dass die Stadien 1 und 4 nach der alten Klassifikation mit jeweils 10 % den geringsten Anteil der Bevölkerung ausmachen. In der neuen Version verteilte sich die Bevölkerung fast gleichmäßig auf die Gruppen A, B und D; am geringsten war die Verteilung in der Gruppe C. Auch in anderen Studien hat sich gezeigt, dass die Gruppe C den geringsten Anteil an der Verteilung ausmacht.24,25 Die neue Klassifikation zeigt, dass es sowohl Patienten mit vielen Symptomen, aber leichter Atemwegsobstruktion als auch Patienten mit wenigen Symptomen, aber schwerer Atemwegsobstruktion geben kann. Komorbiditäten und systemische Entzündungen können bei Patienten mit leichter/mittlerer Obstruktion zu einer Zunahme der Exazerbation und der Symptome führen, so dass diese Patienten in die Hochrisikogruppen (Klasse C oder D) eingestuft werden. In einer Studie wurde gezeigt, dass zum Subtyp C Patienten mit einem höheren Komorbiditätsstatus und zum Subtyp D Patienten mit den schwersten Exazerbationen, einer hohen Rate an Exazerbationen im Zusammenhang mit einem Krankenhausaufenthalt und den schlechtesten Ergebnissen gehören.26 In einer neueren Studie verglichen Agustí et al. zwei Gruppen mit und ohne persistierende systemische Entzündung und zeigten, dass Patienten mit persistierender Entzündung während der Nachbeobachtung eine höhere Exazerbationsrate pro Jahr aufwiesen als die andere Gruppe, obwohl die pulmonalen Anomalien in diesen beiden Gruppen ähnlich waren.7
GOLD empfiehlt die Verwendung der CAT- oder mMRC-Skala zur Bewertung der Symptome. Wir haben die mMRC-Skala für die Gruppenzuordnung verwendet, da bei der Bewertung der Symptome anhand der CAT die Zahl der Patienten mit weniger als 10 Haltepunkten sehr gering war (8 Patienten). Die höheren CAT-Werte könnten mit einer höheren Wahrnehmung der Symptome durch die Patienten zusammenhängen. Es wurde auch gezeigt, dass CAT und mMRC nicht gleichwertig sind, was zu Unterschieden in der Klassifizierung führen kann.24,25,27 In der neuen Klassifizierung bestehen die anderen Grenzwerte aus der Anzahl der Exazerbationen pro Jahr. Bei COPD-Patienten wurde ein Zusammenhang zwischen dem basalen CAT-Score und der Häufigkeit von Exazerbationen nachgewiesen.28 Pothirat et al. haben gezeigt, dass die Veränderung des CAT-Scores während der Überwachungsbesuche ein nützliches Instrument zur Erkennung einer akuten Verschlechterung des Gesundheitszustands von COPD-Patienten ist.29 In unserer Studie wurde ein starker Zusammenhang zwischen CAT, mMRC und den Exazerbationsraten festgestellt. Es wurde auch festgestellt, dass die CAT mit der Krankheitsdauer und dem Rauchen (Packungsjahre) korreliert. Der mittlere FEV1-Wert der Patienten lag bei 48,8 % des vorhergesagten Wertes und der mittlere CAT-Wert bei 22,6. Es zeigte sich ein starker Zusammenhang zwischen CAT und FEV1, FVC und dem spirometrischen GOLD-Stadium. Mit abnehmendem FEV1 und FVC stieg der CAT-Score an. Der CAT-Score korrelierte auch positiv mit einem schwereren GOLD-Stadium. Diese Ergebnisse zeigen, dass die CAT den Schweregrad der Erkrankung sehr gut widerspiegelt.
Eine weitere wichtige Komponente des COPD-Managements ist die Lebensqualität. Eine Vielzahl von Lebensfragebögen wurde verwendet, um die Auswirkungen der Krankheit auf das tägliche Leben zu bewerten. Die Zuverlässigkeit und Gültigkeit der türkischen Version des SGRQ wurde nachgewiesen.30 Einige Studien haben gezeigt, dass eine signifikante Korrelation zwischen CAT und SGRQ besteht.3,4 In einer Studie wurde berichtet, dass der CAT empfindlich auf Veränderungen des Gesundheitszustands im Zusammenhang mit COPD-Exazerbationen reagiert.31 In unserer Studie wurde ein starker Zusammenhang zwischen CAT und SGRQ nachgewiesen. Da der CAT im Vergleich zum SGRQ ein kürzerer und einfacher zu verstehender Test ist, ist die Verwendung des CAT praktischer.
Die vorliegende Studie weist mehrere Einschränkungen auf, wie z. B. ein Querschnittsdesign, eine Studie an einem einzigen Zentrum und eine geringe Stichprobengröße. Außerdem konnten die Entzündungsmarker bei Rauchern mit normaler Lungenfunktion nicht verglichen werden, da sie in der vorliegenden Studie nicht berücksichtigt wurden. Die Medikamente, die die Patienten einnehmen, können einen Einfluss auf die systemische Entzündungsreaktion und den Gesundheitszustand haben und die Ergebnisse beeinflussen.
Zusammenfassend lässt sich sagen, dass die CAT ein Test ist, der bei der Beurteilung von COPD eingesetzt werden kann, da seine Zuverlässigkeit und Validität eindeutig nachgewiesen wurden. Die Ergebnisse unserer Studie deuten auf einen Zusammenhang zwischen CAT und CRP sowie anderen COPD-Komponenten (klinische und funktionelle Parameter) hin. Es sind jedoch longitudinale multizentrische Studien erforderlich, um die Beziehung zwischen CAT und Biomarkern zu bewerten.
Ethische AngabenSchutz von Menschen und Tieren
Die Autoren erklären, dass für diese Studie keine Versuche an Menschen oder Tieren durchgeführt wurden.
Vertraulichkeit der Daten
Die Autoren erklären, dass sie die Protokolle ihrer Arbeitsstelle über die Veröffentlichung von Patientendaten befolgt haben und dass alle in die Studie eingeschlossenen Patienten ausreichend informiert wurden und ihre schriftliche Einwilligung zur Teilnahme an der Studie gegeben haben.
Recht auf Privatsphäre und informierte Einwilligung
Die Autoren haben die schriftliche informierte Einwilligung der im Artikel genannten Patienten oder Probanden eingeholt. Der korrespondierende Autor ist im Besitz dieses Dokuments.
Autorschaft
Studienaufbau: NS, FE und AAH; Datenerhebung: NS, CB; Datenanalyse und Interpretation: NS, AAH und CB; Kritische Überarbeitung des Manuskripts: NS, FE, CB und AAH.
Interessenkonflikte
Die Autoren erklären, dass sie bei der Erstellung dieses Manuskripts keinen Interessenkonflikt hatten.
