- Was ist Entropie?
- Was ist der dritte Hauptsatz der Thermodynamik?
- Bedeutung des dritten Hauptsatzes der Thermodynamik
Der dritte Hauptsatz der Thermodynamik besagt, dass die Entropie eines Systems konstant wird, wenn sich seine Temperatur dem absoluten Nullpunkt nähert, oder dass die Veränderung der Entropie gleich Null ist. Der dritte Hauptsatz der Thermodynamik sagt die Eigenschaften eines Systems und das Verhalten der Entropie in einer einzigartigen Umgebung voraus, die als absolute Temperatur bekannt ist.
Die Entropie eines begrenzten oder isolierten Systems wird konstant, wenn sich seine Temperatur der absoluten Temperatur (dem absoluten Nullpunkt) nähert.
Die Thermodynamik ist einer der wichtigsten und am meisten untersuchten Zweige der physikalischen Wissenschaft. Abgesehen davon, dass sie Maschinenbaustudenten die meiste Zeit ihres akademischen Lebens quält, ist sie allgegenwärtig, von der kalten Brise meiner Klimaanlage bis zu einem der Höhepunkte des Industriezeitalters – der Dampfmaschine. Ihre Umsetzung wird durch drei Gesetze geregelt, die als die Gesetze der Thermodynamik bekannt sind. Diese Gesetze legen fest, wie Arbeit, Wärme und Energie ein System beeinflussen. Ein System ist jeder Bereich im Universum, der endlich begrenzt ist und in dem Energie übertragen wird. Alles außerhalb dieser Begrenzung ist die Umgebung des Systems.
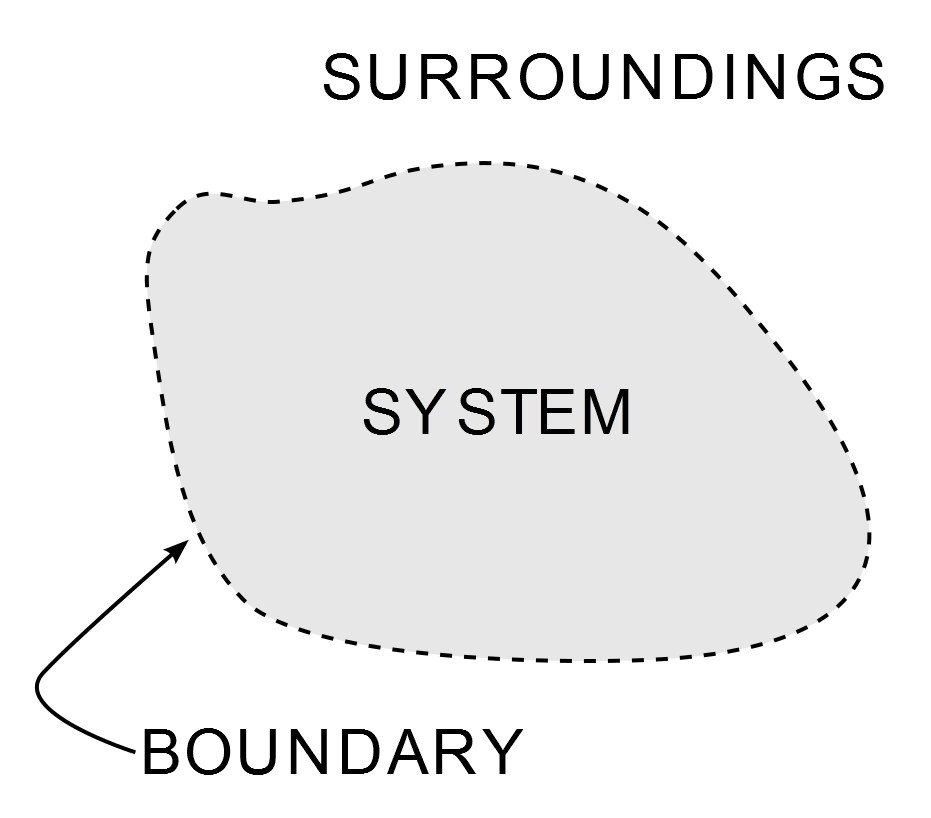
Illustration eines Systems in der Thermodynamik. (Photo Credit : Wavesmikey / Wikipedia Commons)
Was ist Entropie?
Während der erste Hauptsatz der Thermodynamik davon ausgeht, dass das Universum mit endlicher nutzbarer Energie begann, wobei ein System, das Energie bezieht, diese zum Teil durch Arbeit und zum Teil durch Erhöhung seiner Innentemperatur verbraucht, untersucht der zweite Hauptsatz seine Auswirkungen. Dazu gehört die Umwandlung dieser endlichen nutzbaren Energie in unbrauchbare Energie, z. B. die Bildung von Materie vor Milliarden von Jahren durch die Kondensation der Energie, mit der das Universum begann. In diesem Prozess wird die endliche nutzbare Energie nun in unbrauchbare Energie umgewandelt.
Diese unbrauchbare Energie wird durch etwas gemessen, das „Entropie“ genannt wird, ein Barometer zur Messung der Zufälligkeit oder Unordnung in einem System.
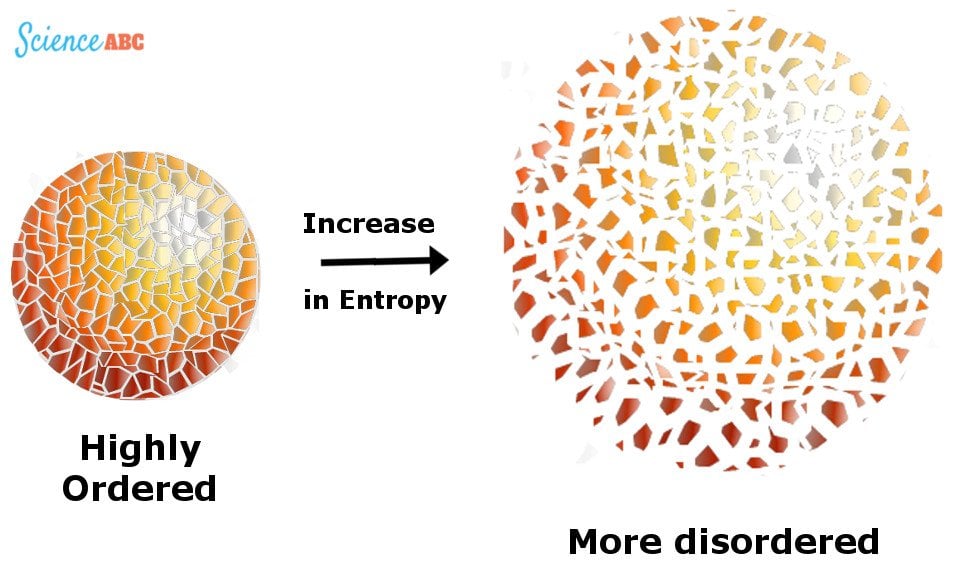
Veranschaulichung der Entropie als Zunahme der Unordnung.
Das Universum ist wie ein Raum voller Kleider, die ungeordnet herumliegen. Die Entropie dieses Systems nimmt zu, wenn immer mehr Kleidung benutzt und weggeworfen wird, was die Unordnung vergrößert, es sei denn, der Bewohner bemüht sich, sie aufzuheben und zu ordnen, was die Unordnung verringert.
Betrachten wir das Universum als ein einziges System, so gibt es in seiner Umgebung nichts, woraus man Energie gewinnen könnte, so dass, wenn alle Energie in unbrauchbare Energie umgewandelt wird, nur ein kalter, dunkler Ort zurückbleibt. Dies wird als Wärmetod bezeichnet und ist eine der Möglichkeiten, wie das Universum enden könnte. Ein begrenztes System wie unser Universum besitzt endliche Energiequellen, wie seine hellen Sterne, die Äonen lang brennen werden, bevor sie sich den grausamen Gesetzen der Natur ergeben.

Was ist der dritte Hauptsatz der Thermodynamik?
Der dritte Hauptsatz der Thermodynamik sagt die Eigenschaften eines Systems und das Verhalten der Entropie in einer einzigartigen Umgebung voraus, die als absolute Temperatur bekannt ist. Die absolute Temperatur ist die niedrigste bekannte Temperatur und stellt eine untere Grenze für den Temperaturbereich des Universums dar.
Wie cool ist das denn! Nein, im Ernst, wie kalt ist das? Die absolute Temperatur ist 0 Kelvin, die Standardeinheit der Temperatur oder -273,15 Grad Celsius! Die absolute Temperatur wird in manchen Kreisen und Ländern auch als absoluter Nullpunkt bezeichnet. Diese Skala gibt dir eine Vorstellung.
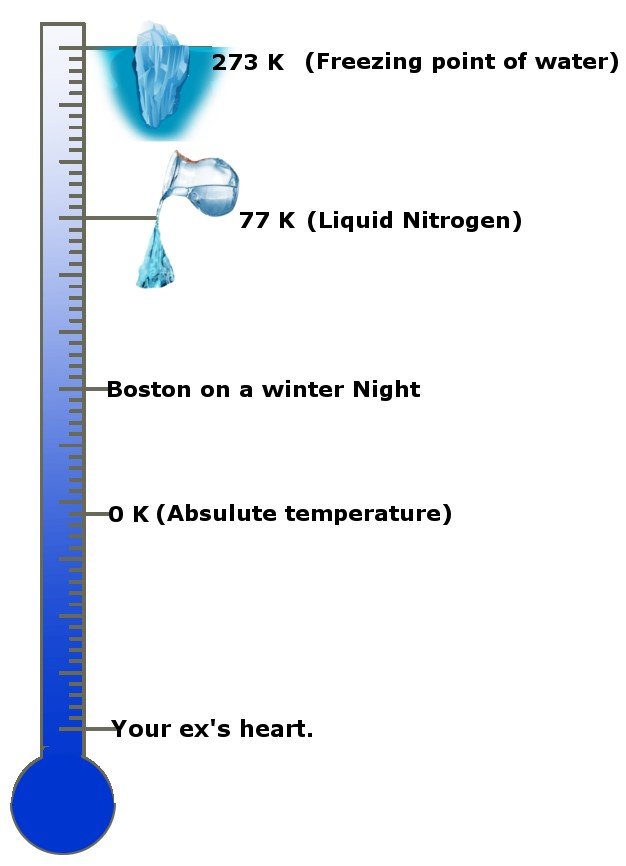
Das dritte Gesetz besagt, dass die Entropie eines Systems konstant wird, wenn sich die Temperatur dem absoluten Nullpunkt nähert, oder die Änderung der Entropie gleich Null ist.

Die Aussage wird durch diese Gleichung dargestellt, wobei T der Temperatur entspricht und delta S die Änderung der Entropie des Systems ist. Die Bezeichnung „tendiert gegen Null“, dargestellt durch einen Pfeil, der gegen Null zeigt, bedeutet, dass das System, wenn die Temperatur auf einen infinitesimalen Wert sinkt, eine konstante Entropie erreicht, indem es seiner Umgebung Energie entzieht, aber wie das erste Gesetz vorschreibt, wird ein Teil dieser Energie der inneren Energie des Systems hinzugefügt, wodurch ein konstanter Entropiezustand verneint wird.
Bedeutung des dritten Hauptsatzes der Thermodynamik
Der dritte Hauptsatz ist in unserem täglichen Leben kaum anwendbar und regelt die Dynamik von Objekten bei den niedrigsten bekannten Temperaturen. Er definiert einen so genannten „perfekten Kristall“, dessen Atome an ihren Positionen festgeklebt sind. Der perfekte Kristall besitzt also absolut keine Entropie, was nur bei der absoluten Temperatur möglich ist.
Das Konzept der Entropie wurde auch in einigen Theorien verwendet, die den kontinuierlichen Fluss der Zeit objektiv definieren, wie etwa die lineare Zunahme der Entropie des Universums.
Bei 0 Kelvin ist die Entropieänderung bei Reaktionen zur Bildung von Materie gleich Null, obwohl praktisch alle Materie aufgrund der Anwesenheit kleinster Wärmemengen ein gewisses Maß an Entropie aufweist. Die kälteste Temperatur, die wir gemessen haben, liegt bei 3 K in den fernen Tiefen des Universums, jenseits von Sternen und Galaxien.
Mit anderen Worten: Genießen Sie den Sommer, solange er andauert!
Was ist der erste Hauptsatz der Thermodynamik?
Was ist der zweite Hauptsatz der Thermodynamik?
