Momentos dipolares
La distribución asimétrica de cargas en una sustancia polar como el HCl produce un momento dipolar donde \( Qr \) en metros (m). se abrevia con la letra griega mu (µ). El momento dipolar se define como el producto de la carga parcial Q en los átomos enlazados y la distancia r entre las cargas parciales.
Cuando una molécula con momento dipolar se coloca en un campo eléctrico, tiende a orientarse con el campo eléctrico debido a su distribución de carga asimétrica (Figura \(\PageIndex{4}\)).
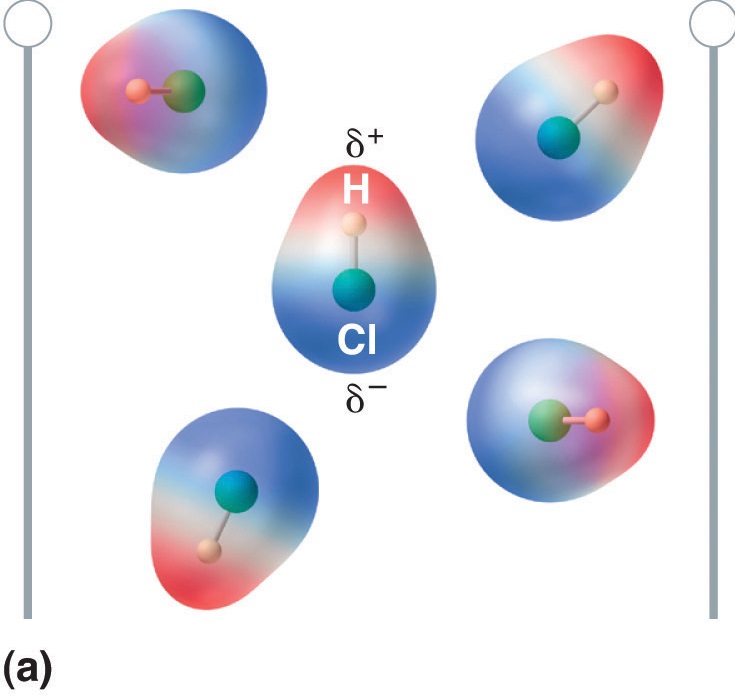
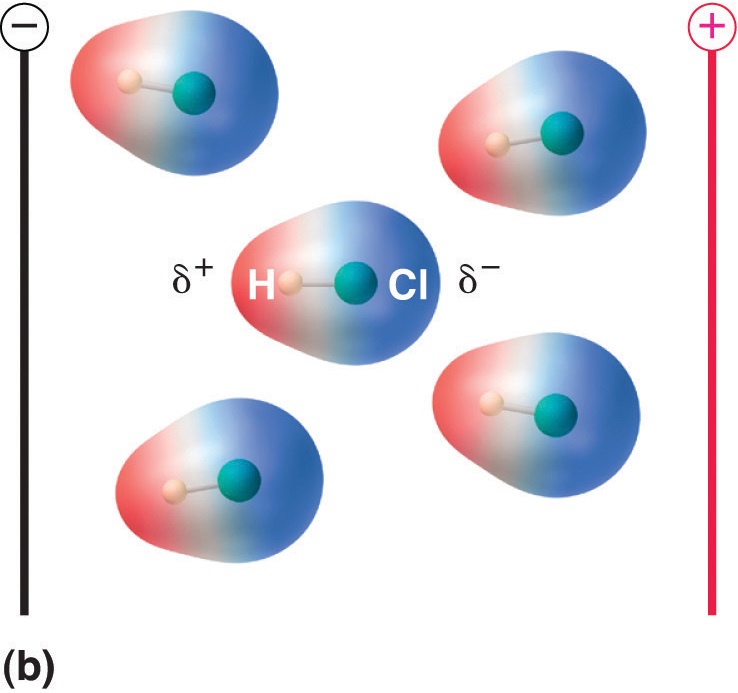
Figura \(\PageIndex{5}\): Las moléculas que poseen un momento dipolar se alinean parcialmente con un campo eléctrico aplicado. En ausencia de campo (a), las moléculas de HCl se orientan al azar. Cuando se aplica un campo eléctrico (b), las moléculas tienden a alinearse con el campo, de forma que el extremo positivo del dipolo molecular apunta hacia el terminal negativo y viceversa.
El momento dipolar medido del HCl indica que el enlace H-Cl tiene aproximadamente un 18% de carácter iónico (0,1811 × 100), o un 82% de carácter covalente. En lugar de escribir HCl como
\
podemos, por tanto, indicar la separación de cargas cuantitativamente como
\
Nuestros resultados calculados están de acuerdo con la diferencia de electronegatividad entre el hidrógeno y el cloro χH = 2,20; χCl = 3,16, χCl – χH = 0,96), un valor que se encuentra dentro del rango de los enlaces covalentes polares. Indicamos el momento dipolar escribiendo una flecha sobre la molécula. Matemáticamente, los momentos dipolares son vectores, y poseen tanto una magnitud como una dirección. El momento dipolar de una molécula es la suma vectorial de los dipolos de los enlaces individuales. En el HCl, por ejemplo, el momento dipolar se indica de la siguiente manera:
![]()
La flecha muestra la dirección del flujo de electrones señalando hacia el átomo más electronegativo.
La carga de los átomos de muchas sustancias en la fase gaseosa puede calcularse utilizando los momentos dipolares medidos y las distancias de enlace. La figura (índice de página 6) muestra un gráfico del porcentaje de carácter iónico frente a la diferencia de electronegatividad de los átomos enlazados para varias sustancias. Según el gráfico, el enlace en especies como el NaCl(g) y el CsF(g) es sustancialmente inferior al 100% de carácter iónico. Sin embargo, cuando el gas se condensa en un sólido, las interacciones dipolo-dipolo entre las especies polarizadas aumentan las separaciones de carga. En el cristal, por tanto, se transfiere un electrón del metal al no metal, y estas sustancias se comportan como compuestos iónicos clásicos. Los datos de la figura (\PageIndex{6}) muestran que las especies diatómicas con una diferencia de electronegatividad inferior a 1,5 tienen un carácter iónico inferior al 50%, lo que concuerda con nuestra descripción anterior de que estas especies contienen enlaces covalentes polares. El uso de los momentos dipolares para determinar el carácter iónico de un enlace polar se ilustra en el Ejemplo \(\PageIndex{2}\).
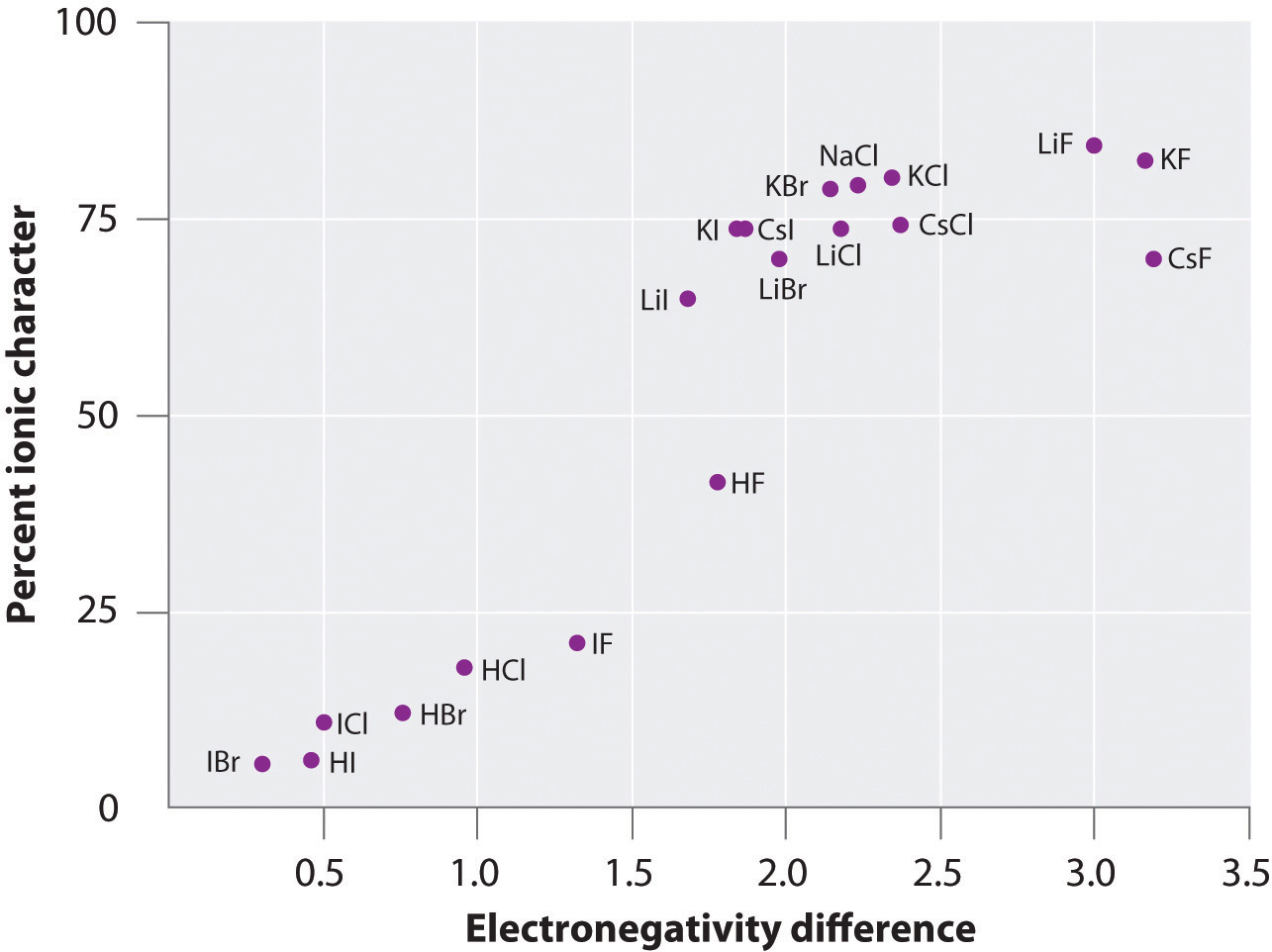
Figura \(\PageIndex{6}\): Un gráfico del porcentaje de carácter iónico de un enlace determinado a partir de los momentos dipolares medidos frente a la diferencia de electronegatividad de los átomos enlazados.En la fase gaseosa, incluso el CsF, que tiene la mayor diferencia posible de electronegatividad entre los átomos, no es 100% iónico. El CsF sólido, sin embargo, se ve mejor como 100% iónico debido a las interacciones electrostáticas adicionales en la red.
