Entalpía
La termodinámica es el estudio de la relación entre el calor (o energía) y el trabajo. La entalpía es un factor central en la termodinámica. Es el contenido de calor de un sistema. El calor que entra o sale del sistema durante una reacción es el cambio de entalpía. El hecho de que la entalpía del sistema aumente (es decir, cuando se añade energía) o disminuya (porque se cede energía) es un factor crucial que determina si una reacción puede producirse.
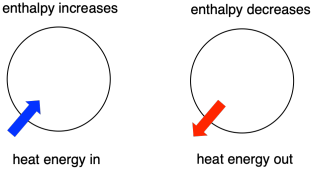
A veces, llamamos «entalpía interna» a la energía de las moléculas que sufren el cambio. A veces, la llamamos «entalpía del sistema». Estas dos frases se refieren a lo mismo. Del mismo modo, la energía de las moléculas que no participan en la reacción se llama «entalpía externa» o «entalpía del entorno».
A grandes rasgos, los cambios de energía que vimos en la introducción a la termodinámica eran cambios de entalpía. En la próxima sección veremos que hay otro factor energético, la entropía, que también debemos considerar en las reacciones. Por ahora, sólo veremos la entalpía.
- La entalpía es el contenido de calor de un sistema.
- El cambio de entalpía de una reacción equivale aproximadamente a la cantidad de energía perdida o ganada durante la reacción.
- Una reacción se ve favorecida si la entalpía del sistema disminuye a lo largo de la reacción.
Esta última afirmación se parece mucho a la descripción de la energética de la página anterior. Si un sistema sufre una reacción y cede energía, su propio contenido energético disminuye. Le queda menos energía si ha cedido algo. ¿Por qué cambia la energía de un conjunto de moléculas cuando se produce una reacción? Para responder a esto, tenemos que pensar en lo que ocurre en una reacción química.
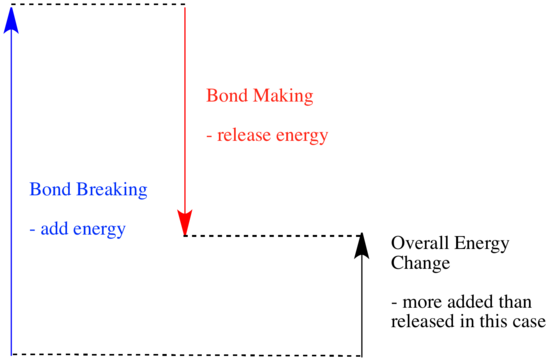
En una reacción, hay un cambio en el enlace químico. Algunos de los enlaces de los reactivos se rompen, y se crean nuevos enlaces para formar los productos. La ruptura de enlaces cuesta energía, pero se libera energía cuando se crean nuevos enlaces.
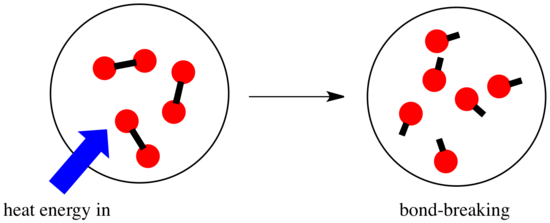
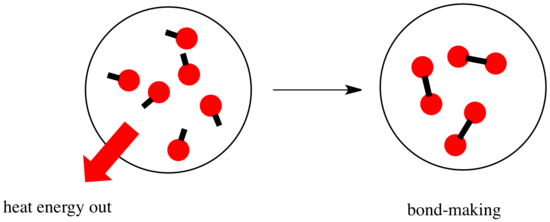
El que una reacción pueda seguir adelante puede depender del equilibrio entre estos pasos de creación y de ruptura de enlaces.
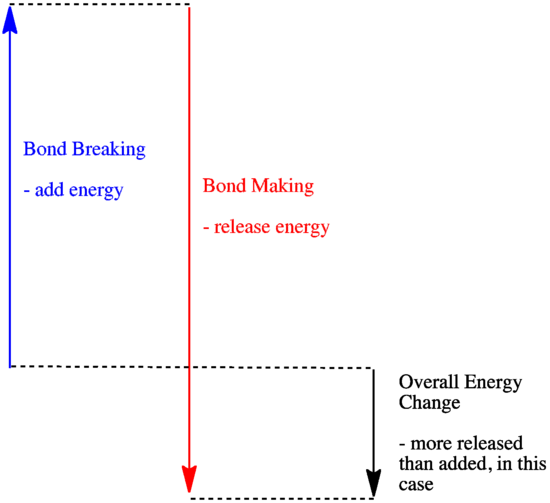
- Una reacción es exotérmica si se libera más energía por la formación de nuevos enlaces que la que se consume al romper los antiguos.
- Una reacción es exotérmica si se intercambian enlaces más débiles por otros más fuertes.
- Una reacción es endotérmica si la ruptura de enlaces cuesta más energía que la que se proporciona en la formación de enlaces.
Las energías de enlace (la cantidad de energía que debe añadirse para romper un enlace) son un factor importante para determinar si se producirá una reacción. Las energías de enlace no siempre son fáciles de predecir, porque la fuerza de un enlace depende de varios factores. Sin embargo, mucha gente ha hecho mucho trabajo midiendo la fuerza de los enlaces, y han recogido la información en tablas, así que si necesitas saber cómo de fuerte es un enlace, puedes buscar la información que necesitas.
| Enlace | Energía de enlace (kcal/mol) | Enlace | Energía de enlace (kcal/mol) |
| H-H | 104 | O-H | 111 |
| C-C | 83 | C-H | 99 |
| O=O | 119 | N-H | 93 |
| N=N | 226 | C=O | 180 |
Por ejemplo, suponga que quiere saber si la combustión del metano es una reacción exotérmica o endotérmica. Voy a suponer que es exotérmica, porque esta reacción (y otras similares) se utiliza para proporcionar calor a muchos hogares quemando gas natural en los hornos.
La «combustión» del metano significa que se quema en el aire, para que reaccione con el oxígeno. Los productos de la combustión de hidrocarburos son principalmente dióxido de carbono y agua. El átomo de carbono del metano (CH4) se incorpora a una molécula de dióxido de carbono. Los átomos de hidrógeno se incorporan a las moléculas de agua. Hay cuatro átomos de hidrógeno en el metano, así que eso es suficiente para hacer dos moléculas de H2O.
- Cuatro enlaces C-H deben romperse en la combustión del metano.
- Cuatro nuevos enlaces O-H se hacen cuando los hidrógenos del metano se incorporan a nuevas moléculas de agua.
- Dos nuevos enlaces C=O se forman cuando el carbono del metano se añade a una molécula de CO2.
La otra pieza del rompecabezas es la fuente de oxígeno para la reacción. El oxígeno está presente en la atmósfera principalmente como O2. Como necesitamos dos átomos de oxígeno en la molécula de CO2 y otros dos átomos de oxígeno para las dos moléculas de agua, necesitamos un total de cuatro átomos de oxígeno para la reacción, que podrían ser proporcionados por dos moléculas de O2.
-
Dos enlaces O=O deben romperse para proporcionar los átomos de oxígeno para los productos.
En total, son cuatro enlaces C-H y dos O=O rotos, más dos enlaces C=O y cuatro O-H hechos. Eso es 4 x 99 kcal/mol para los enlaces C-H y 2 x 119 kcal/mol para los enlaces O=O, un total de 634 kJ/mol añadido. La reacción libera 2 x 180 kcal/mol para los enlaces C=O y 4 x 111 kcla/mol para los enlaces OH, un total de 804 kcal/mol. En total, se liberan 170 kcal/mol más de las que se consumen.
Eso significa que la reacción es exotérmica, por lo que produce calor. Probablemente sea una buena forma de calentar tu casa.
