Abstracto
¿Cómo funciona el cerebro? Esta es una pregunta que interesa a los científicos desde hace cientos de años. Para averiguar cómo funciona el cerebro, los científicos han tenido que hacer muchos experimentos y descubrir formas de examinar y probar el cerebro. En 2005 se creó una nueva técnica, llamada optogenética. Esta técnica utiliza una combinación de luz e ingeniería genética (cambiar la información genética de un ser vivo insertando o borrando información en el código genético) para controlar las células del cerebro. La optogenética se ha hecho muy popular y ahora se utiliza en los laboratorios de investigación del cerebro de todo el mundo. Nos está ayudando a descubrir muchas cosas nuevas sobre el cerebro. Aquí explicamos lo que hace que la optogenética sea tan especial para estudiar el cerebro.
Células especiales del cerebro y del sistema nervioso, llamadas neuronas, trabajan juntas para producir todos nuestros pensamientos y comportamientos. Para entender cómo el cerebro controla el comportamiento, tenemos que entender cómo se comunican las neuronas. El cerebro humano es muy complejo, pero muchas de sus propiedades son similares a las de otros animales. Esto significa que los neurocientíficos (científicos que estudian el cerebro y el sistema nervioso) pueden utilizar animales sencillos para descubrir cosas nuevas sobre el cerebro humano. Así se descubrió la comunicación entre las neuronas.
¿Cómo se comunican las neuronas entre sí?
Las neuronas se comunican utilizando una combinación de actividad eléctrica y química. Los primeros científicos lo descubrieron mediante observaciones y experimentos ingeniosos. A finales del siglo XVIII, un científico italiano llamado Luigi Galvani paseaba por un mercado durante una tormenta eléctrica. Vio unas ancas de rana en venta y se dio cuenta de que se movían. Su hipótesis era que la electricidad de la tormenta activaba los nervios de las ancas de rana. Decidió probar esta hipótesis en su laboratorio. Galvani utilizó un objeto que permite el flujo de la corriente eléctrica, llamado electrodo, para pasar una corriente eléctrica al nervio de la rana. Esto hizo que la pata de la rana se moviera. Este fue el primer estudio de estimulación eléctrica en neurociencia. A partir de este hallazgo, Galvani llegó a la conclusión de que las neuronas podían utilizar señales eléctricas para transmitir información. Es importante saberlo. Ahora que sabemos cómo se comunican las neuronas entre sí, podemos empezar a hablar su idioma. Podemos utilizar señales eléctricas para encender algunas neuronas y ver lo que ocurre después. Esto es exactamente lo que los científicos empezaron a hacer.
No fue hasta la década de 1930 que se utilizó la estimulación eléctrica para mapear el cerebro humano. El Dr. Wilder Penfield, un neurocirujano, trabajaba con pacientes que padecían epilepsia. La epilepsia provoca señales eléctricas anormales en el cerebro y puede ser muy peligrosa. En casos extremos, es necesario operar el cerebro para detener la epilepsia. El Dr. Penfield quería cartografiar los cerebros de sus pacientes para averiguar qué partes del cerebro eran las más importantes. Esto le ayudaría a saber qué zonas del cerebro no debía operar. Para mapear el cerebro, utilizó la estimulación eléctrica, tal y como había hecho Galvani. Introdujo un pequeño electrodo en las zonas motoras (de movimiento) del cerebro. A continuación, envió una pequeña señal eléctrica y observó los movimientos del paciente. La estimulación en una zona del cerebro provocaba un movimiento de los dedos, mientras que la estimulación en una zona ligeramente diferente del cerebro provocaba un movimiento de los pies. Esto llevó al Dr. Penfield a darse cuenta de que ciertas áreas del cerebro controlan zonas muy específicas del cuerpo. El Dr. Penfield observó que la ubicación de las áreas motoras del cerebro era similar en todos sus pacientes. Creó diagramas de sus resultados, que nos dieron el primer mapa funcional de las áreas motoras en el cerebro humano . Los mapas funcionales del Dr. Penfield, conocidos como el homúnculo, se siguen utilizando hoy en día.
Desde la década de 1930, los experimentos de estimulación cerebral han cambiado. Los estudios de estimulación eléctrica tienen algunos inconvenientes. Un problema es que el cerebro puede resultar dañado cuando se inserta un electrodo. Otro problema es que la estimulación eléctrica activa el tejido de forma muy general y no selectiva (Figura 1A). Es como utilizar una excavadora cuando una pala es suficiente: la excavadora es eficaz, pero no es muy precisa ni cuidadosa. En 2005, se creó una nueva técnica que permite una estimulación cerebral más precisa. Esta técnica se llama optogenética.
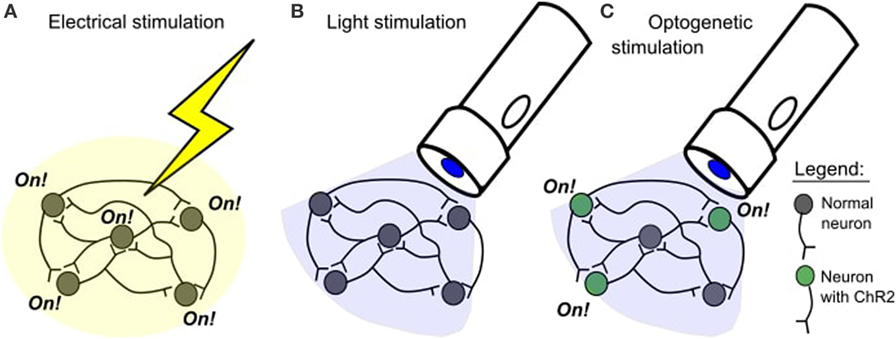
- Figura 1
- A. En un estudio de estimulación eléctrica, se activarán todas las células cercanas al lugar de estimulación. B. La luz azul no afecta normalmente a las neuronas. C. La luz azul activará selectivamente las neuronas con canalrodopsina-2 (ChR2).
¿Qué es la optogenética?
La optogenética es un método para controlar la actividad de una neurona utilizando luz e ingeniería genética. La ingeniería genética es un proceso en el que los científicos cambian la información del código genético (los planos) de un ser vivo. En los estudios optogenéticos, los científicos toman el código genético de las neuronas que quieren estudiar y le añaden un nuevo fragmento de código. El nuevo código permite a estas neuronas fabricar proteínas especiales, llamadas opsinas, que responden a la luz. Las opsinas se producen de forma natural y se descubrieron por primera vez en las algas, que utilizan estas proteínas para ayudarse a desplazarse hacia la luz. ¿Pero cómo llega la opsina a la neurona? Esto requiere algunas técnicas de laboratorio especializadas. Tomemos como ejemplo un ratón. Para introducir la opsina en las neuronas de un ratón, hay que insertar cuidadosamente el código genético de la opsina en el código genético de las neuronas del ratón. Si esto se hace correctamente, ahora cada neurona del ratón debería tener la opsina. Como sabemos mucho sobre el código genético del ratón, podemos elegir dónde colocar la opsina. Podemos insertar el código en un tipo específico de neurona, o en un lugar específico del cerebro. Podemos elegir exactamente qué neuronas queremos controlar.
En la neurociencia, la opsina más popular se llama channelrhodopsin-2 (ChR2). Esta opsina procede del alga verde Chlamydomonas reinhardtii . La ChR2 se activa con la luz azul, lo que significa que sólo funciona cuando la luz azul la ilumina y no responde a otros tipos de luz. Cuando ChR2 se inserta en las neuronas, significa que las neuronas pueden encenderse con luz azul. Las neuronas con ChR2 sólo se encenderán mientras la luz azul las ilumine. Esto nos da un control preciso sobre el tiempo de la actividad de la neurona. Normalmente, las neuronas no se ven afectadas por la luz azul (Figura 1B), así que sólo las neuronas que tienen ChR2 se verán afectadas por la luz azul (Figura 1C).
La estimulación optogenética es más específica que la estimulación eléctrica
Al igual que hay muchas carreteras en una ciudad, hay muchas vías en el cerebro. Si queremos saber cómo se conecta el Punto A con el Punto B en una ciudad, podemos simplemente mirar todas las carreteras y dibujar un mapa de carreteras. Este es un tipo de mapa estructural: nos ayuda a entender cómo están dispuestas las carreteras. Pero, por lo general, hay muchas formas de ir del Punto A al Punto B, así que ¿cómo sabemos qué camino es el más popular? Para averiguarlo, tenemos que observar los coches que circulan por las carreteras mientras van del Punto A al Punto B. Este es un mapa funcional: nos ayuda a entender cómo se utilizan las carreteras. En el cerebro, las neuronas son como las carreteras, y las señales que viajan de neurona a neurona son como los coches. Normalmente, el cerebro está muy activo y hay muchos coches en las carreteras en todo momento. En todo el mapa del cerebro, los coches inician y detienen sus viajes en diferentes momentos. Como hay tanta actividad, no podemos ver ningún patrón ni entender cómo se relacionan las cosas. Para averiguar los patrones, sería útil poder controlar cuándo y dónde los coches comienzan su viaje.
Imagina que hay coches en cada entrada de nuestra ciudad. Estos coches están esperando una señal para salir a la calle (Figura 2A). En un estudio de estimulación eléctrica, podemos controlar cuándo empiezan a circular los coches, pero no tenemos mucho control sobre qué coches saldrán a la calle. Con la estimulación eléctrica, la estimulación es general. Todos los coches cercanos a la estimulación saldrán a la carretera. Esto significa que hay mucha actividad que seguir (Figura 2B). En un estudio de estimulación optogenética, podemos elegir exactamente qué coches queremos que salgan a la carretera y cuándo. Podemos elegir un grupo de coches por ubicación (por ejemplo, podemos elegir que todos los coches de un barrio salgan a la carretera), o podemos elegir por tipo de coche (por ejemplo, podemos elegir que sólo los camiones salgan a la carretera) (Figura 2C). Se trata de una estimulación selectiva. El movimiento de los coches es mucho más fácil de seguir en este caso. Nos dice más sobre el funcionamiento de coches concretos en las carreteras.
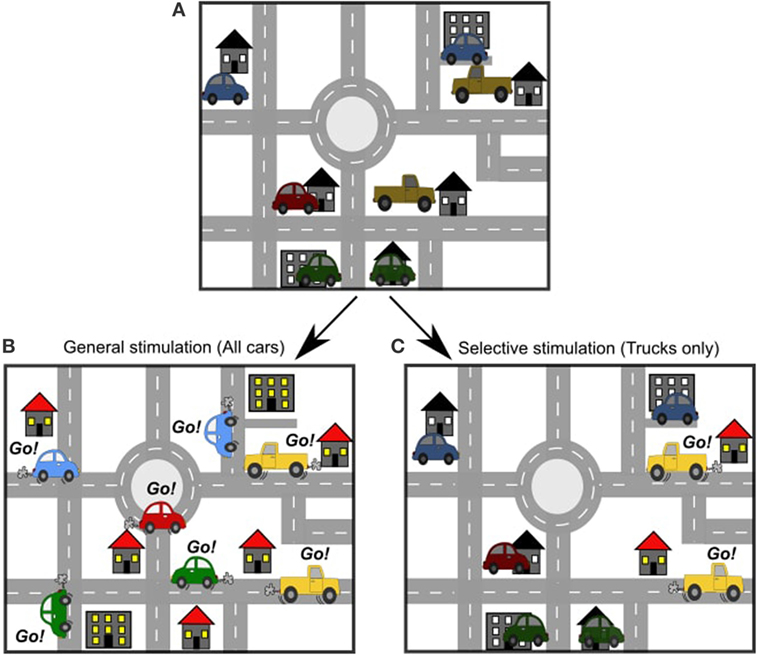
- Figura 2
- A. Al igual que hay muchas carreteras en una ciudad, hay muchas vías en el cerebro. B. Un estudio de estimulación eléctrica es como enviar todos los coches a las carreteras a la vez. C. Un estudio de estimulación optogenética es como enviar sólo un tipo de coche por las carreteras.
¿Cómo se utiliza la optogenética para cartografiar el cerebro?
La optogenética puede utilizarse de varias maneras diferentes para cartografiar el cerebro del ratón (revisado en la Ref. ).
Al igual que podemos alejar el zoom en un mapa de carreteras de una ciudad para ver las principales autopistas (Figura 3A), o acercar el mapa para ver una sola manzana de la ciudad (Figura 3B), también podemos acercar o alejar el cerebro. Podemos alejar el zoom del cerebro para ver cómo se conectan y funcionan juntas grandes áreas del cerebro (Figura 3C). Esta visión de conjunto es buena si estamos interesados en la forma en que la información viaja a través de largas distancias en el cerebro, o qué áreas del cerebro están conectadas entre sí. Por ejemplo, las grandes ciudades suelen tener más carreteras y autopistas que las atraviesan, porque mucha gente viaja hacia y desde estas ciudades. Utilizando la optogenética para estimular un área del cerebro y registrar las respuestas en otras áreas cerebrales, podemos averiguar qué áreas del cerebro tienen más tráfico. Esto es importante para entender cómo se producen ciertos comportamientos, pero también podría ser importante para entender qué ocurre si el cerebro está dañado en una zona concreta (por ejemplo, si hay un accidente en la cuarta calle, ¿cómo se redirigirá el tráfico?).
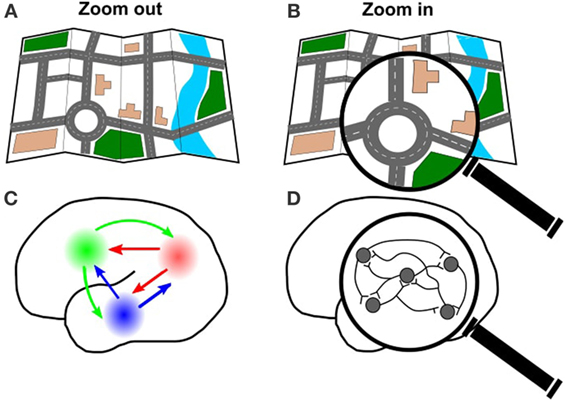
- Figura 3
- A. Al igual que se puede mirar el mapa de toda una ciudad, B. o acercarse a una carretera individual, también se pueden mirar las conexiones de todo el cerebro C., o acercarse a un grupo específico de células D.
También podemos acercarnos al cerebro para ver cómo se conectan las neuronas individuales (Figura 3D). Usando la optogenética, podemos investigar cómo las neuronas trabajan juntas, usando la luz para encender algunas neuronas y registrar la respuesta de las otras neuronas. Esta visión detallada es útil para comprender cómo y cuándo se comunican las neuronas entre sí. Esto podría ser muy útil para investigar las enfermedades que interrumpen la comunicación entre las neuronas en un área concreta, que es lo que ocurre cuando alguien sufre un derrame cerebral (lea más sobre esto en la siguiente sección).
El mapeo optogenético crea muchas posibilidades para investigar cómo funciona el cerebro. A medida que las técnicas optogenéticas mejoran y se crean o descubren más opsinas, existe la posibilidad de un control aún mayor en los estudios de estimulación cerebral. Quizá podamos utilizar múltiples opsinas para controlar varios tipos diferentes de neuronas al mismo tiempo. Como cada opsina responde a un tipo específico de luz, podríamos utilizar una luz diferente para controlar distintos tipos de neuronas. De hecho, algunas opsinas actúan para apagar las neuronas cuando el tipo correcto de luz está presente.
En nuestro ejemplo de mapeo de coches en la ciudad, podríamos utilizar múltiples señales para controlar el movimiento de los coches. Podríamos hacer que un conjunto de coches saliera a la calle cuando diéramos una señal (digamos, luz azul) y otro conjunto de coches saliera a la calle cuando diéramos una señal diferente (digamos, una luz roja). Con esta configuración, podemos empezar a experimentar con estos dos grupos de coches: ¿qué ocurre si los coches con luz roja salen primero? ¿Qué ocurre si los coches con luz azul van primero? ¿Qué ocurre si van al mismo tiempo? Esto nos ayudaría a entender cómo estos diferentes conjuntos de coches interactúan entre sí.
Entonces, ¿cómo elige un científico qué técnica o qué opsina utilizar? La respuesta dependerá de la pregunta que el científico quiera explorar. La siguiente sección destacará algunas de las cuestiones que se han investigado utilizando la optogenética.
Descubrimientos recientes utilizando la optogenética
Los científicos del cerebro comenzaron a utilizar la optogenética en 2005 . Desde entonces, los métodos optogenéticos se han utilizado para estudiar el cerebro desde muchos puntos de vista diferentes: desde la comunicación de un grupo de neuronas individuales, hasta las interacciones entre grandes regiones del cerebro (revisado en la Ref. ). Muchos otros estudios han utilizado métodos optogenéticos para investigar diferentes temas y preguntas. Algunas preguntas recientes son: ¿dónde está el miedo en el cerebro? ¿Cómo se calcula el riesgo y la recompensa? ¿Cómo se almacenan los recuerdos? (revisado en la Ref. ). Hemos utilizado la optogenética en ratones para investigar cómo cambia el cerebro después de un accidente cerebrovascular. Un ictus se produce cuando se interrumpe o reduce el suministro de sangre a una zona del cerebro. Esto es peligroso porque el suministro de sangre transporta oxígeno y otros nutrientes importantes que el cerebro necesita para sobrevivir. Si una zona del cerebro pasa demasiado tiempo sin oxígeno, las neuronas de esa zona acaban muriendo. Esto provoca problemas en esa zona concreta del cerebro y en las demás zonas cerebrales que están conectadas a ella. En nuestro estudio, queríamos investigar cómo un pequeño golpe en una zona del cerebro afectaba a muchas otras zonas del mismo. Para empezar, utilizamos el ChR2 para ayudarnos a dibujar un mapa funcional del cerebro de los ratones. Comparamos los mapas entre animales con y sin ictus. Comprobamos que los mapas cambiaban con el tiempo. Una semana después del ictus, la actividad cerebral general era muy baja. Sorprendentemente, la actividad era baja incluso en una zona alejada del ictus. A las 8 semanas del ictus, la actividad cerebral general era mayor, pero no había vuelto a la normalidad. A partir de estos datos, llegamos a la conclusión de que incluso un pequeño ictus puede tener un gran efecto en el funcionamiento del cerebro en su conjunto. Entender lo que le ocurre al cerebro después de un ictus podría ayudar a los científicos a crear mejores tratamientos para los pacientes con ictus. Éste es sólo un ejemplo de la utilidad de la optogenética para investigar cuestiones relacionadas con el cerebro. Es probable que los científicos del cerebro sigan utilizando la optogenética durante muchos años.
Glosario
Neuronas: Células especiales del cerebro que se comunican entre sí enviando y recibiendo señales eléctricas y químicas. Hay miles de millones de neuronas en el cerebro, y las señales que se envían entre estas células son la base de todos nuestros pensamientos y comportamientos. Las neuronas se denominan a veces células nerviosas.
Estudio de estimulación eléctrica: Técnica para activar neuronas o vías neuronales mediante la inserción de un pequeño electrodo y el envío de una corriente eléctrica al tejido. Esto provoca cambios en la actividad eléctrica del tejido.
Neurociencia: Rama de la ciencia que estudia el cerebro y el sistema nervioso.
Optogenética: Técnica que utiliza una combinación de luz e ingeniería genética para controlar la actividad de una célula.
Ingeniería genética: El proceso de cambiar la información del código genético (los planos) de un ser vivo añadiendo o eliminando información. La ingeniería genética se denomina a veces modificación genética.
Opsinas: Proteínas que responden a un tipo específico de luz (por ejemplo, la ChR2 sólo responde a la luz azul). En neurociencia, estas proteínas se utilizan para controlar la actividad de las neuronas.
Opsina de canalización-2 (ChR2): Una opsina que responde específicamente a la luz azul. Cuando la ChR2 se inserta en las neuronas, la luz azul puede utilizarse para encender esas neuronas. La ChR2 es actualmente la opsina más popular para los estudios optogenéticos.
Infarto: Normalmente, la sangre transporta oxígeno y otros nutrientes importantes al cerebro. Cuando el suministro de sangre se interrumpe o se reduce, el cerebro no recibe lo que necesita para funcionar correctamente. Esto se denomina ictus, y puede causar problemas y disfunciones duraderas.
Declaración de conflicto de intereses
Los autores declaran que la investigación se ha llevado a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Artículo de origen
Lim, D. H., LeDue, J., Mohajerani, M. H., Vanni, M. P., y Murphy, T. H. 2013. Enfoques optogenéticos para el mapeo funcional del cerebro del ratón. Front. Neurosci. 7:54. doi:10.3389/fnins.2013.00054
Kolb, B., Whishaw, I. Q., y Teskey, G. C. 2016. Una introducción al cerebro y al comportamiento. 5th ed. Nueva York, NY: Worth.
Penfield, W., y Edwin, B. 1937. Somatic motor and sensory representation in the cerebral cortex of man as studied by electrical stimulation. Brain 60(4):389-443. doi:10.1093/brain/60.4.389
Nagel, G., Szellas, T., Huhn, W., Kateriya, S., Adeishvili, N., Berthold, P., et al. 2003. Channelrhodopsin-2, a directly light-gated cation-selective membrane channel. Proc. Natl. Acad. Sci. U.S.A. 100:13940-5. doi:10.1073/pnas.1936192100
Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., y Deisseroth, K. 2005. Control óptico de la actividad neuronal dirigido genéticamente en una escala de milisegundos. Nat. Neurosci. 8:1263-8. doi:10.1038/nn1525
Lim, D. H., LeDue, J., Mohajerani, M. H., Vanni, M. P., y Murphy, T. H. 2013. Enfoques optogenéticos para el mapeo funcional del cerebro del ratón. Front. Neurosci. 7:54. doi:10.3389/fnins.2013.00054
Deisseroth, K. 2015. Optogenética: 10 años de opsinas microbianas en la neurociencia. Nat. Neurosci. 18(9):1213-25. doi:10.1038/nn.4091
Lim, D. H., LeDue, J., Mohajerani, M. H., y Murphy, T. H. 2014. El mapeo optogenético después de un accidente cerebrovascular revela el escalamiento de las conexiones funcionales en toda la red y la recuperación heterogénea del peri-infarto. J. Neurosci. 34(49):16455–66. doi:10.1523/JNEUROSCI.3384-14.2014
