Nombre genérico: verde de indocianina
Forma farmacéutica: inyección, polvo, liofilizado, para solución
Revisado médicamente por Drugs.com. Actualizado por última vez el 1 de octubre de 2020.
- Efectos secundarios
- Dosificación
- Profesional
- Interacciones
- Embarazo
- Más
Indicaciones y uso de IC-Green
IC-Green® está indicado:
Para determinar el gasto cardíaco, la función hepática y el flujo sanguíneo hepático
Dosis y administración de IC-Green
Estudios de dilución de colorantes
En la realización de curvas de dilución de colorantes, se inyecta una cantidad conocida de colorante en forma de bolo único lo más rápidamente posible a través de un catéter cardíaco en lugares seleccionados del sistema vascular. Se acopla un instrumento de registro (oxímetro o densitómetro) a una aguja o catéter para el muestreo de la mezcla de colorante y sangre desde un sitio de muestreo arterial sistémico.
En condiciones estériles, el polvo de IC-Green® debe disolverse con el Agua Estéril para Inyecciones, USP proporcionada para este producto, y la solución debe utilizarse dentro de las 6 horas siguientes a su preparación. Si se produce un precipitado, deseche la solución.
Las dosis habituales de IC-Green® para las curvas de dilución son las siguientes:
Adultos – 5,0 mg
Niños – 2,5 mg
Los bebés – 1,25 mg
Estas dosis del colorante se inyectan normalmente en un volumen de 1 mL. Se recomienda una media de cinco curvas de dilución en la realización de un cateterismo cardíaco diagnóstico. La dosis total de colorante inyectado debe mantenerse por debajo de los 2 mg/kg.
Aunque puede utilizarse agua estéril para inyecciones para enjuagar la jeringa, debe utilizarse solución salina isotónica para lavar el colorante residual del catéter cardíaco en la circulación a fin de evitar la hemólisis. A excepción del enjuague de la jeringa de inyección de colorante, debe utilizarse solución salina en todas las demás partes del procedimiento de cateterismo.
Calibración de las curvas de colorante: Para cuantificar las curvas de dilución, se realizan diluciones estándar de IC-Green® en sangre total como se indica a continuación. Se recomienda encarecidamente que en la preparación de estas diluciones estándar se utilice el mismo colorante que se utilizó para las inyecciones. La solución de colorante más concentrada se hace diluyendo exactamente 1 mL del colorante de 5 mg/mL con 7 mL de agua destilada. Esta concentración se reduce sucesivamente a la mitad diluyendo 4 mL de la concentración anterior con 4 mL de agua destilada.
Si se utilizó una concentración de 2,5 mg/mL para las curvas de dilución, se añade 1 mL del colorante de 2,5 mg/mL a 3 mL de agua destilada para hacer la solución «estándar» más concentrada. Esta concentración se reduce sucesivamente a la mitad diluyendo 2 mL de la concentración anterior con 2 mL de agua destilada.
Entonces se añaden porciones de 0,2 mL (medidas con precisión con una jeringa calibrada) de estas soluciones de colorante a alícuotas de 5 mL de la sangre del sujeto, dando concentraciones finales del colorante en sangre que comienzan con 24,0 mg/litro, aproximadamente (la concentración real depende del volumen exacto de colorante añadido). Por supuesto, esta concentración se reduce sucesivamente a la mitad en las alícuotas sucesivas de la sangre del sujeto. Estas alícuotas de sangre que contienen cantidades conocidas de colorante, así como una muestra en blanco a la que se han añadido 0,2 mL de solución salina que no contiene colorante, se hacen pasar por el instrumento de detección y se construye una curva de calibración a partir de las desviaciones registradas.
Estudios de la función hepática
Debido a su espectro de absorción, las concentraciones cambiantes de IC-Green® (verde de indocianina para inyección) en la sangre pueden controlarse mediante densitometría auricular u obteniendo muestras de sangre a intervalos de tiempo. La técnica para ambos métodos es la siguiente.
El paciente debe ser estudiado en ayunas, en estado basal. Se debe pesar al paciente y calcular la dosis sobre la base de 0,5 mg/kg de peso corporal.
En condiciones estériles, el polvo de IC-Green® debe disolverse con el Agua Estéril para Inyecciones, USP suministrada. Deben añadirse exactamente 5 mL de Agua Estéril para Inyección, USP al vial de 25 mg para obtener 5 mg de colorante por mL de solución.
Inyectar la cantidad calculada de colorante (0,5 mg/kg de peso corporal) en el lumen de una vena del brazo lo más rápidamente posible, sin permitir que el colorante salga fuera de la vena. (Si se utiliza el método fotométrico, antes de inyectar el IC-Green®, extraiga 6 mL de sangre venosa del brazo del paciente para el blanco de suero y la construcción de la curva estándar, y a través de la misma aguja, inyecte la cantidad correcta de colorante.)
Densitometría auricular: La oximetría también se ha utilizado y permite controlar la aparición y desaparición de IC-Green® sin necesidad de extraer y analizar espectrofotométricamente las muestras de sangre para su calibración. Debe utilizarse un densitómetro de oído que disponga de una célula fotoeléctrica compensatoria para corregir los cambios en el volumen sanguíneo y el hematocrito, y una célula fotoeléctrica de detección que registre los niveles. Este dispositivo permite medir simultáneamente el gasto cardíaco, el volumen sanguíneo y el aclaramiento hepático de IC-Green®*. Esta técnica se ha empleado en recién nacidos, adultos sanos y en niños y adultos con enfermedades hepáticas. El sujeto normal tiene una tasa de eliminación del 18 al 24% por minuto. Debido a la ausencia de eliminación extrahepática, el IC-Green® resultó adecuado para el estudio en serie de enfermedades hepáticas crónicas graves y para proporcionar una medición estable del flujo sanguíneo hepático. En dosis mayores, IC-Green® puede utilizarse en la detección de alteraciones de la función hepática inducidas por fármacos y en la detección de lesiones hepáticas leves.
Utilizando el densitómetro auricular, una dosis de 0,5 mg/kg en sujetos normales da el siguiente patrón de aclaramiento.
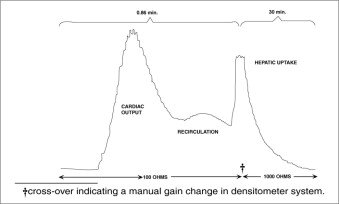
*Densitómetro de auricular dicromático suministrado por The Waters Company, Rochester, Minnesota.
Método fotométrico –
Determinación mediante retención porcentual del colorante:
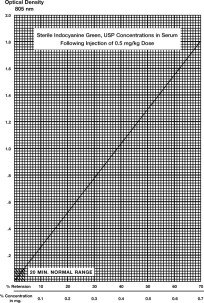
Se muestra una curva típica obtenida mediante el trazado de la concentración de colorante frente a la densidad óptica. El porcentaje de retención puede leerse a partir de este gráfico. Si se desean resultados más precisos, puede construirse una curva utilizando la sangre del paciente y el vial de IC-Green® que se utiliza en la determinación de la siguiente manera:
- Tome 6 mL de sangre venosa del brazo del paciente que no contenga colorante. Colocar en un tubo de ensayo y dejar que la sangre coagule. El suero debe separarse por centrifugación.
- Pipetear 1 mL del suero en una microcubeta.
- Añadir 1 lambda (λ) de la solución acuosa de 5 mg/mL de IC-Green® (verde de indocianina estéril) al suero, dando una dilución de 5 mg/litro, el estándar para la retención del 50%. (La adición de 2 lambda (λ) de la solución de 5 mg/mL de IC-Green® daría una retención del 100%; sin embargo, esta concentración no puede leerse en el espectrofotómetro.)
- La densidad óptica de esta solución debe leerse a 805 nm, utilizando suero normal como blanco.
- Usando un papel cuadriculado similar al utilizado en la ilustración, grafique la cifra del 50% obtenida en el paso 4 y trace una línea que conecte este punto con las coordenadas del cero.
Porcentaje de retención: Debe recogerse una única muestra de 20 minutos (extraída de una vena del brazo opuesto al inyectado) y dejarla coagular, centrifugarla y determinar su densidad óptica a 805 nm utilizando el suero normal del paciente como blanco. La concentración de colorante puede leerse a partir de la curva anterior. Una sola muestra de 20 minutos de suero en sujetos sanos no debe contener más del 4% de la concentración inicial del colorante. El uso del porcentaje de retención es menos preciso que el porcentaje de desaparición. No se espera que la hemólisis interfiera en la lectura.
Determinación mediante el índice de desaparición del colorante: Para calcular el índice de desaparición porcentual, obtenga muestras a los 5, 10, 15 y 20 minutos después de inyectar el colorante. Preparar la muestra como en el apartado anterior y medir las densidades ópticas a 805 nm, utilizando el suero normal del paciente como blanco. La concentración de IC-Green® en cada muestra cronometrada debe determinarse utilizando la curva de concentración ilustrada. Los valores deben representarse en papel semilogarítmico.
Las muestras que contienen IC-Green® deben leerse a la misma temperatura, ya que su densidad óptica se ve influida por las variaciones de temperatura.
Valores normales: El porcentaje de desaparición en sujetos sanos es del 18 al 24% por minuto. El tiempo medio biológico normal es de 2,5 a 3,0 minutos.
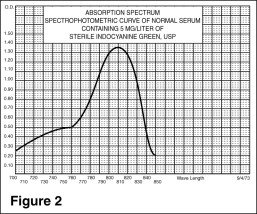
Estudios de angiografía oftálmica
Los espectros de excitación y emisión (Figura 1) y los espectros de absorción (Figura 2) de IC-Green® lo hacen útil en la angiografía oftálmica.
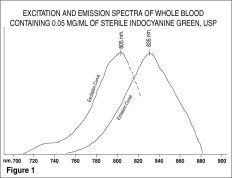
Se deben utilizar dosis de hasta 40 mg de colorante IC-Green® en 2 mL de Agua Estéril para Inyección, USP, dependiendo del equipo y la técnica de imagen utilizados. La vena antecubital puede inyectarse con un bolo de colorante IC-Green® y debe seguirse inmediatamente con un bolo de 5 mL de solución salina normal.
Formas de dosificación y concentraciones
IC-Green® es un polvo verde liofilizado estéril que contiene 25 mg de verde de indocianina con no más del 5% de yoduro de sodio.
Contraindicaciones
IC-Green® contiene yoduro de sodio y debe utilizarse con precaución en pacientes con antecedentes de alergia a los yoduros debido al riesgo de anafilaxia.
Advertencias y precauciones
Anafilaxia
Se han notificado muertes por anafilaxia tras la administración de IC-Green® durante un cateterismo cardíaco.
Instabilidad del fármaco
IC-Green® es inestable en solución acuosa y debe utilizarse antes de 6 horas. Sin embargo, el colorante es estable en el plasma y en la sangre total, por lo que las muestras obtenidas en técnicas de muestreo discontinuo pueden leerse horas después. Deben utilizarse técnicas estériles en la manipulación de la solución del colorante, así como en la realización de las curvas de dilución. Si se produce un precipitado, deseche la solución.
Interacciones entre el medicamento y la prueba de laboratorio
Los estudios de captación de yodo radiactivo no deben realizarse durante al menos una semana tras el uso de IC-Green®.
Reacciones adversas
Se han notificado reacciones anafilácticas o urticariales en pacientes con o sin antecedentes de alergia a los yoduros. Si se producen estas reacciones, tratar con los agentes adecuados, por ejemplo epinefrina, antihistamínicos y corticosteroides.
Interacciones con otros medicamentos
Los preparados que contienen bisulfito de sodio, incluidos algunos productos de heparina, reducen el pico de absorción de IC-Green® en sangre y, por lo tanto, no deben utilizarse como anticoagulantes para la recogida de muestras para el análisis.
Uso en poblaciones específicas
Embarazo
No se han realizado estudios de reproducción en animales con IC-Green®. Tampoco se sabe si IC-Green® puede causar daño fetal cuando se administra a una mujer embarazada o puede afectar a la capacidad de reproducción. IC-Green® debe administrarse a una mujer embarazada sólo si está claramente indicado.
Madres lactantes
No se sabe si este medicamento se excreta en la leche humana. Dado que muchos fármacos se excretan en la leche humana, se debe tener precaución cuando se administre IC-Green® a una mujer lactante.
Uso pediátrico
Se ha establecido la seguridad y eficacia en pacientes pediátricos. Ver DOSIFICACIÓN Y ADMINISTRACIÓN (2) para obtener información específica sobre la dosificación en pacientes pediátricos.
Uso geriátrico
No se han observado diferencias globales en la seguridad o eficacia entre los pacientes de edad avanzada y los más jóvenes.
Sobredosis
No se dispone de datos que describan los signos, síntomas o hallazgos de laboratorio que acompañan a la sobredosis. La DL50 tras la administración intravenosa oscila entre 60 y 80 mg/kg en ratones, 50 y 70 mg/kg en ratas y 50 y 80 mg/kg en conejos. En función de la superficie corporal, estas dosis son de 2,4 a 13 veces la dosis máxima recomendada en humanos (MRHD) de 2 mg/kg para estudios de dilución de indicadores, de 10 a 52 veces la MRHD de 0,5 mg/kg para estudios de función hepática, y de 7 a 39 veces la MRHD de 0.67 mg/kg para estudios de angiografía oftálmica.
IC-Green Descripción
IC-Green® es un polvo verde liofilizado estéril que contiene 25 mg de verde de indocianina con no más del 5% de yoduro de sodio. Se envasa con agua estéril para inyecciones, USP, utilizada para disolver el verde de indocianina. IC-Green® debe administrarse por vía intravenosa.
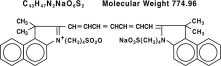
El verde de indocianina es un colorante tricarbocanino soluble en agua con un pico de absorción espectral a 800 nm. El nombre químico del Verde de Indocianina es 1 H-Benzindolio, 2-indol-2-ilideno]-1,3,5-heptatrienil]-1,1-dimetil-3-(4-sulfobutil)-,hidróxido, sal interna, sal de sodio. IC-Green® tiene un pH de aproximadamente 6,5 cuando se reconstituye. Cada vial de IC-Green® contiene 25 mg de verde de indocianina como polvo liofilizado estéril.
IC-Green – Farmacología clínica
IC-Green® permite el registro de las curvas de dilución del indicador tanto para fines de diagnóstico como de investigación, independientemente de las fluctuaciones de la saturación de oxígeno. Tras la inyección intravenosa, IC-Green® se une rápidamente a la proteína plasmática, de la que la albúmina es el principal portador (95%). El IC-Green® no sufre una circulación extrahepática o enterohepática significativa; las estimaciones simultáneas en sangre arterial y venosa han mostrado una absorción renal, periférica, pulmonar o cerebroespinal insignificante del colorante. El IC-Green® es captado desde el plasma casi exclusivamente por las células del parénquima hepático y es secretado en su totalidad en la bilis. Tras una obstrucción biliar, el colorante aparece en la linfa hepática, independientemente de la bilis, lo que sugiere que la mucosa biliar está lo suficientemente intacta como para impedir la difusión del colorante, aunque permite la difusión de la bilirrubina. Estas características hacen que el IC-Green® sea un índice útil de la función hepática.
El pico de absorción y emisión del IC-Green® se encuentra en una región (800 a 850 nm) en la que la transmisión de energía por el epitelio pigmentario es más eficiente que en la región de la energía de la luz visible. El IC-Green® también tiene la propiedad de estar unido en casi un 98% a la proteína de la sangre y, por lo tanto, no se produce una extravasación excesiva del colorante en la vasculatura coroidea altamente fenestrada. Por lo tanto, es útil tanto en la angiografía infrarroja de absorción como de fluorescencia de la vasculatura coroidea cuando se utilizan los filtros y la película adecuados en una cámara de fondo de ojo.
Se ha notificado que la tasa de desaparición fraccional del plasma a la dosis recomendada de 0,5 mg/kg es significativamente mayor en las mujeres que en los hombres, aunque no hubo diferencias significativas en el valor calculado para el aclaramiento.
Toxicología no clínica
Carcinogénesis, mutagénesis, deterioro de la fertilidad
No se han realizado estudios para evaluar la carcinogénesis, la mutagénesis o el deterioro de la fertilidad.
Cómo se suministra/almacenamiento y manipulación
IC-Green® se suministra en un kit (NDC 17478-701-02) que contiene seis viales de 25 mg de IC-Green® y seis ampollas de 10 mL de agua estéril para inyección, USP:
NDC 17478-701-25 IC-Green® vial. Relleno de 25 mg en vial de 20 mL.
NDC 17478-701-10 Agua estéril para inyección, ampolla USP. Rellenar 10 mL en ampolla de 10 mL.
Almacenamiento: Almacenar a 20° a 25°C (68° a 77°F).
AKORN
Fabricado por: Akorn, Inc.
Lake Forest, IL 60045
IG00N Rev. 06/16
Texto principal del panel de visualización para la etiqueta del envase:
NDC 17478-701-25
IC-Green®
(verde de indocianina
para inyección, USP)
25 mg Sterile Rx only

Texto principal del panel de visualización para la etiqueta del cartón:
Logotipo de Akorn NDC 17478-701-02
IC-Green®
(verde de indocianina
para inyección, USP)
25 mg kit
Sólo Rx estéril

Texto principal del panel de visualización para la etiqueta del envase:
NDC 17478-701-10
Agua estéril
para inyección, USP
para IC-Green® (indocianina
verde para inyección, USP)
10 mL Sterile Rx only

Texto principal del panel de visualización para la etiqueta de la caja:
NDC 17478-701-10
Logotipo de Akorn
Agua estéril
para inyección, USP
para IC-Green®
(verde de indocianina
para inyección, USP)
Estéril
6 Ampollas
(10 mL cada una) Rx only

| IC-Verde kit de verde de indocianina |
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
Parte 1 de 2 IC-Verde
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
Parte 2 de 2 SOLVENTE ACUOSO
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
Etiquetadora – Akorn, Inc. (117696770)
Registrador – Akorn Operating Company LLC (117693100)
| Establecimiento | |||
| Nombre | Dirección | ID/FEI | Operaciones |
| Akorn, Inc. | 117696790 | LABEL(17478-701), PACK(17478-701) | |
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| Akorn, Inc. | 117696832 | Fabricación(17478-701), Análisis(17478-701), Esterilización(17478-701) | |
