US Pharm. 2020;45(5)(Specialty&Oncology suppl):3-8.
ABSTRACT: En los últimos años, se han desarrollado varias opciones nuevas de terapia dirigida para combatir la resistencia a la terapia endocrina tradicional para el cáncer de mama avanzado. Se han aprobado tres inhibidores de la CDK4/6 (palbociclib, ribociclib y abemaciclib) para pacientes con cáncer de mama avanzado con receptor hormonal positivo y receptor del factor de crecimiento epidérmico humano 2 negativo. Cada agente ha demostrado su eficacia, pero existen diferencias entre los tres fármacos, sobre todo en sus perfiles de efectos adversos.
El cáncer de mama es el tipo de cáncer más frecuente en las mujeres, con más de 276.000 nuevos casos estimados en 2020.1 El cáncer de mama con receptores hormonales positivos (HR+), que representa más del 70% de estos casos, se ha tratado históricamente con terapia endocrina (TE), como los inhibidores selectivos de los receptores de estrógenos y los inhibidores de la aromatasa (IA). Aunque la TE sigue siendo la espina dorsal del tratamiento del cáncer de mama HR+, la resistencia se desarrolla en hasta el 50% de las pacientes con cáncer de mama avanzado.2 Para combatir la resistencia, se han aprobado terapias dirigidas para el cáncer de mama HR+.3,4
Los inhibidores de la quinasa dependiente de la ciclina (CDK), la clase más reciente de interés para el cáncer de mama avanzado, funcionan inhibiendo específicamente las proteínas CDK4/6 y bloqueando la transición de la fase G1 a la fase S del ciclo celular. Esta clase de fármacos inhibe la actividad de las quinasas, que fosforilan la vía de la proteína retinoblastoma. Al bloquear esta vía, los inhibidores de la CDK4/6 son capaces de bloquear la progresión del ciclo celular en la mitad de la fase G1 y evitar la progresión de las células cancerosas. En los últimos años, se han aprobado tres inhibidores de CDK4/6 (palbociclib, ribociclib y abemaciclib) como terapias combinadas para los cánceres de mama avanzados o metastásicos HR+, con receptor del factor de crecimiento epidérmico humano 2 negativo (HER2-).5-8 En este artículo se revisan las diferencias de estos agentes (TABLA 1), los ensayos clínicos de fase III (TABLA 2) y los perfiles de acontecimientos adversos (TABLA 3).
Palbociclib
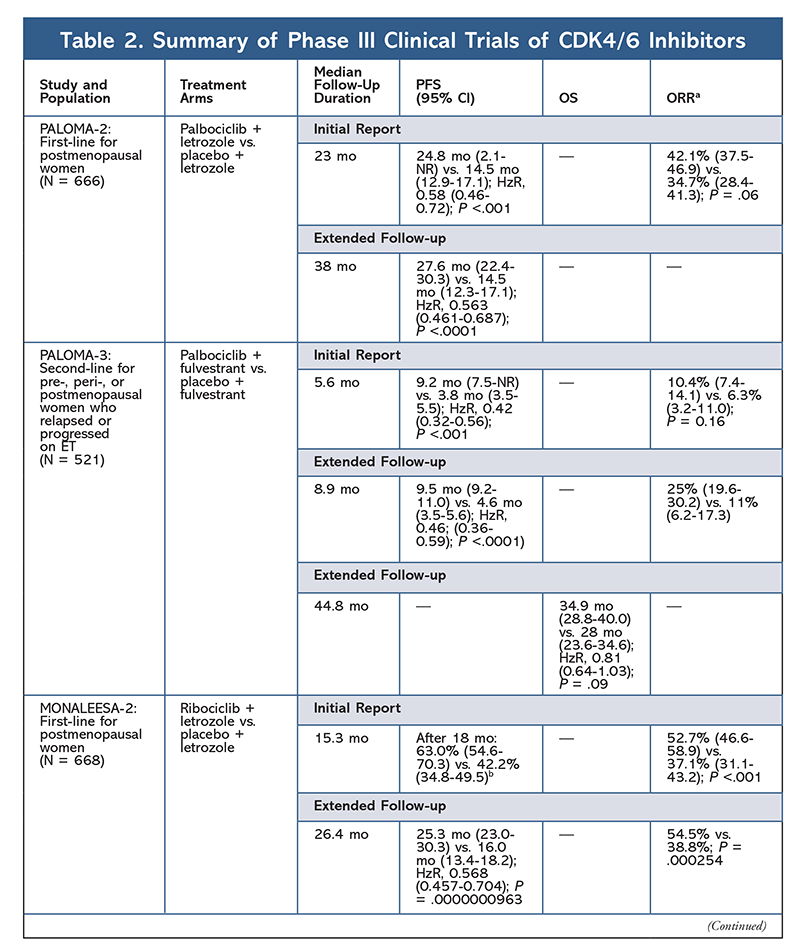
En 2015, palbociclib se convirtió en el primer inhibidor de la CDK4/6 que recibió la aprobación de la FDA para el tratamiento del cáncer de mama HR+, HER2- (en combinación con un IA como TE inicial en mujeres posmenopáusicas o en hombres, o en combinación con fulvestrant en pacientes con progresión de la enfermedad tras el TE).6,9-14 Palbociclib recibió inicialmente la aprobación tras los resultados positivos del estudio de fase II PALOMA-1, en el que se comparó palbociclib más letrozol con letrozol solo como tratamiento inicial para pacientes con cáncer de mama avanzado no tratados con TE.9
Estos resultados condujeron a la realización de dos ensayos de fase III en los que se evaluó el efecto de palbociclib en esta población de pacientes. Los resultados iniciales de PALOMA-2 confirmaron los efectos de palbociclib más letrozol, demostrando una mejor supervivencia libre de progresión (SLP) frente a letrozol solo (24,8 meses frente a 14,5 meses, respectivamente; cociente de riesgo de progresión de la enfermedad o muerte, 0,58; IC del 95%, 0,46-0,72; P <.001). Un estudio de seguimiento a largo plazo a los 38 meses confirmó aún más el efecto de palbociclib sobre la SLP, con un aumento a 27,6 meses frente a 14,5 meses para letrozol solo (HzR, 0,563; IC del 95%, 0,461-0,687; P <.0001). El estudio de seguimiento también informó de una mejora consistente de la SLP con palbociclib más letrozol en todos los subgrupos estudiados, así como de un retraso en la mediana de tiempo hasta el inicio del tratamiento posterior. Sin embargo, los datos de supervivencia global (SG) de los informes inicial y de seguimiento eran inmaduros, y se está realizando un seguimiento de la supervivencia de las pacientes inscritas.10,11
Poco después del inicio de PALOMA-2, se inició otro ensayo de fase III, PALOMA-3, para evaluar la seguridad y la eficacia de palbociclib más fulvestrant en mujeres premenopáusicas o posmenopáusicas con cáncer de mama avanzado HR+ que progresó con la TE anterior. El informe inicial tras 5,6 meses de seguimiento mostró una mejora de la mediana de la SLP (9,2 meses frente a 3,8 meses), con una reducción del 58% de la progresión (HzR, 0,42; IC del 95%, 0,32-0,56; P <.001).12 Un análisis preespecificado de la SG en el ensayo PALOMA-3, utilizando una mediana de seguimiento de 44.8 meses, encontró que las diferencias en la SG para todo el grupo de intención de tratamiento no alcanzaron significación estadística, pero la combinación prolongó la SG en 10 meses en los pacientes que eran sensibles a la TE previa.14
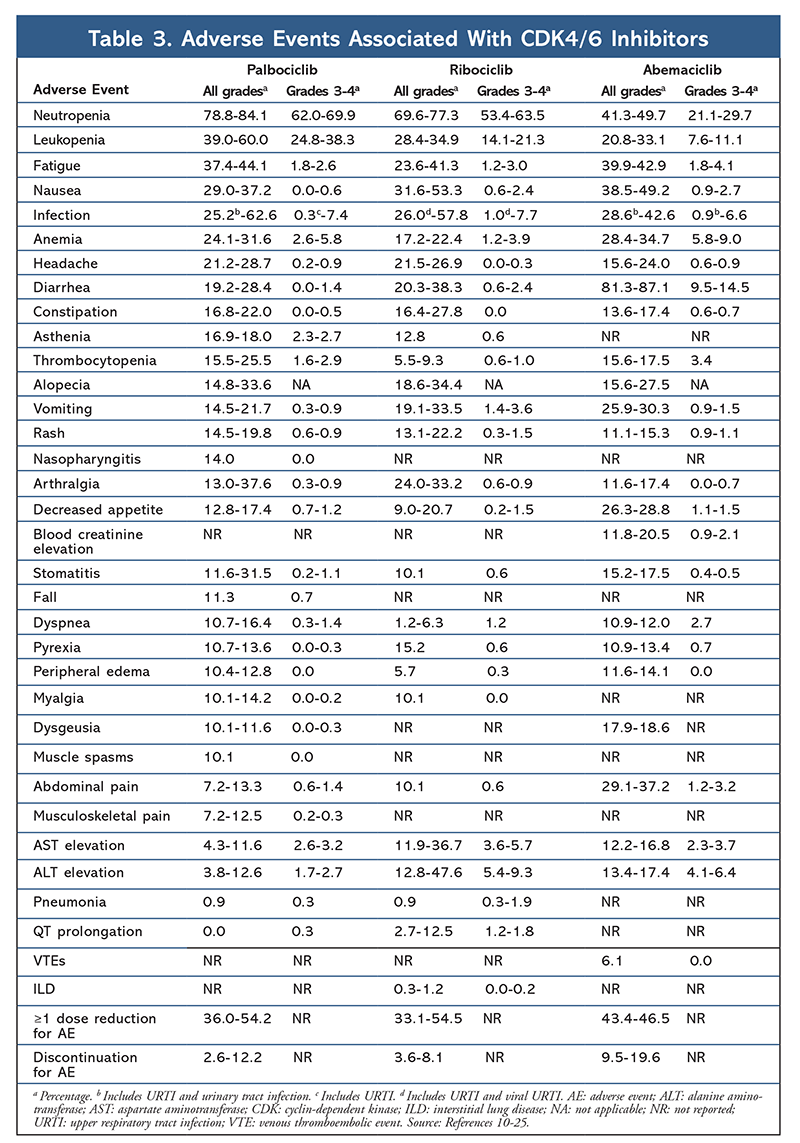
El perfil de EAs se mantuvo consistente en todos los informes de los ensayos (TABLA 3), siendo la neutropenia de todo grado (78,8%-84,1%), la leucopenia (39%-60%) y la fatiga (37,4%-44,1%) los EAs más frecuentemente notificados. Las tasas de neutropenia fueron elevadas; sin embargo, la neutropenia febril fue rara (hasta el 2%). La tolerabilidad general de palbociclib se consideró manejable, y el agente arrojó datos positivos sobre la calidad de vida cuando se utilizó en terapia combinada en comparación con la monoterapia endocrina.9,14
Ribociclib
Un segundo inhibidor de CDK4/6, ribociclib, fue aprobado por la FDA en 2017 con una población de pacientes indicada más amplia. Ribociclib está aprobado para mujeres posmenopáusicas y pre o perimenopáusicas con cáncer de mama HR+, HER2- avanzado o metastásico (como terapia de combinación con un IA como TE inicial o, en mujeres posmenopáusicas, combinado con fulvestrant como TE inicial o tras la progresión de la enfermedad en el TE).7
Ribociclib recibió por primera vez la aprobación de la FDA después de que el ensayo MONALEESA-2 descubriera que la SLP mejoraba cuando el fármaco se administraba en combinación con letrozol frente a letrozol solo. Las tasas de SLP evaluadas localmente frente al letrozol solo después de 18 meses fueron del 63,0% (IC del 95%, 54,6-70,3) y del 42,2% (IC del 95%, 34,8-49,5), respectivamente.15 Un informe de seguimiento ampliado a 26,4 meses demostró además la eficacia y la tolerabilidad de la combinación.16 A pesar de la mejora de la SLP, los datos de SG de MONALEESA-2 siguen siendo inmaduros.
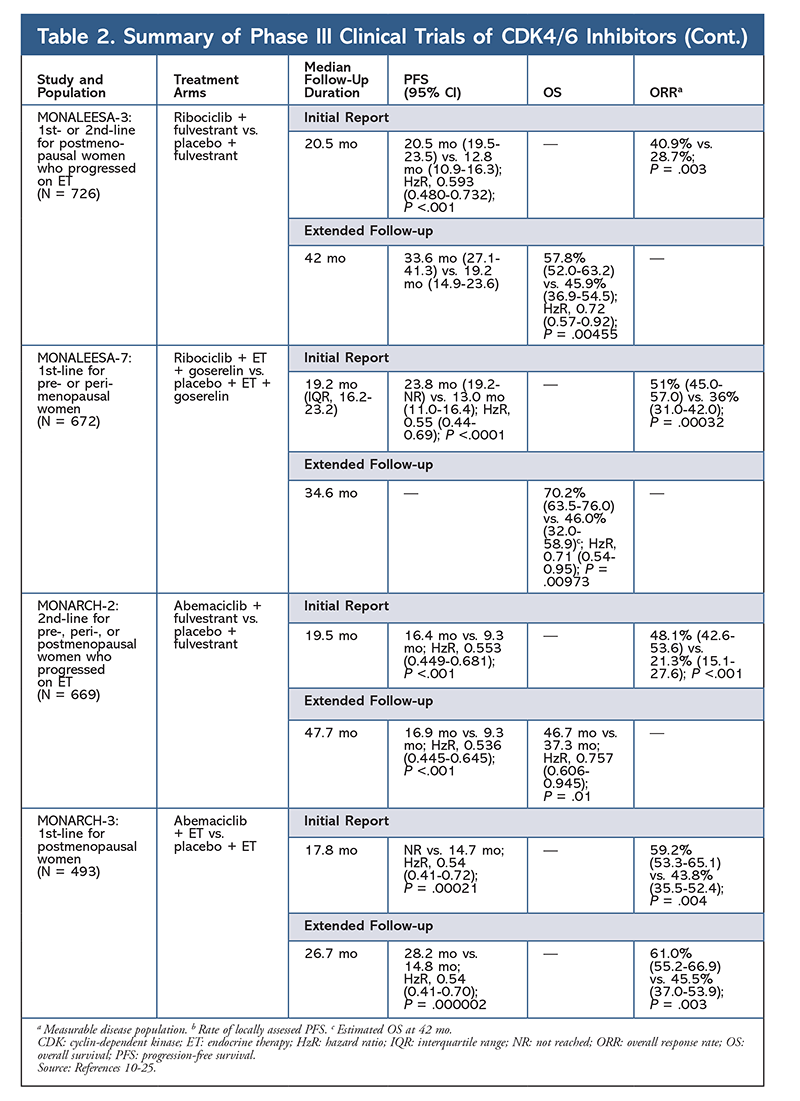
También se está investigando Ribociclib (en MONALEESA-3) en combinación con fulvestrant en pacientes que no han recibido tratamiento y en las que han recaído después de la TE. El informe inicial reveló una mejora de la SLP para la combinación en comparación con el fulvestrant solo (20,5 meses frente a 12,8 meses, respectivamente; HzR, 0,593; IC del 95%, 0,480-0,732; P <.001), lo que dio lugar a la aprobación de esta combinación por parte de la FDA.17 Un segundo informe, el más reciente, sobre el inhibidor CDK4/6, que tuvo 21,6 meses adicionales de seguimiento, demostró además la mejora constante de la SLP. Este informe también demostró el beneficio de la SG de ribociclib más fulvestrant en comparación con fulvestrant solo, con una SG estimada a los 42 meses del 57,8% frente al 45,9%, respectivamente, y una reducción del 28% del riesgo relativo de muerte (HzR, 0,72; IC del 95%, 0,57-0.92; P = 0,00455).18
Un tercer ensayo clínico, MONALEESA-7, es actualmente el único ensayo de fase III que evalúa la eficacia y la seguridad de un inhibidor de la CDK4/6 como tratamiento de primera línea para mujeres pre o perimenopáusicas con cáncer de mama metastásico. En este ensayo, ribociclib más tamoxifeno o un IA no esteroideo (AINE) -como letrozol o anastrozol- más goserelina mejoró significativamente la SLP en 23,8 meses frente a los 13 meses del grupo de placebo (HzR, 0,55; IC del 95%, 0,44-0,69; P <.0001), y la combinación condujo a la indicación ampliada que incluye a las mujeres pre y perimenopáusicas.19 Un informe de seguimiento ampliado demostró el beneficio de la SG de la combinación de ribociclib más tamoxifeno o un AINE más goserelina en comparación con el placebo, con una SG estimada a los 42 meses del 70,2% frente al 46,0%.20
El perfil de toxicidad de ribociclib es muy similar al de palbociclib, siendo la neutropenia y la leucopenia los EA de mayor grado y gravedad (grados 3/4) notificados, aunque en tasas inferiores a las de palbociclib (TABLA 3).15-20 La neutropenia febril fue poco frecuente y no surgieron nuevos problemas de seguridad con la exposición prolongada a ribociclib en ninguno de los informes de seguimiento ampliado.
Abemaciclib
El tercer inhibidor de CDK4/6 aprobado por la FDA es abemaciclib. Este agente está indicado en combinación con un IA como TE inicial en mujeres posmenopáusicas con cáncer de mama avanzado, o en combinación con fulvestrant en mujeres pre, peri o posmenopáusicas con progresión de la enfermedad tras la TE. El abemaciclib también está aprobado como monoterapia en hombres y mujeres con progresión de la enfermedad tras la TE y quimioterapia previa en el contexto metastásico.6 El agente obtuvo inicialmente la aprobación sobre la base de los resultados de MONARCH-1, que demostraron una actividad clínica prometedora después de 12 meses, con una tasa de respuesta global (ORR) del 19,7% (IC del 95%, 13,3-27,5) y una mediana de la SLP de 6 meses.5,21 Durante este tiempo, el abemaciclib también se estaba investigando en MONARCH-2 para mujeres pre, peri y posmenopáusicas que progresaron con la TE. Este estudio demostró un beneficio de la SLP estadísticamente significativo con una combinación de abemaciclib más fulvestrant frente a fulvestrant solo (16,4 meses frente a 9,3 meses; HzR, 0,553; IC del 95%, 0,449-0,681; P <.001).22 Un estudio de seguimiento ampliado con una duración media de 477 meses informó de una ligera mejora de los resultados de la SLP y del beneficio de la SG con la combinación de abemaciclib frente a placebo y fulvestrant (46,7 meses frente a 37,3 meses; IC del 95%, 0,606-0,945; P = 0,01).23
Poco después del inicio de los dos ensayos de abemaciclib, se inició el ensayo MONARCH-3. Este ensayo encontró una mejora estadísticamente significativa en la SLP y la RUP con abemaciclib más un AINE en comparación con el brazo de placebo más AINE como tratamiento de primera línea para mujeres posmenopáusicas. Un informe actualizado con 8,9 meses de seguimiento adicional confirmó aún más los resultados de la SLP y la RUP del análisis inicial; sin embargo, los datos de la SG siguen siendo inmaduros, y el análisis final de la SG se llevará a cabo después de 315 eventos.24,25
En general, se ha observado que abemaciclib es el inhibidor más potente de la CDK4/6, con una excelente actividad en el sistema nervioso central debido a su estructura, que le permite atravesar la barrera hematoencefálica y permanecer en el objetivo durante más tiempo.5 Esto puede ser beneficioso para las pacientes con metástasis cerebrales. Aunque abemaciclib también presenta altos porcentajes de EA hematológicos, estos índices son mucho más bajos que los de otros inhibidores de CDK4/6. Abemaciclib se asocia con más toxicidades gastrointestinales, como la diarrea, que otros inhibidores de CDK4/6 (todos los grados: 81,3%-87,1%; grados 3-4: 9,5%-14,5%).22-25
El papel del farmacéutico
En general, los perfiles de EA de los distintos inhibidores de CDK 4/6 son similares, pero cada fármaco tiene EA únicos. Los EA más comunes notificados con los inhibidores de CDK4/6 son neutropenia, leucopenia, fatiga, náuseas, infección, artralgia, anemia, cefalea y diarrea (TABLA 3). Aparte de la neutropenia y la leucopenia, la mayoría de los pacientes notificaron EA de grado 1 o 2. La neutropenia y la leucopenia de grado 3 ó 4, que fueron muy comunes con todos los inhibidores de las CDK, en particular con palbociclib y ribociclib, se trataron principalmente con la interrupción y/o reducción de la dosis. El hemograma del paciente debe controlarse al inicio, cada dos semanas durante los dos primeros ciclos, al comienzo de cada uno de los cuatro ciclos siguientes y según sea clínicamente necesario para la supresión de la médula ósea.6-8 Las caídas, los espasmos musculares y la nasofaringitis se asocian a palbociclib, pero son leves en la mayoría de los casos.10,11,14 Se ha notificado una baja incidencia de prolongación del QT con ribociclib.15-20 Abemaciclib se asoció a una incidencia significativamente mayor de diarrea en comparación con palbociclib y ribociclib; los casos se produjeron sobre todo durante el primer ciclo y pudieron controlarse con un tratamiento antidiarreico.22-25 Abemaciclib se asoció con elevación de la creatinina sérica y eventos tromboembólicos venosos (en su mayoría leves), que no se informaron en el caso de palbociclib y ribociclib, y una mayor incidencia de dolor abdominal.22-25 En particular, en septiembre de 2019, la FDA advirtió que en pacientes tratados con inhibidores de CDK4/6 puede producirse una enfermedad pulmonar intersticial (EPI) rara pero grave, potencialmente mortal o neumonitis.26 Por lo tanto, los pacientes deben ser controlados regularmente para detectar síntomas pulmonares indicativos de EPI y/o neumonitis.
Conclusión
Las aprobaciones de palbociclib, ribociclib y abemaciclib en los últimos años han ampliado las opciones de tratamiento para los pacientes con cáncer de mama avanzado. Aunque todos ellos poseen el mismo mecanismo de acción, estos fármacos presentan ligeras diferencias en cuanto a eficacia y seguridad. Varios estudios en curso, además de los mencionados en esta revisión, siguen explorando estos inhibidores en diferentes poblaciones de pacientes y con diferentes combinaciones de tratamiento. El potencial de estos agentes para ampliar el uso de los inhibidores de la CDK4/6 en entornos distintos del cáncer de mama avanzado HR+ y HER2 parece prometedor.27
1. Siegel RL, Miller KD, Jemal A. Cancer statistics, 2020. CA Cancer J Clin. 2020;70(1):7-30.
2. Preusser M, De Mattos-Arruda L, Thill M, et al. Inhibidores de CDK4/6 en el tratamiento de pacientes con cáncer de mama: resumen de una mesa redonda multidisciplinar. ESMO Open. 2018;3(5):e000368.
3. Tripathy D, Bardia A, Sellers WR. Ribociclib (LEE011): mecanismo de acción e impacto clínico de este inhibidor selectivo de la quinasa dependiente de ciclina 4/6 en varios tumores sólidos. Clin Cancer Res. 2017;23(13):3251-3262.
4. Portman N, Alexandrou S, Carson E, et al. Superación de la resistencia a los inhibidores de CDK4/6 en el cáncer de mama ER-positivo. Endocr Relat Cancer. 2019;26(1):R15-R30.
5. Sobhani N, D’Angelo A, Pittacolo M, et al. Actualizaciones de la estrategia y combinaciones de inhibidores de CDK4/6 en el cáncer de mama. Cells. 2019;8(4):E321.
6. Prospecto de Ibrance (palbociclib). Nueva York, NY: Pfizer Inc; septiembre de 2019.
7. Prospecto de Kisqali (ribociclib). East Hanover, NJ: Novartis Pharmaceuticals Corp; septiembre de 2019.
8. Prospecto de Verzenio (abemaciclib). Indianápolis, IN: Eli Lilly and Co; septiembre de 2019.
9. Finn RS, Crown JP, Lang I, et al. El inhibidor de la quinasa dependiente de ciclina 4/6 palbociclib en combinación con letrozol frente a letrozol solo como tratamiento de primera línea del cáncer de mama avanzado con receptor de estrógeno positivo y HER2 negativo (PALOMA-1/TRIO-18): un estudio aleatorizado de fase 2. Lancet Oncol. 2015;16(1):25-35.
10. Finn RS, Martin M, Rugo HS, et al. Palbociclib y letrozol en cáncer de mama avanzado. N Engl J Med. 2016;375(20):1925-1936.
11. Rugo HS, Finn RS, Diéras V, et al. Palbociclib más letrozol como terapia de primera línea en cáncer de mama avanzado con receptor de estrógeno positivo/receptor del factor de crecimiento epidérmico humano 2 negativo con seguimiento prolongado. Tratamiento de la investigación del cáncer de mama. 2019;174(3):719-729.
12. Turner NC, Ro J, André F, et al. Palbociclib en cáncer de mama avanzado con receptores hormonales positivos. N Engl J Med. 2015;373(3):209-219.
13. Cristofanilli M, Turner NC, Bondarenko I, et al. Fulvestrant más palbociclib frente a fulvestrant más placebo para el tratamiento del cáncer de mama metastásico con receptores hormonales positivos y HER2 negativo que ha progresado con el tratamiento endocrino previo (PALOMA-3): análisis final del ensayo controlado aleatorio multicéntrico, doble ciego, de fase 3. Lancet Oncol. 2016;17(4):425-439.
14. Turner NC, Slamon DJ, Ro J, et al. Supervivencia global con palbociclib y fulvestrant en cáncer de mama avanzado. N Engl J Med. 2018;379(20):1926-1936.
15. Hortobagyi GN, Stemmer SM, Burris HA, et al. Ribociclib como terapia de primera línea para el cáncer de mama avanzado con RH positivo. N Engl J Med. 2016;375(18):1738-1748.
16. Hortobagyi GN, Stemmer SM, Burris HA, et al. Resultados actualizados de MONALEESA-2, un ensayo de fase III de ribociclib más letrozol en primera línea frente a placebo más letrozol en cáncer de mama avanzado con receptores hormonales positivos y HER2 negativo. Ann Oncol. 2018;29(7):1541-1547.
17. Slamon DJ, Neven P, Chia S, et al. Estudio aleatorizado de fase III de ribociclib y fulvestrant en cáncer de mama avanzado con receptor hormonal positivo y receptor del factor de crecimiento epidérmico humano 2 negativo: MONALEESA-3. J Clin Oncol. 2018;36(24):2465-2472.
18. Slamon DJ, Neven P, Chia S, et al. Supervivencia global con ribociclib más fulvestrant en cáncer de mama avanzado. N Engl J Med. 2020;382(6):514-524.
19. Tripathy D, Im SA, Colleoni M, et al. Ribociclib más terapia endocrina para mujeres premenopáusicas con cáncer de mama avanzado con receptores hormonales positivos (MONALEESA-7): un ensayo aleatorio de fase 3. Lancet Oncol. 2018;19(7):904-915.
20. Im SA, Lu YS, Bardia A, et al. Supervivencia global con ribociclib más terapia endocrina en cáncer de mama. N Engl J Med. 2019;381(4):307-316.
21. Dickler MN, Tolaney SM, Rugo HS, et al. MONARCH 1, un estudio de fase II de abemaciclib, un inhibidor de CDK4 y CDK6, como agente único, en pacientes con cáncer de mama metastásico HR+/HER2- refractario. Clin Cancer Res. 2017;23(17):5218-5224.
22. Sledge GW Jr, Toi M, Neven P, et al. MONARCH 2: abemaciclib en combinación con fulvestrant en mujeres con cáncer de mama avanzado HR+/HER2- que habían progresado mientras recibían terapia endocrina. J Clin Oncol. 2017;35(25):2875-2884.
23. Sledge GW Jr, Toi M, Neven P, et al. El efecto de abemaciclib más fulvestrant en la supervivencia global en el cáncer de mama con receptores hormonales positivos y ERBB2 negativo que progresó con la terapia endocrina-MONARCH 2: un ensayo clínico aleatorizado. JAMA Oncol. 2020;6(1):116-124.
24. Goetz MP, Toi M, Campone M, et al. MONARCH 3: abemaciclib como terapia inicial para el cáncer de mama avanzado. J Clin Oncol. 2017;35(32):3638-3646.
25. Johnston S, Martin M, Di Leo A, et al. MONARCH 3 final PFS: un estudio aleatorizado de abemaciclib como terapia inicial para el cáncer de mama avanzado. NPJ Breast Cancer. 2019;17(5):5.
26. FDA. La FDA advierte sobre una rara pero grave inflamación pulmonar con Ibrance, Kisqali y Verzenio para el cáncer de mama. www.fda.gov/drugs/drug-safety-and-availability/fda-warns-about-rare-severe-lung-inflammation-ibrance-kisqali-and-verzenio-breast-cancer. Consultado el 15 de enero de 2020.
27. Shah M, Nunes MR, Stearns V. Inhibidores de CDK4/6: ¿cambiadores de juego en el tratamiento del cáncer de mama avanzado con receptores hormonales positivos? Oncología (Williston Park). 2018;32(5):216-222.
El contenido de este artículo tiene únicamente fines informativos. El contenido no pretende ser un sustituto del asesoramiento profesional. La confianza en cualquier información proporcionada en este artículo es únicamente bajo su propio riesgo.
