Dipolmomentumok
Az aszimmetrikus töltéseloszlás egy poláris anyagban, például a HCl-ben dipolmomentumot eredményez, ahol \( Qr \) méterben (m). a görög mu (µ) betűvel rövidül. A dipólusmomentumot a kötött atomok Q parciális töltésének és a parciális töltések közötti r távolságnak a szorzataként határozzuk meg.
Ha egy dipólusmomentummal rendelkező molekula elektromos térbe kerül, aszimmetrikus töltéseloszlása miatt hajlamos az elektromos térrel együtt tájékozódni (\(\PageIndex{4}\) ábra).
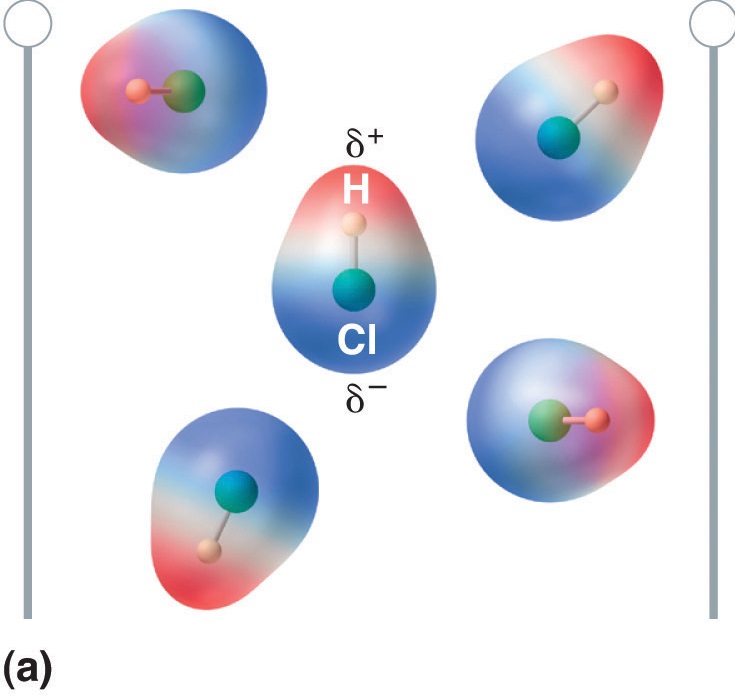
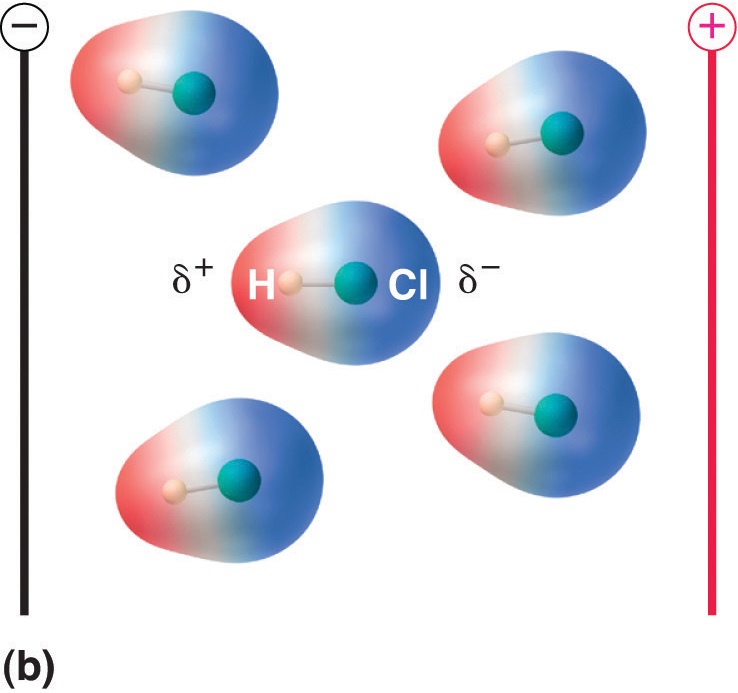
Ábra \(\PageIndex{5}\): A dipolmomentummal rendelkező molekulák részben igazodnak az alkalmazott elektromos mezőhöz. Mező hiányában (a) a HCl-molekulák véletlenszerűen orientálódnak. Ha elektromos teret alkalmazunk (b), a molekulák hajlamosak a mezőhöz igazodni, úgy, hogy a molekuláris dipólus pozitív vége a negatív végpont felé mutat és fordítva.
A HCl mért dipólusmomentuma azt jelzi, hogy a H-Cl kötés körülbelül 18%-ban ionos jellegű (0,1811 × 100), vagy 82%-ban kovalens jellegű. Ahelyett, hogy a HCl-t
\
írnánk, a töltésszétválasztást ezért kvantitatív módon
\
A számítási eredményeink összhangban vannak a hidrogén és a klór elektronegativitáskülönbségével χH = 2,20; χCl = 3,16, χCl – χH = 0,96), ami jóval a poláros kovalens kötésekre jellemző tartományon belüli érték. A dipólusmomentumot a molekula fölé írt nyíllal jelezzük. Matematikailag a dipólusmomentumok vektorok, amelyeknek van nagyságuk és irányuk is. A molekula dipólusmomentuma az egyes kötések dipólusainak vektoros összege. A HCl-ben például a dipólusmomentumot a következőképpen jelölik:
![]()
A nyíl az elektronáramlás irányát mutatja azáltal, hogy az elektronegatívabb atom felé mutat.
A gázfázisban sok anyag atomjainak töltése kiszámítható a mért dipólusmomentumok és kötéstávolságok segítségével. A \(\PageIndex{6}\) ábra több anyag esetében mutatja a százalékos ionos jelleg ábrázolását a kötött atomok elektronegativitásának különbségével szemben. A grafikon szerint az olyan fajok kötése, mint a NaCl(g) és a CsF(g), lényegesen kisebb, mint 100%-ban ionos jellegű. Ahogy azonban a gáz szilárd anyaggá sűrűsödik, a polarizált fajok közötti dipólus-dipólus kölcsönhatások növelik a töltéskülönbségeket. A kristályban tehát egy elektron átkerül a fémből a nemfémbe, és ezek az anyagok klasszikus ionos vegyületekként viselkednek. A \(\PageIndex{6}\) ábra adatai azt mutatják, hogy az 1,5-nél kisebb elektronegativitáskülönbségű kétatomos fajok kevesebb, mint 50%-ban ionos jellegűek, ami összhangban van azzal a korábbi leírásunkkal, miszerint ezek a fajok poláris kovalens kötéseket tartalmaznak. A dipólusmomentumok használatát a poláris kötések ionos jellegének meghatározására a \(\PageIndex{2}\) példa szemlélteti.
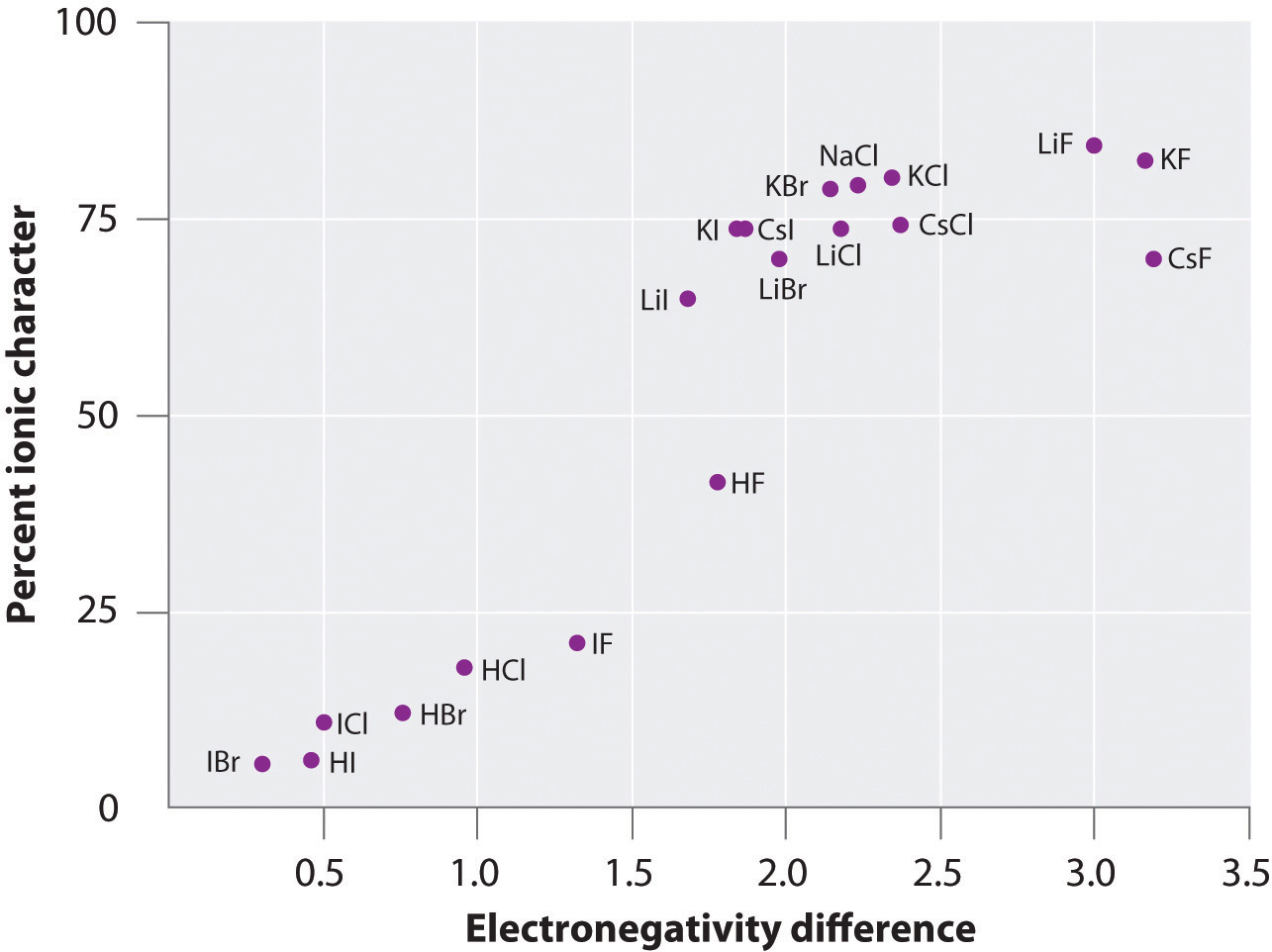
Ábra \(\PageIndex{6}\): Gázfázisban még a CsF sem 100%-ban ionos, még az atomok közötti legnagyobb elektronegativitás-különbséggel rendelkező CsF sem. A szilárd CsF azonban a rácsban lévő további elektrosztatikus kölcsönhatások miatt leginkább 100%-ban ionosnak tekinthető.
