Entalpia
A termodinamika a hő (vagy energia) és a munka közötti kapcsolat tanulmányozása. Az entalpia a termodinamika központi tényezője. Ez egy rendszer hőtartalma. A reakció során a rendszerbe vagy a rendszerből távozó hő az entalpiaváltozás. Az, hogy a rendszer entalpiája növekszik-e (azaz energia hozzáadásakor) vagy csökken (mert energia távozik), döntő tényező, amely meghatározza, hogy egy reakció végbemehet-e.
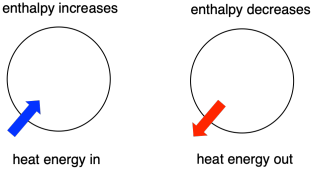
Máskor a változáson áteső molekulák energiáját “belső entalpiának” nevezzük. Néha “a rendszer entalpiájának” nevezzük. Ez a két kifejezés ugyanarra a dologra utal. Hasonlóképpen a reakcióban részt nem vevő molekulák energiáját “külső entalpiának” vagy “a környezet entalpiájának” nevezzük.
Gyakorlatilag az energiaváltozások, amelyeket a termodinamika bevezetőjében vizsgáltunk, az entalpia változásai voltak. A következő részben látni fogjuk, hogy van egy másik energetikai tényező, az entrópia, amelyet szintén figyelembe kell vennünk a reakciókban. Egyelőre csak az entalpiát fogjuk megvizsgálni.
- Az entalpia egy rendszer hőtartalma.
- A reakció entalpiaváltozása nagyjából megegyezik a reakció során elveszett vagy nyert energia mennyiségével.
- Egy reakció akkor kedvező, ha a rendszer entalpiája csökken a reakció során.
Ez utóbbi állítás nagyon hasonlít az előző oldalon található energetika leírására. Ha egy rendszer reakción megy keresztül és energiát ad le, akkor a saját energiatartalma csökken. Kevesebb energiája marad, ha leadott belőle. Miért változik egy molekulacsoport energiája, ha reakció lép fel? Ahhoz, hogy erre választ kapjunk, át kell gondolnunk, mi történik egy kémiai reakcióban.
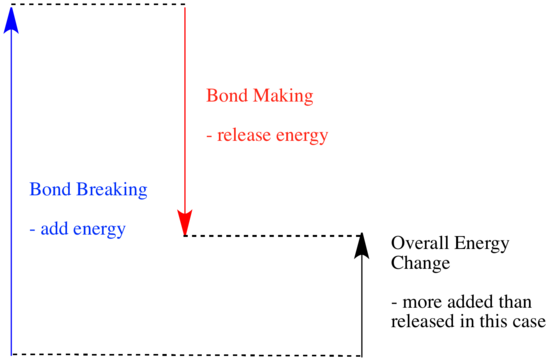
Egy reakcióban a kémiai kötés megváltozik. A reaktánsok egyes kötései megszakadnak, és új kötések jönnek létre a termékek kialakulásához. A kötések felbontása energiába kerül, de az új kötések létrejöttekor energia szabadul fel.
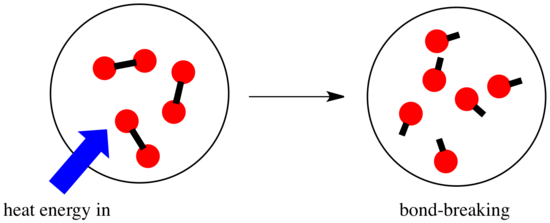
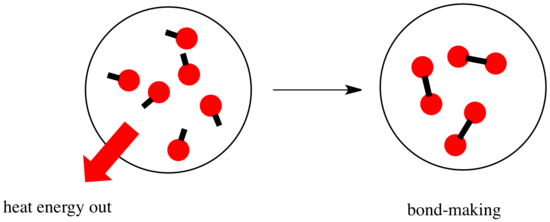
Az, hogy egy reakció képes-e előrehaladni, függhet e kötésképző és kötésbontó lépések közötti egyensúlytól.
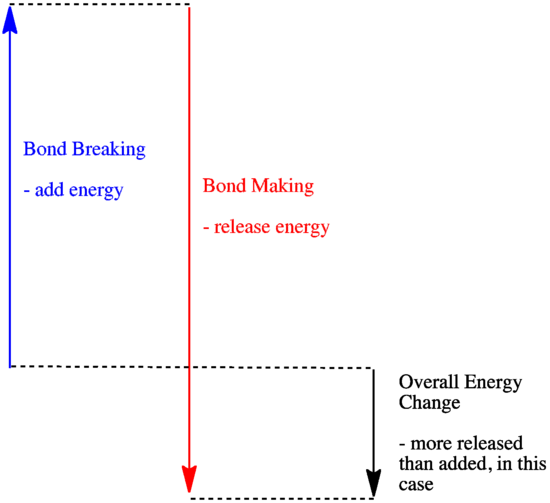
- Egy reakció exoterm, ha az új kötések képződésével több energia szabadul fel, mint amennyi a régi kötések felbontásával elfogy.
- Egy reakció exoterm, ha gyengébb kötések cserélődnek erősebbekre.
- Egy reakció endoterm, ha a kötésbontás több energiába kerül, mint amennyit a kötésképzés biztosít.
A kötési energiák (az az energiamennyiség, amelyet egy kötés felbontásához hozzá kell adni) fontos tényező annak meghatározásában, hogy egy reakció létrejöjjön. A kötéserősségeket nem mindig könnyű megjósolni, mivel egy kötés erőssége számos tényezőtől függ. Sokan azonban rengeteg munkát végeztek a kötéserősségek mérésével, és az információkat táblázatokba gyűjtötték, így ha tudnod kell, milyen erős egy kötés, egyszerűen utánanézhetsz a szükséges információknak.
| Bond | Bond Energy (kcal/mol) | Bond | Bond Energy (kcal/mol) |
| H-H | 104 | O-H | 111 |
| C-C | 83 | C-H | 99 |
| O=O | 119 | N-H | 93 |
| N=N | 226 | C=O | 180 |
Például, tegyük fel, hogy azt szeretnénk tudni, hogy a metán elégetése exoterm vagy endoterm reakció. Én arra tippelek, hogy exoterm, mert ezt a reakciót (és a többi hasonlót) sok otthon hőellátására használják a földgáz kemencékben történő elégetésével.
A metán “elégetése” azt jelenti, hogy levegőn égetik el, tehát oxigénnel lép reakcióba. A szénhidrogének elégetésének termékei többnyire szén-dioxid és víz. A metán (CH4) szénatomja beépül egy szén-dioxid molekulába. A hidrogénatomok vízmolekulákba épülnek be. A metánban négy hidrogénatom van, így ez elég ahhoz, hogy két H2O molekula jöjjön létre.
- A metán elégetése során négy C-H kötést kell felbontani.
- Négy új O-H kötés jön létre, amikor a metánból származó hidrogénatomok új vízmolekulákba épülnek be.
- Két új C=O kötés jön létre, amikor a metánból származó szén egy CO2-molekulába kerül.
A kirakós másik darabja a reakció oxigénforrása. Az oxigén a légkörben többnyire O2 formájában van jelen. Mivel két oxigénatomra van szükségünk a CO2-molekulához és további két oxigénatomra a két vízmolekulához, összesen négy oxigénatomra van szükségünk a reakcióhoz, amit két O2-molekula biztosíthat.
-
Két O=O kötést kell felbontani, hogy a termékek oxigénatomjait biztosítani tudjuk.
Ez összesen négy C-H és két O=O kötés felbontása, valamint két C=O és négy O-H kötés létrehozása. Ez 4 x 99 kcal/mol a C-H kötésekhez és 2 x 119 kcal/mol az O=O kötésekhez, összesen 634 kJ/mol hozzáadott érték. A reakció során 2 x 180 kcal/mol szabadul fel a C=O kötésekért és 4 x 111 kcla/mol az OH kötésekért, összesen 804 kcal/mol. Összességében 170 kcal/mol-lal több szabadul fel, mint amennyi elhasználódik.
Ez azt jelenti, hogy a reakció exoterm, tehát hőt termel. Valószínűleg jó módja az otthonunk fűtésének.
