US Pharm. 2020;45(5)(Specialty&Oncology suppl):3-8.
ABSZTRAKT: Az elmúlt években számos új célzott terápiás lehetőséget fejlesztettek ki az előrehaladott emlőrák hagyományos endokrin terápiájával szembeni rezisztencia leküzdésére. Három CDK4/6-gátlót (palbociclib, ribociclib és abemaciclib) engedélyeztek hormonreceptor-pozitív, humán epidermális növekedési faktor receptor 2-negatív előrehaladott emlőrákban szenvedő betegek számára. Mindegyik szer bizonyította hatékonyságát, de a három gyógyszer között különbségek vannak, különösen a mellékhatásprofiljukban.
Az emlőrák a nők leggyakoribb ráktípusa, 2020-ra több mint 276 000 új esetet becsülnek.1 A hormonreceptor-pozitív (HR+) emlőrákot, amely ezen esetek több mint 70%-át teszi ki, hagyományosan endokrin terápiával (ET), például szelektív ösztrogénreceptor-gátlókkal és aromatázgátlókkal (AI) kezelték. Bár az ET továbbra is a HR+ emlőrák kezelésének gerincét képezi, az előrehaladott emlőrákban szenvedő betegek akár 50%-ánál rezisztencia alakul ki.2 A rezisztencia leküzdésére célzott terápiákat hagytak jóvá a HR+ emlőrák kezelésére.3,4
A ciklinfüggő kináz (CDK) gátlók, az előrehaladott emlőrák legújabb érdekeltségű csoportja, a CDK4/6 fehérjék specifikus gátlásával és a sejtciklus G1 fázisából az S fázisba való átmenet blokkolásával működik. Ez a gyógyszerosztály gátolja a kinázaktivitást, amely foszforilálja a retinoblasztóma fehérje útját. Ennek az útvonalnak a blokkolásával a CDK4/6 inhibitorok képesek a G1 fázis közepén blokkolni a sejtciklus progresszióját és megakadályozni a rákos sejtek progresszióját. Az elmúlt években három CDK4/6-gátlót (palbociclib, ribociclib és abemaciclib) hagytak jóvá kombinációs terápiaként HR+, humán epidermális növekedési faktor receptor 2-negatív (HER2-), előrehaladott vagy áttétes emlőrák esetén5-8. Ez a cikk áttekinti e szerek különbségeit (1. TÁBLÁZAT), a III. fázisú klinikai vizsgálatokat (2. TÁBLÁZAT) és a mellékhatások (AE) profilját (3. TÁBLÁZAT).
Palbociclib
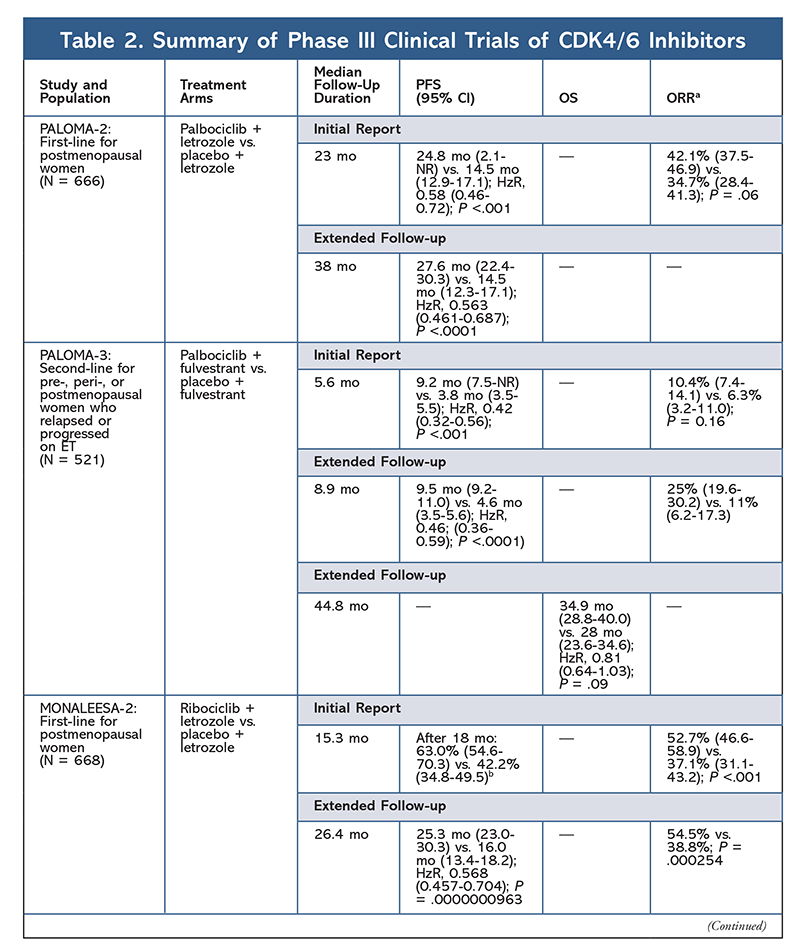
2015-ben a palbociclib lett az első CDK4/6-gátló, amely megkapta az FDA engedélyét HR+, HER2- emlőrák kezelésére (AI-val kombinálva kezdeti ET-ként posztmenopauzás nőknél vagy férfiaknál, vagy fulvestrannal kombinálva olyan betegeknél, akiknél a betegség ET-t követően progresszióra került sor).6,9-14 A palbociclib eredetileg a PALOMA-1 fázisú II. vizsgálat pozitív eredményei után kapta meg az engedélyt, amely a palbociclib és letrozol kombinációját hasonlította össze a letrozollal önmagában ET-naiv előrehaladott emlőrákos betegek kezdeti terápiájaként9 .
Ezek az eredmények két III. fázisú vizsgálathoz vezettek, amelyek tovább értékelték a palbociclib hatását ebben a betegpopulációban. A PALOMA-2 kezdeti eredményei megerősítették a palbociclib plusz letrozol hatását, és jobb progressziómentes túlélést (PFS) mutattak ki a csak letrozollal szemben (24,8 hónap vs. 14,5 hónap; a betegség progressziójának vagy halálának kockázati aránya 0,58; 95% CI, 0,46-0,72; P <.001). A 38 hónapos hosszú távú követéses vizsgálat tovább erősítette a palbociclib PFS-re gyakorolt hatását, amely 27,6 hónapra nőtt, szemben a letrozol önmagában 14,5 hónappal (HzR, 0,563; 95% CI, 0,461-0,687; P <.0001). A követéses vizsgálat a palbociclib plusz letrozol alkalmazásával a PFS konzisztens javulásáról is beszámolt valamennyi vizsgált alcsoportban, valamint a későbbi terápia megkezdéséig eltelt medián idő késéséről. A teljes túlélési (OS) adatok azonban a kezdeti és a követéses jelentésben nem voltak kiforrottak, és a bevont betegeket a túlélés szempontjából követik.10,11
Röviddel a PALOMA-2 kezdete után egy másik III. fázisú vizsgálat, a PALOMA-3 megkezdődött a palbociclib plusz fulvestrant biztonságosságának és hatékonyságának értékelésére premenopauzában vagy posztmenopauzában lévő, HR+ előrehaladott emlőrákban szenvedő, korábbi ET-re progresszívvá vált nőknél. Az 5,6 hónapos követés után készült első jelentés a PFS medián javulását mutatta (9,2 hónap vs. 3,8 hónap), a progresszió 58%-os csökkenésével (HzR, 0,42; 95% CI, 0,32-0,56; P <,001).12 A PALOMA-3 vizsgálatban az OS előre specifikált elemzése, a 44 hónapos medián követési idő felhasználásával.8 hónapos követési idővel, azt találta, hogy az OS-ben a teljes kezelési szándékkal rendelkező csoport esetében a különbségek nem érték el a statisztikai szignifikanciát, de a kombináció 10 hónappal meghosszabbította az OS-t azoknál a betegeknél, akik érzékenyek voltak a korábbi ET-re14.
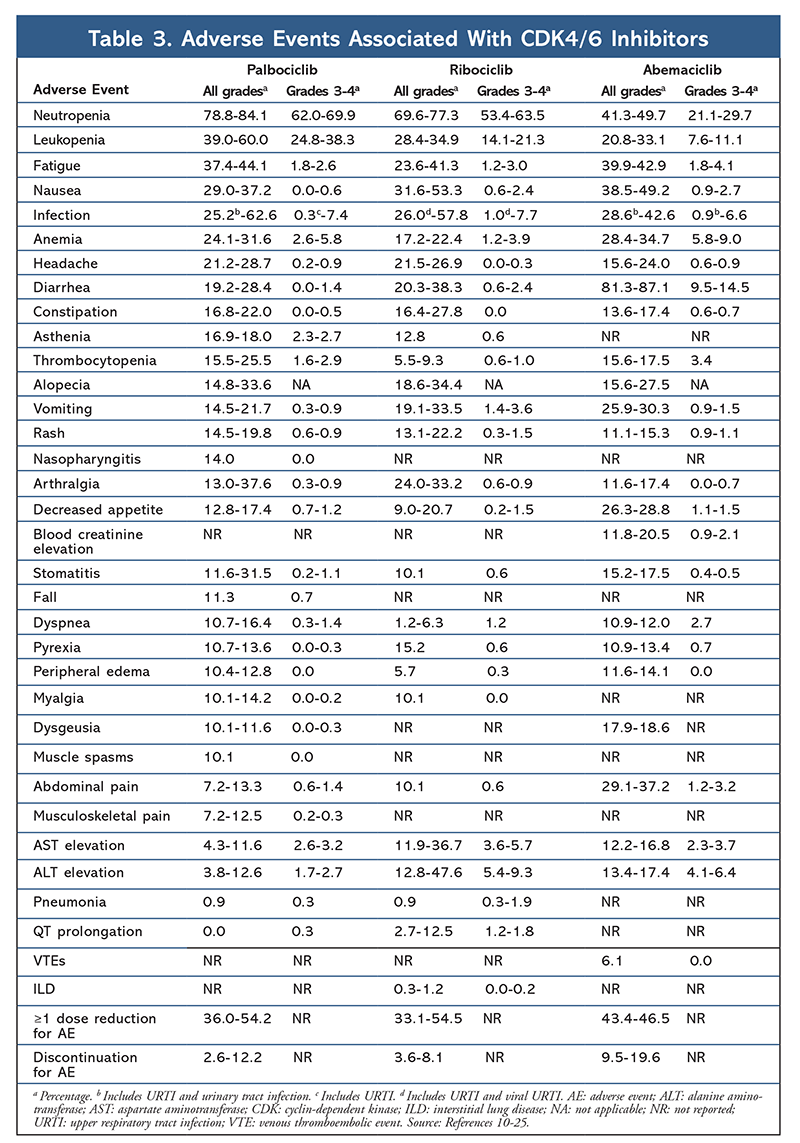
Az AE-profil az összes vizsgálati jelentésben konzisztens maradt (3. TÁBLÁZAT), a leggyakrabban jelentett AE-k a teljes körű neutropenia (78,8%-84,1%), a leukopénia (39%-60%) és a fáradtság (37,4%-44,1%) voltak. A neutropenia aránya magas volt; a lázas neutropenia azonban ritka volt (legfeljebb 2%). A palbociclib általános tolerálhatóságát kezelhetőnek ítélték, és a szer kombinációs terápiában alkalmazva az endokrin monoterápiához képest pozitív életminőségi adatokat eredményezett.9,14
Ribociclib
A második CDK4/6-gátlót, a ribocicliböt 2017-ben engedélyezte az FDA szélesebb indikált betegcsoporttal. A ribociclib a HR+, HER2- előrehaladott vagy áttétes emlőrákban szenvedő posztmenopauzális és pre- vagy perimenopauzális nők számára engedélyezett (AI-val kombinált terápiaként kezdeti ET-ként vagy posztmenopauzális nők esetében fulvestrannal kombinálva kezdeti ET-ként vagy a betegség progresszióját követően ET-re).7
A ribociclib először azt követően kapott FDA-engedélyt, hogy a MONALEESA-2 vizsgálat megállapította, hogy a PFS javult, amikor a gyógyszert letrozollal kombinálva adták, szemben a letrozollal önmagában. A helyileg értékelt PFS aránya 18 hónap után 63,0% (95% CI, 54,6-70,3), illetve 42,2% (95% CI, 34,8-49,5) volt a csak letrozollal szemben.15 Egy kiterjesztett, 26,4 hónapos követéses jelentés tovább bizonyította a kombináció hatékonyságát és tolerálhatóságát.16 A PFS javulása ellenére a MONALEESA-2 OS-adatai még éretlenek.
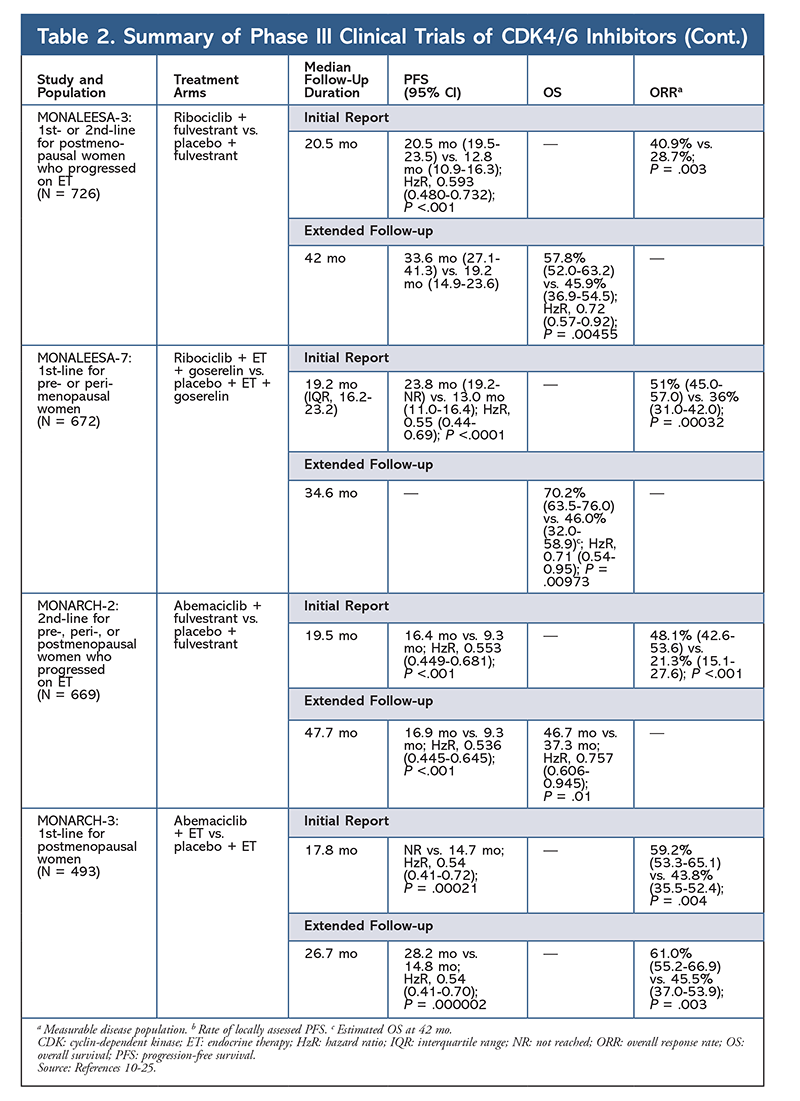
A ribociclib és fulvestrant kombinációját is vizsgálják (a MONALEESA-3-ban) kezelés-naiv és ET után visszaeső betegeknél. Az első jelentés a kombináció jobb PFS-t mutatott ki a fulvestrant önmagához képest (20,5 hónap vs. 12,8 hónap; HzR, 0,593; 95% CI, 0,480-0,732; P <.001), ami ennek a kombinációnak az FDA általi engedélyezését eredményezte.17 Egy második, és a CDK4/6-gátlóról szóló legfrissebb jelentés, amely további 21,6 hónapos követést tartalmazott, tovább bizonyította a következetes PFS javulást. Ez a jelentés is bizonyította a ribociclib plusz fulvestrant OS előnyét a fulvestrant önmagában alkalmazott fulvestranthoz képest: a becsült OS 42 hónapra 57,8% volt a 45,9%-kal szemben, és 28%-kal csökkent a halálozás relatív kockázata (HzR, 0,72; 95% CI, 0,57-0.92; P = .00455).18
A harmadik klinikai vizsgálat, a MONALEESA-7 jelenleg az egyetlen III. fázisú vizsgálat, amely a CDK4/6-gátló hatásosságát és biztonságosságát vizsgálja első vonalbeli terápiaként metasztatikus emlőrákban szenvedő, pre- vagy perimenopauzában lévő nők esetében. Ebben a vizsgálatban a ribociclib plusz tamoxifen vagy egy nem szteroid AI (NSAI) – például letrozol vagy anasztrozol – plusz goserelin jelentősen, 23,8 hónappal javította a PFS-t a placebocsoport 13 hónapjával szemben (HzR, 0,55; 95% CI, 0,44-0,69; P <.0001), és a kombináció vezetett a kiterjesztett indikációhoz, amely a pre- és perimenopauzában lévő nőkre is kiterjed.19 Egy kiterjesztett követéses jelentés bizonyította a ribociclib és a tamoxifen vagy egy NSAI plusz goserelin kombináció OS-előnyét a placebóval szemben, a becsült 42 hónapos OS 70,2% volt 46,0%-kal szemben.20
A ribociclib toxicitási profilja nagymértékben hasonlít a palbociclibéhoz, a neutropenia és a leukopénia a legmagasabb általános és súlyos (3/4 fokozatú) jelentett AE-k, bár alacsonyabb arányban, mint a palbociclib esetében (3. TÁBLA).15-20 A lázas neutropenia ritka volt, és a ribociclib hosszabb expozíciója során nem merültek fel új biztonsági aggályok a kiterjesztett követési jelentések egyikében sem.
Abemaciclib
A harmadik CDK4/6-gátló, amelyet az FDA engedélyezett, az abemaciclib. Ez a szer AI-val kombinálva indikált kezdeti ET-ként posztmenopauzában lévő, előrehaladott emlőrákban szenvedő nőknél, vagy fulvestrannal kombinálva pre-, peri- vagy posztmenopauzában lévő, ET-t követően a betegség progresszióját mutató nőknél. Az abemaciclib monoterápiaként is engedélyezett férfiak és nők esetében, akiknél a betegség ET-t és előzetes kemoterápiát követően metasztatikus környezetben előrehaladt.6 A szer eredetileg a MONARCH-1 eredményei alapján kapta meg a jóváhagyást, amelyek 12 hónap után ígéretes klinikai aktivitást mutattak, 19,7%-os (95% CI, 13,3-27,5) általános válaszaránnyal (ORR) és 6 hónapos medián PFS-sel.5,21 Ez idő alatt az abemaciclibot a MONARCH-2-ben is vizsgálták olyan pre-, peri- és posztmenopauzában lévő nők esetében, akiknél az ET után előrehaladt a betegség. Ez a vizsgálat statisztikailag szignifikáns PFS-előnyt mutatott ki az abemaciclib és fulvestrant kombinációjával szemben a fulvestrant önmagában (16,4 hónap vs. 9,3 hónap; HzR, 0,553; 95% CI, 0,449-0,681; P <.001).22 Egy kiterjesztett követéses vizsgálat, amelynek medián időtartama 47.7 hónapos vizsgálatot követően kissé jobb PFS-eredményekről és OS-előnyről számoltak be az abemaciclib kombinációval szemben a placebóval és a fulvestrannal szemben (46,7 mo vs. 37,3 mo; 95% CI, 0,606-0,945; P = .01).23
Röviddel a két abemaciclib-kísérlet megkezdése után megkezdődött a MONARCH-3 vizsgálat. Ez a vizsgálat statisztikailag szignifikáns javulást talált a PFS és az ORR tekintetében az abemaciclib és egy NSAI kombinációjával a placebo-plus-NSAI karhoz képest a posztmenopauzában lévő nők első vonalbeli kezelésében. Egy frissített jelentés 8,9 hónapos további követési idővel tovább erősítette a kezdeti elemzés PFS- és ORR-eredményeit; az OS-adatok azonban még éretlenek, és a végleges OS-elemzésre 315 esemény után kerül sor.24,25
Az abemaciclib a legerősebb CDK4/6-gátlónak bizonyult, amely szerkezetéből adódóan kiváló központi idegrendszeri aktivitással rendelkezik, így képes átjutni a vér-agy gáton, és tovább marad a célponton.5 Ez előnyös lehet az agyi áttétes betegek esetében. Bár az abemaciclibnek is magas a hematológiai AE-k aránya, ezek az arányok sokkal alacsonyabbak, mint más CDK4/6-gátlók esetében. Az abemaciclib több gasztrointesztinális toxicitással, például hasmenéssel jár, mint a többi CDK4/6-gátló (minden fokozat: 81,3%-87,1%; 3-4. fokozat: 9,5%-14,5%).22-25
A gyógyszerész szerepe
A különböző CDK 4/6-gátlók AE-profilja összességében hasonló, de mindegyik gyógyszer egyedi AE-kkel rendelkezik. A CDK4/6-gátlókkal kapcsolatban leggyakrabban jelentett AE-k a neutropenia, leukopénia, fáradtság, hányinger, fertőzés, arthralgia, anémia, fejfájás és hasmenés (3. TÁBLÁZAT). A neutropenián és a leukopénián kívül a betegek többsége 1-es vagy 2-es fokozatú mellékhatásokról számolt be. A 3. vagy 4. fokozatú neutropeniát és leukopéniát, amelyek valamennyi CDK-gátló, különösen a palbociclib és a ribociclib esetében nagyon gyakoriak voltak, többnyire a dózis megszakításával és/vagy csökkentésével kezelték. A beteg CBC-jét a kezdéskor, az első két ciklusban kéthetente, az azt követő négy ciklus elején, valamint a csontvelő-szuppresszió klinikai szükségessége esetén ellenőrizni kell.6-8 A palbociclib alkalmazásával összefüggésben állt esés, izomgörcsök és orrgaratgyulladás, de ezek az esetek többségében enyhék.10,11,14 A ribociclib mellett a QT-meghosszabbodás alacsony incidenciájáról számoltak be.15-20 Az abemaciclib a palbociclibhez és a ribociclibhez képest szignifikánsan nagyobb gyakoriságú hasmenéssel járt; az esetek többnyire az első ciklusban fordultak elő, és hasmenés elleni kezeléssel kezelhetőek voltak.22-25 Az abemaciclib szérum kreatinin emelkedéssel és vénás tromboembóliás eseményekkel (többnyire enyhe) társult, amelyekről a palbociclib és a ribociclib esetében nem számoltak be, valamint a hasi fájdalom nagyobb gyakoriságával.22-25 Figyelemre méltó, hogy 2019 szeptemberében az FDA figyelmeztetett, hogy a CDK4/6 gátlókkal kezelt betegeknél ritka, de súlyos, életveszélyes vagy halálos intersticiális tüdőbetegség (ILD) és pneumonitis fordulhat elő.26 Ezért a betegeket rendszeresen ellenőrizni kell az ILD-re és/vagy tüdőgyulladásra utaló tüdőtünetek szempontjából.
Következtetés
A palbociclib, a ribociclib és az abemaciclib utóbbi években történt engedélyeztetése kibővítette az előrehaladott emlőrákban szenvedő betegek kezelési lehetőségeit. Bár mindegyikük azonos hatásmechanizmussal rendelkezik, ezek a gyógyszerek hatásosságukban és biztonságosságukban kis mértékben különböznek egymástól. Az ebben az áttekintésben említetteken túl számos folyamatban lévő vizsgálat folytatja ezeknek a gátlóknak a vizsgálatát különböző betegpopulációkban és különböző kezelési kombinációkkal. Ígéretesnek tűnik, hogy ezek a szerek a CDK4/6-gátlók alkalmazását a HR+, HER2- előrehaladott emlőrákon kívüli egyéb állapotokra is kiterjeszthetik.27
1. Siegel RL, Miller KD, Jemal A. Rákstatisztika, 2020. CA Cancer J Clin. 2020;70(1):7-30.
2. Preusser M, De Mattos-Arruda L, Thill M, et al. CDK4/6 inhibitorok az emlőrákos betegek kezelésében: egy multidiszciplináris kerekasztal-beszélgetés összefoglalója. ESMO Open. 2018;3(5):e000368.
3. Tripathy D, Bardia A, Sellers WR. Ribociclib (LEE011): e szelektív ciklinfüggő kináz 4/6 inhibitor hatásmechanizmusa és klinikai hatása különböző szolid tumorokban. Clin Cancer Res. 2017;23(13):3251-3262.
4. Portman N, Alexandrou S, Carson E, et al. Overcoming CDK4/6 inhibitor resistance in ER-positive breast cancer. Endocr Relat Cancer. 2019;26(1):R15-R30.
5. Sobhani N, D’Angelo A, Pittacolo M, et al. Aktualitások a CDK4/6 gátló stratégiáról és kombinációkról emlőrákban. Cells. 2019;8(4):E321.
6. Ibrance (palbociclib) betegtájékoztató. New York, NY: Pfizer Inc; September 2019.
7. Kisqali (ribociclib) betegtájékoztató. East Hanover, NJ: Novartis Pharmaceuticals Corp; 2019. szeptember.
8. Verzenio (abemaciclib) betegtájékoztató. Indianapolis, IN: Eli Lilly and Co; 2019. szeptember.
9. Finn RS, Crown JP, Lang I, et al. The cyclin-dependent kinase 4/6 inhibitor palbociclib in combination with letrozole versus letrozole alone as first-line treatment of oestrogen receptor-positive, HER2-negative, advanced breast cancer (PALOMA-1/TRIO-18): a randomized phase 2 study. Lancet Oncol. 2015;16(1):25-35.
10. Finn RS, Martin M, Rugo HS, et al. Palbociclib és letrozol előrehaladott emlőrákban. N Engl J Med. 2016;375(20):1925-1936.
11. Rugo HS, Finn RS, Diéras V, et al. Palbociclib plusz letrozol első vonalbeli terápiaként ösztrogénreceptor-pozitív/humán epidermális növekedési faktor receptor 2-negatív előrehaladott emlőrákban, kiterjesztett követéssel. Breast Cancer Res Treat. 2019;174(3):719-729.
12. Turner NC, Ro J, André F, et al. Palbociclib hormonreceptor-pozitív előrehaladott emlőrákban. N Engl J Med. 2015;373(3):209-219.
13. Cristofanilli M, Turner NC, Bondarenko I, et al. Fulvestrant plus palbociclib versus fulvestrant plus placebo a hormonreceptor-pozitív, HER2-negatív metasztatikus emlőrák kezelésére, amely korábbi endokrin terápia hatására progresszióba került (PALOMA-3): a multicentrikus, kettős vak, 3. fázisú randomizált, kontrollált vizsgálat végső elemzése. Lancet Oncol. 2016;17(4):425-439.
14. Turner NC, Slamon DJ, Ro J, et al. Teljes túlélés palbociclib és fulvestrant alkalmazásával előrehaladott emlőrákban. N Engl J Med. 2018;379(20):1926-1936.
15. Hortobagyi GN, Stemmer SM, Burris HA, et al. Ribociclib mint a HR-pozitív, előrehaladott emlőrák első vonalbeli terápiája. N Engl J Med. 2016;375(18):1738-1748.
16. Hortobagyi GN, Stemmer SM, Burris HA, et al. Updated results from MONALEESA-2, a phase III trial of first-line ribociclib plus letrozole versus placebo plus letrozole in hormone receptor-positive, HER2-negative advanced breast cancer. Ann Oncol. 2018;29(7):1541-1547.
17. Slamon DJ, Neven P, Chia S, et al. Ribociclib és fulvestrant III. fázisú randomizált vizsgálata hormonreceptor-pozitív, humán epidermális növekedési faktor receptor 2-negatív előrehaladott emlőrákban: MONALEESA-3. J Clin Oncol. 2018;36(24):2465-2472.
18. Slamon DJ, Neven P, Chia S, et al. Overall survival with ribociclib plus fulvestrant in advanced breast cancer. N Engl J Med. 2020;382(6):514-524.
19. Tripathy D, Im SA, Colleoni M, et al. Ribociclib plusz endokrin terápia hormonreceptor-pozitív, előrehaladott emlőrákban szenvedő premenopauzális nőknél (MONALEESA-7): randomizált, 3. fázisú vizsgálat. Lancet Oncol. 2018;19(7):904-915.
20. Im SA, Lu YS, Bardia A, et al. Overall survival with ribociclib plus endocrine therapy in breast cancer. N Engl J Med. 2019;381(4):307-316.
21. Dickler MN, Tolaney SM, Rugo HS, et al. MONARCH 1, az abemaciclib, egy CDK4- és CDK6-gátló, mint egyetlen szer II. fázisú vizsgálata refrakter HR+/HER2- metasztatikus emlőrákban szenvedő betegeknél. Clin Cancer Res. 2017;23(17):5218-5224.
22. Sledge GW Jr, Toi M, Neven P, et al. MONARCH 2: abemaciclib és fulvestrant kombinációban HR+/HER2- előrehaladott emlőrákban szenvedő nőknél, akik endokrin terápia mellett előrehaladott állapotba kerültek. J Clin Oncol. 2017;35(25):2875-2884.
23. Sledge GW Jr, Toi M, Neven P, et al. The effect of abemaciclib plus fulvestrant on overall survival in hormone receptor positive, ERBB2-negative breast cancer that progressed on on endocrine therapy-MONARCH 2: a randomized clinical trial. JAMA Oncol. 2020;6(1):116-124.
24. Goetz MP, Toi M, Campone M, et al. MONARCH 3: abemaciclib mint előrehaladott emlőrák kezdeti terápiája. J Clin Oncol. 2017;35(32):3638-3646.
25. Johnston S, Martin M, Di Leo A, et al. MONARCH 3 végleges PFS: az abemaciclib mint előrehaladott emlőrák kezdeti terápiája randomizált vizsgálata. NPJ Breast Cancer. 2019;17(5):5.
26. FDA. Az FDA ritka, de súlyos tüdőgyulladásra figyelmeztet az emlőrák kezelésére szolgáló Ibrance, Kisqali és Verzenio esetében. www.fda.gov/drugs/drug-safety-and-availability/fda-warns-about-rare-severe-lung-inflammation-ibrance-kisqali-and-verzenio-breast-cancer. Hozzáférés 2020. január 15.
27. Shah M, Nunes MR, Stearns V. CDK4/6 gátlók: játékváltók a hormonreceptor-pozitív előrehaladott emlőrák kezelésében? Oncology (Williston Park). 2018;32(5):216-222.
A cikk tartalma kizárólag tájékoztató jellegű. A tartalom nem helyettesíti a szakmai tanácsadást. A cikkben szereplő bármely információra való hagyatkozás kizárólag az Ön saját felelősségére történik.
