Bevezetés
A krónikus obstruktív tüdőbetegség (COPD) a modern világban a halálozás és a morbiditás jelentős oka. A betegség halálozási aránya növekszik, és az előrejelzések szerint 2020-ra világszerte a harmadik vezető halálozási ok lesz.1 A COPD-t nem lehet kizárólag az 1-es erőltetett kilégzési térfogat (FEV1) alapján meghatározni, ezért a krónikus obstruktív tüdőbetegségek globális kezdeményezése (GOLD) többdimenziós definíciót dolgozott ki a COPD értékelésére.2 Az új definíció a FEV1-érték mellett a tünetek gyakoriságát és az exacerbációk előzményeit is figyelembe veszi, és a társbetegségek értékelését is hangsúlyozza. A tünetek felmérésére a módosított Medical Research Council (mMRC) vagy a COPD Assessment Test (CAT) ajánlott. Emellett egy betegségspecifikus életminőség-skálát (SGRQ, SF-36, CCQ) használtak a betegség mindennapi életre gyakorolt hatásának értékelésére. Egyes tanulmányok szoros kapcsolatot mutattak ki a CAT és a Szent György Légzési Kérdőív (SGRQ) között.3,4 Ladeira és munkatársai5 kimutatták, hogy a CAT korrelált a BODE indexszel.
A COPD komplex betegség, amely genetikai, sejtes és molekuláris komponenseket tartalmaz. A gyulladásos útvonalakban számos különböző sejt és molekula vesz részt. Számos mutatót használtak a betegséggel kapcsolatos esetleges szisztémás gyulladás kimutatására.6-9 A légúti és tüdőparenchimális gyulladás a COPD egyik fő patogén mechanizmusa. Emellett a tartós szisztémás gyulladás különböző extrapulmonális társbetegségekkel és pulmonális hatásokkal járhat.10 A legújabb kutatások bizonyították a különálló “újszerű szisztémás gyulladásos COPD fenotípus” létezését. 7 Egy nemrégiben végzett vizsgálatban kimutatták, hogy a kardiovaszkuláris társbetegség és a cukorbetegség a szisztémás gyulladás egyes markereinek magasabb szintjével társult.11 Ezért a genetikai terhelés, a szisztémás gyulladás és a társbetegségek a COPD különböző fenotípusaihoz társulnak. Elengedhetetlen, hogy új perspektívákat dolgozzunk ki e betegség kezelésében.
A CAT-ot jelenleg egyre gyakrabban használják a COPD értékelésére és monitorozására. Bár számos szérum biomarkert határoztak meg a COPD-ben, nincs egyetlen elégséges és hatékony egyetlen biomarker, amely a COPD-s betegek állapotának értékelésére használható. Kimutatták, hogy a biomarkerek számos paraméterrel, például a gyulladással, a kórházi kezeléssel és a halálozással állnak kapcsolatban.7-13 A CAT és a biomarkerek közötti kapcsolatot azonban nem bizonyították egyértelműen. Ezért a jelen tanulmány célja a szisztémás gyulladás szintjének vizsgálata COPD-ben, valamint a CAT és a gyulladásmarkerek, valamint az életminőség közötti kapcsolat meghatározása.
Anyagok és módszerekTanulmánytervezés
Ez egy keresztmetszeti, egylátogatásos megfigyeléses vizsgálat volt. Száztíz, a GOLD-kritériumok14 szerint diagnosztizált COPD-s beteget és hatvanöt kontrollszemélyt toboroztak 2013 februárja és 2013 augusztusa között. A kontrollszemélyeket a Balikesir Egyetemi Kórház pulmonológiai és belgyógyászati klinikájára beutalt, rutinvizsgálatokon átesett betegek közül választottuk ki. Minden résztvevőtől írásbeli beleegyező nyilatkozatot kaptunk, és a vizsgálatot a Balikesir Egyetem Orvosi Karának Intézményi Etikai Bizottsága jóváhagyta.
Minden betegnél fizikális vizsgálatot, mellkasröntgent, légzésfunkciós vizsgálatot és rutin vérvizsgálatot végeztek. Feljegyezték az előző évi súlyosbodások számát és a dohányzási kórtörténetet. A CAT, mMRC dyspnoe-pontszámot tüdőgyógyász által végzett személyes interjúk útján végezték. Az SGRQ-pontszámokat a betegek jelentették. Az egészséges kontrollcsoport esetében csak légzésfunkciós vizsgálatot és rutin vérvizsgálatot végeztek.
A vizsgálat populációja
Bevonási kritériumok: A betegek akkor kerültek bevonásra, ha: (1) 40 évnél idősebbek voltak; (2) jelenlegi vagy volt dohányosok voltak, ≥10 csomagévnyi dohányzási előzménnyel; (3) a bronchodilatátor utáni FEV1
80%-ot és FEV1/FVC0,7-et mutattak. A kontrollszemélyeket akkor vonták be a vizsgálatba, ha: (1) 40 évnél idősebbek voltak; (2) orvos által meghatározott tüdőbetegségtől mentesek voltak; (3) normális spirometriával rendelkeztek (FEV1>85% és FEV1/FVC>0,7); és (4) dohányzási anamnézisük
kizárási kritériumok: (1) a COPD súlyosbodása volt az előző 6 héten belül; (2) a COPD-től vagy rosszindulatú daganatos betegségtől eltérő légzőszervi betegségben szenvedett; (3) krónikus gyulladásos betegségben szenvedett (vasculitis, gyulladásos bélbetegség, rheumatoid arthritis stb.) (4) kontrollálatlan vagy súlyos kísérőbetegsége volt (MI, szívritmuszavar stb.).
Mérések
A demográfiai jellemzőket, életkort, nemet, dohányzási szokásokat, a sürgősségi osztályra való beutalást vagy kórházi kezelést az elmúlt egy évben, a kísérőbetegségeket és a meglévő kezeléseket megfelelően rögzítették. A súlyosbodást a tünetek olyan súlyosbodásaként definiáltuk, amely orális kortikoszteroidokat és/vagy antibiotikumokat és/vagy kórházi kezelést igényelt. A kísérőbetegségeket a klinikai anamnézis és a fizikális vizsgálat leletei alapján állapítottuk meg a látogatás során, és a rendelkezésre álló kórlapok áttekintésével támasztottuk alá. Dokumentálták az aktuális gyógyszereket, beleértve az inhalátorokat, vérnyomáscsökkentőket és egyéb gyógyszereket. Megmérték a magasságot, a testsúlyt és a BMI-indexet, valamint spirometriát is végeztek a nemzetközi irányelveknek (ATS/ERS) megfelelően.15 A betegséget a GOLD stádiumbeosztás régi és új változata szerint osztályozták.14 Először a GOLD spirometriai stádiumbeosztás (FEV1 alapú (1-4) stádiumbeosztás), majd a GOLD stádiumbeosztás (A-D osztály). A dyspnoét az mMRC dyspnoe-skálával értékelték.16 A COPD-s betegeket az mMRC dyspnoe-skála és az exacerbációs kockázat alapján végzett tüneti értékelést kombinálva A, B, C és D kategóriába sorolták.
CAT: E skála török változatának érvényességét és megbízhatóságát már korábban igazolták.17 A CAT 8 elemet tartalmaz, és 0 és 40 közötti összpontszámot ad; a magasabb pontszámok súlyosabb egészségi állapotromlást vagy a COPD kevésbé sikeres kontrollját jelzik.3
Az életminőségi kérdőív: Az életminőséget a Szent György Légzőszervi Betegségek Kérdőív (SGRQ) török fordításával vizsgáltuk.18
Biomarkerek
A biomarkereket korábbi tanulmányok alapján választottuk ki.7,9-13 Az összes alanyból vett vérmintákat centrifugáltuk és -80°C-on tároltuk. A vizsgálat befejezésekor minden mintát elemeztünk. A szérumot diagnosztikai eszközzel (BioTek, ELx 800, USA) vizsgáltuk, kereskedelmi készletek (eBioscience, Human TNF-α és Human IL-6 Platinum ELISA, Ausztria) felhasználásával, valamint a tumor nekrózis alfa (TNF-α) és az interleukin-6 (IL-6) szintjének enzimhez kötött immunszorbiens teszt (ELISA) módszerével. A C-reaktív fehérje (CRP) szintjét klinikai kémiai analizátorral (Cobes Integra 800, Roche diagnosztika) vizsgáltuk egy kereskedelmi készlet segítségével. A CRP referenciaértéke 0-0,5 mg/l, míg az IL-6 elemzett legalacsonyabb értéke 0,92pg/ml. A TNFα elemzett legalacsonyabb értéke 2,3pg/ml. Néhány minta TNF-α és IL-6 koncentrációja a számszerűsítés alsó határa (LLQ) alatt volt. Az LLQ alatti értékeket mutató egyének elemzése során a populációs adatok lefelé torzításának elkerülése érdekében az LLQ-érték felének megfelelő nominális szintet használtunk.19
Statisztikai elemzés
A COPD- és kontrollcsoportok átlagos CRP-értékeit (3,2 (1,5,7,1), 1,3 (0,6,2,7)) hasonló vizsgálatokból határoztuk meg.7 Ezt követően minden csoportban 80%-os pontossággal és 5%-os hibával átlagszámítási képlet segítségével számoltuk ki a mintaszámot. Ennek megfelelően a mintaméretnek minden csoportban legalább 55 alanynak kellett lennie. Az eredményeket átlag ± SD, medián vagy százalékos arányban mutattuk be. A parametrikus tesztekhez a Student’s t-tesztet és az ANOVA-t használtuk; a Mann-Whitney U-tesztet, a Kruskal-Wallis és a chi-négyzet statisztikát használtuk a nem parametrikus tesztekhez a csoportösszehasonlításokhoz. A Fisher-féle egzakt teszt értékelte a társbetegségek százalékos aránya közötti különbségeket és a nemek közötti különbségeket. A chi-négyzet teszt a társbetegségek százalékos aránya közötti különbségeket értékelte. A COPD-s betegek folyamatos változóinak páronkénti korrelációját Pearson-korrelációval vizsgálták. A p
0,05 értéket statisztikailag szignifikánsnak tekintették. Minden statisztikai elemzést az SPSS (20.0 verziójú) szoftverrel végeztünk.EredményekA vizsgálati személyek klinikai jellemzése
A vizsgálatba 110 beteg (átlagéletkor 64±8,9 év; 100 férfi (90,9%)) és 65 kontrollszemély (átlagéletkor 61,5±9,2 év, 55 férfi (84,6%)) került bevonásra. A beteg- és kontrollcsoportok demográfiai és klinikai jellemzőit az 1. táblázat tartalmazza. Negyvenöt (40,9%) COPD-s betegnek volt valamilyen kísérőbetegsége (iszkémiás szívbetegség (n=21), magas vérnyomás (n=13), cukorbetegség (n=8), egyéb (n=3)). Az átlagos FEV1 az előre jelzett érték 48,8%-a, az átlagos FEV1/FVC: 55,4% volt a COPD-s csoportban. Az átlagos CAT pontszám 22,6 (±9,2), az mMRC: 1,9 (±0,9) és a teljes SGRQ: 58,4 (±22,2) volt. A 110 beteg 9,1%-a 1-es, 37,3%-a 2-es, 42,7%-a 3-as, 10,9%-a 4-es stádiumú volt a GOLD-féle spirometriai stádiumbeosztás szerint. Amikor a betegeket a GOLD stádiumbeosztás szerint osztályozták, 27,3% az A csoportba, 30,9% a B csoportba, 7,3% a C csoportba és 34,5% a D csoportba tartozott.
A beteg- és kontrollcsoport demográfiai, funkcionális, klinikai jellemzői.
| Beteg (n=110) | Kontroll (n=65) | p-érték | ||
|---|---|---|---|---|
| Kor | 64.0±8.9 | 61.5±9.2 | 0.080 | |
| Férfi n, (%) | 100 (90.9) | 55 (84.6) | 0.224 | |
| BMI, kg/m2 | 26.5±5.6 | 25±2.6 | 0.064 | |
| Pack-évek | 38,9±23 | 0,1±1,2 | ||
| Co-betegségek, n (%) | ||||
| Bármilyen | 65 (59.1) | 42 (64,6) | 0,95 | |
| Ischaemiás szívbetegség | 21(19,1) | 11 (16,9) | ||
| HT | 13 (11.8) | 6 (9.2) | ||
| DM | 8 (7.3) | 4 (6.2) | ||
| Egyéb | 3 (2.7) | 2 (3.1) | ||
| mMRC | 1.94±0.9 | 0.04±0.2 | ||
| FEV1, % előrejelzett | 48.8±17.8 | 89.4±5.6 | ||
| FVC, % előre jelzett | 68.7±17.8 | 92.1±5.8 | ||
| FEV1/FVC, % | 55.4±12,9 | 89,6±4,7 | ||
| GOLD spirometriai szakasz, n (%) | ||||
| 1 | 10 (9.1) | |||
| 2 | 41 (37.3) | |||
| 3 | 47 (42.7) | |||
| 4 | 12 (10.9) | |||
| GOLD stádium, n (%) | ||||
| A | 30 (27.3) | |||
| B | 34 (30.9) | |||
| C | 8 (7.3) | |||
| D | 38 (34.5) | |||
| SGRQ-total score | 58.4±22.2 | |||
| CAT score | 22.6±9.2 | |||
| TNFα (pg/ml) | 109.5±58 | 14.6±18 | ||
| IL-6 (pg/ml) | 10.3±18 | 2,14±1,9 | ||
| CRP (mg/L) | 1,6±1,7 | 0,4±0,3 | ||
Abröv: BMI: testtömegindex, HT: magas vérnyomás, DM: cukorbetegség, FEV1: 1 másodperc alatt kényszerített kilégzési térfogat, FVC: kényszerített vitálkapacitás, CAT: COPD értékelő teszt.
COPD és kontroll összehasonlítás
A két csoport életkora (p=0,080, Student’s t-teszt) és neme (p=0,453, fisher’s exact teszt) között nem volt szignifikáns különbség (1. táblázat). A csoportokban hasonló volt a társbetegségek előfordulása (p=0,095, χ2-teszt). A várakozásoknak megfelelően a COPD-s betegek tüdőfunkciós paraméterei (FEV1, FVC, FEV1/FVC) szignifikánsan alacsonyabbak voltak a kontrollokhoz képest (p
0,001, Student’s t-teszt). Általánosságban elmondható, hogy a COPD-s betegek magasabb CRP (1,6±1,7mg/L) és TNF-α (109,5±58pg/ml), valamint IL-6 (10,3±18pg/ml) szérumszintet mutattak, mint az egészséges kontrollok (CRP: 0,4±0,3mg/L, p0,001; TNF-α: 14,6±18pg/ml, p0,001; IL-6: 2,14±1,9pg/ml, p0,001, Student’s t-test) (1. táblázat) A CAT-kérdőívek és a betegek jellemzőinek összefüggése
A CAT-pontszám és a GOLD-spirometriás stádium között összefüggés volt (Pearson r=0,43; p
0,001). A CAT-pontszám a betegség súlyosságával párhuzamosan emelkedett. Statisztikailag szignifikáns kapcsolat volt a CAT-pontszám és az előző évi súlyosbodások száma (Pearson r=0,35, p0,001), a betegség időtartama (Pearson r=0,29, p0,001), a dohányzás (csomag-év) (Pearson r=0,27, p=0,014) és az mMRC (Pearson r=0,59, p0,001) között. A CAT-pontszám szignifikáns korrelációt mutatott a FEV1 (Pearson r=-0,39, p0,001) és az FVC (Pearson r=-42, p=0,003) értékekkel. Ugyanakkor erős korrelációt figyeltek meg a CAT-pontszám és az SGRQ tüneti, aktivitási, hatás- és összpontszámok között (Pearson r=0,72; p0,001).A biomarkerek és a betegek jellemzői közötti összefüggés
A gyulladásos markerek és a tüdőfunkciós paraméterek összehasonlítása. A FEV1 csökkenésével a biomarkerek szintje szignifikánsan emelkedett. A CRP-szintek korreláltak a FEV1 (Pearson r=-0,39, p
0,001), az FVC (Pearson r=-0,33, p0,001) és a FEV1/FVC (Pearson r=-0,38, p0,001) értékekkel. A TNF-α szintek szintén korreláltak a FEV1 (Pearson r=-0,57, p0,001), FVC (Pearson r=-0,37, p0,001) és FEV1/FVC (Pearson r=-0,66, p0,001) értékekkel. Az IL-6 szintek szintén korreláltak a FEV1 (Pearson r=-0,31, p0,001), FVC (Pearson r=-0,32, p0,001) és FEV1/FVC (Pearson r=-0,34, p0,001) értékekkel. Szignifikáns korrelációt figyeltek meg a CRP, a TNF-α, az IL-6 és a dohányzás (csomagév) között (Pearson r=0,35, r=0,44, r=0,27, p0,001). A szív- és érrendszeri betegségben szenvedő COPD-s betegek CRP-szintje emelkedett (2,98±2.4mg/L) a társbetegségek nélküli betegekhez képest (1,56±1,5mg/L, p=0,008 ANOVA teszt, majd LSD post hoc teszt). Nem volt szignifikáns összefüggés más biomarkerekkel és társbetegségekkel. Az IL-6 emelkedésével az mMRC-pontszám is nőtt, de ez a kapcsolat statisztikailag nem volt szignifikáns (p=0,06). Amikor a gyulladásos markereket összehasonlítottuk a CAT-pontszámmal, a CRP-szintek szignifikáns korrelációt mutattak (r=0,43, p0,001) (1. ábra), míg a TNF-α-val és az IL-6-tal nem volt összefüggés. A CRP-szint és a TNFα között összefüggés volt (r=0,48, p0,001). A biomarkerek és az A-D osztály vagy a spirometriai stádiumok között nem észleltek közvetlen összefüggést.
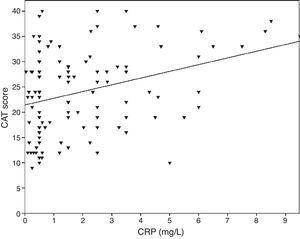
A CAT-pontszámok és a CRP közötti kapcsolat (r=0,43, p0,001).
Megbeszélés
A COPD értékelésére néhány értékelő eszközt használnak, például klinikai teszteket (CAT, BODE), gyulladásmarkereket és életminőségi kérdőíveket. Általánosan elfogadott, hogy a betegség megértéséhez és kezeléséhez többdimenziós értékelésre van szükség. A COPD összetett betegség, amelynek szisztémás összetevője van, és egyes betegek gyulladásos fenotípusúnak tűnnek. Ebben a tanulmányban a CAT-ot mint új klinikai tesztet végezték el, és vizsgálták a CAT és más COPD-komponensek kapcsolatát.
Egyik ilyen komponens a szisztémás gyulladás. A COPD-ben a szisztémás gyulladás jelzésére leggyakrabban vizsgált, általánosan használt biomarkerek a CRP, az IL-6, a TNF-α, az IL-8 és a fibrinogén. Korábban több tanulmány is beszámolt e markerek emelkedett keringési szintjéről stabil COPD-s betegeknél.6-9,20-23 Egy nemrégiben végzett vizsgálatban Agustí és munkatársai kimutatták, hogy a COPD-s betegek 30%-ánál nem volt szisztémás gyulladásra utaló jel, 16%-uknál pedig tartós szisztémás gyulladás volt tapasztalható.7 Érdekes módon ebben a vizsgálatban a TNF-α és az IL-8 szérumszintje magasabbnak bizonyult a normális spirometriájú dohányosoknál, mint a COPD-s betegeknél. A többi marker, mint a fehérvérsejtek, az IL-6, a CRP és a fibrinogén magasabbnak bizonyult a COPD-s betegeknél, mint a normális spirometriájú dohányosoknál és a nemdohányzóknál. Vizsgálatunkban a CRP, TNF-α, IL-6 szintje minden COPD-s betegnél szignifikánsan magasabb volt a kontrollcsoporthoz képest. Valamennyi biomarker összefüggést mutatott a kumulatív dohányzási expozícióval és a tüdőfunkciós tesztparaméterek (FEV1, FVC és FEV1/FVC) csökkenésével. A biomarkerek szintje a légáramlási obstrukció mértékével függ össze. Ezek az eredmények összhangban vannak a korábbi keresztmetszeti vizsgálatokban közölt eredményekkel.13 Egy másik vizsgálatban, amely az ECLIPSE eredményeit vizsgálta, a kardiovaszkuláris társbetegségek és a cukorbetegség korreláltak néhány szisztémás gyulladásmarkerrel.9 A mi vizsgálatunkban a kardiovaszkuláris betegségben szenvedő COPD-s betegek CRP-szintje emelkedett a társbetegségek nélküli betegekhez képest. A szív- és érrendszeri betegségekkel járó COPD-ben megnövekedett szisztémás gyulladás alátámasztja a COPD és e társbetegségek közötti patofiziológiai mechanizmust.
A CAT és a szisztémás gyulladás közötti kapcsolatot az eddigi vizsgálatok nem tisztázták. Egy vizsgálatban szignifikáns korrelációt mutattak ki az LCN1, LCN2 és a CAT között.8 A mi vizsgálatunkban szignifikáns kapcsolatot mutattak ki a CAT és a CRP között. A TNF-α-val és az IL-6-tal azonban nem sikerült hasonló összefüggést kimutatni.
A jelen vizsgálatban a COPD-s betegeket négy csoportba (A-D) és stádiumba (1-4) sorolták a GOLD-osztályozás régi és új változata szerint. Megfigyelhető, hogy az 1. és a 4. stádium a populáció legkisebb részét, egyenként 10%-ot tesz ki a régi osztályozás szerint. Az új változat szerint a populáció majdnem egyenlően oszlott meg az A, B és D csoportok között; a legkisebb megoszlás a C csoportot jellemezte. Más tanulmányokban is kimutatták, hogy a C csoport teszi ki a legkisebb arányt.24,25 Az új osztályozás azt jelzi, hogy lehetnek olyan betegek, akiknek több tünete van, de enyhe légúti elzáródásuk, valamint olyanok is, akiknek kevés tünetük van, de súlyos légúti elzáródásuk. A társbetegségek és a szisztémás gyulladás az enyhe/közepes obstrukcióval rendelkező betegeknél az exacerbáció és a tünetek fokozódásához vezethet, és így ezeket a betegeket a nagy kockázatú csoportokba (C vagy D osztály) sorolja. Egy tanulmányban kimutatták, hogy a C altípusba a magasabb komorbiditási státuszú betegek tartoznak, a D altípusba pedig a legsúlyosabb exacerbációval, a kórházi kezeléssel járó exacerbációk magas arányával és a legrosszabb kimenetellel rendelkező betegek26. Egy nemrégiben végzett vizsgálatban Agustí és munkatársai két csoportot hasonlítottak össze perzisztáló szisztémás gyulladással és anélkül, és kimutatták, hogy a követés során perzisztáló gyulladást mutató betegeknél a másik csoporthoz képest megnőtt az exacerbációk éves aránya, bár a pulmonális eltérések hasonlóak voltak a két csoportban.7
A GOLD a CAT vagy az mMRC skála használatát javasolja a tünetek értékelésére. Mi az mMRC-skálát használtuk a csoportbeosztáshoz, mert amikor a CAT alapján vizsgáltuk a tüneteket, a 10 töréspontnál kevesebbet mutató betegek száma nagyon kicsi volt (8 beteg). A magasabb CAT-pontszámok összefüggésbe hozhatók a betegek tüneteinek magasabb szintű észlelésével. Az is kiderült, hogy a CAT és az mMRC nem egyenértékű, és ez okozhat némi különbséget az osztályozásban.24,25,27 Az új osztályozásban a többi határpontot az éves exacerbációk száma alkotja. A COPD-s betegeknél kimutatták a kapcsolatot a bazális CAT-pontszám és az exacerbációk gyakorisága között.28 Pothirat és munkatársai kimutatták, hogy a CAT-pontszám változása a monitorozó vizitek során hasznos eszköz a COPD-s betegek egészségi állapotának akut romlásának kimutatására.29 Vizsgálatunkban szoros kapcsolatot figyeltek meg a CAT, az mMRC és az exacerbációk aránya között. A CAT összefüggést mutatott a betegség időtartamával és a dohányzással (csomagév) is. A betegek átlagos FEV1-értéke az előre jelzett érték 48,8%-a, a CAT-pontszám átlaga pedig 22,6 volt. A CAT és a FEV1, az FVC és a GOLD-spirometriás stádium között szoros összefüggés mutatkozott. Ahogy a FEV1 és az FVC csökkent, úgy nőtt a CAT-pontszám. A CAT-pontszám pozitívan korrelált a nehezebb GOLD-stádiummal is. Ezek az eredmények azt mutatják, hogy a CAT nagyon jól tükrözi a betegség súlyosságát.
A COPD kezelésének másik fontos összetevője az életminőség. A betegség mindennapi életre gyakorolt hatásának értékelésére különböző életviteli kérdőíveket használtak. Az SGRQ török változatának megbízhatóságát és érvényességét bizonyították.30 Néhány vizsgálat kimutatta, hogy a CAT és az SGRQ között szignifikáns korrelációt figyeltek meg.3,4 Egy vizsgálatban arról számoltak be, hogy a CAT érzékeny a COPD súlyosbodásával járó egészségi állapot változására.31 Vizsgálatunkban a CAT és az SGRQ között szoros kapcsolatot mutattak ki. Mivel a CAT az SGRQ-hoz képest rövidebb és könnyebben érthető teszt, a CAT használata praktikusabb.
A jelen vizsgálatnak számos korlátja van, mint például a keresztmetszeti tervezés, az egyközpontú vizsgálat és a kis mintanagyság. Ezenkívül a gyulladásmarkereket nem lehetett összehasonlítani olyan dohányosoknál, akiknek normális a tüdőfunkciójuk, mivel őket nem vonták be a jelen vizsgálatba. A betegek gyógyszerei hatással lehetnek a szisztémás gyulladásos válaszra és az egészségi állapotra, és ezek is befolyásolhatják az eredményeket.
Összefoglalva, a CAT egy olyan teszt, amely használható a COPD értékelésében, mivel megbízhatósága és érvényessége egyértelműen bizonyított. Vizsgálatunk eredményei a CAT és a CRP, valamint más COPD-komponensek (klinikai, funkcionális paraméterek) közötti kapcsolatra utalnak. A CAT és a biomarkerek közötti kapcsolat értékeléséhez azonban longitudinális multicentrikus vizsgálatokra van szükség.
Etikai közleményekAz emberi és állati alanyok védelme
A szerzők kijelentik, hogy e tanulmányhoz nem végeztek kísérleteket embereken vagy állatokon.
Az adatok titkossága
A szerzők kijelentik, hogy betartották a munkaügyi központjuk betegadatok közzétételére vonatkozó protokolljait, és hogy a vizsgálatba bevont valamennyi beteg elegendő tájékoztatást kapott, és írásos beleegyezését adta a vizsgálatban való részvételhez.
A magánélethez való jog és tájékozott beleegyezés
A szerzők beszerezték a cikkben említett betegek vagy alanyok írásos beleegyezését. Ez a dokumentum a levelező szerző birtokában van.
A szerzőség
Tanulmánytervezés: NS, FE és AAH; Adatgyűjtés: NS, CB; Adatelemzés és értelmezés: NS, AAH és CB; A kézirat kritikai felülvizsgálata: NS, FE, CB és AAH.
Érdekütközés
A szerzők kijelentik, hogy a kézirat elkészítése során nem áll fenn összeférhetetlenségük.
A kézirat elkészítése során nem áll fenn összeférhetetlenségük.
