


A VEGF-ellenes kezelés hatására a neovaszkuláris, korral összefüggő makuladegenerációban szenvedő betegek látásélessége és életminősége általában jelentősen javul. Bár a rövid távú eredmények látványosak, e betegek hosszú távú kezelésével kapcsolatban számos fontos kérdés továbbra is fennáll. Ezek a következők:
- Melyik a legjobb szer?
- Milyen gyakran kell kezelni?
- Ezeknek a szereknek a hosszú távú adagolása látásromlást és látáskárosodást okoz?
- Új platformok vannak a láthatáron e szerek hosszú távú adagolására?
- Ez a cikk ezekre a kérdésekre ad választ a kulcsfontosságú klinikai vizsgálatok eredményei alapján.
Minden anti-VEGF szer egyenlő? Milyen gyakran kell kezelni?
2006-ban a mérföldkőnek számító ANCHOR és MARINA vizsgálatok bizonyították a havi adagolású ranibizumab (Lucentis, Roche/Genentech) hatékonyságát és biztonságosságát. A betegek két év alatt 10,7, illetve 6,6 betűt nyertek.1-2 Ezt követően a párhuzamos VIEW1 és VIEW2 vizsgálatok két év alatt átlagos látásjavulást mutattak ki aflibercept (Eylea, Regeneron Pharmaceuticals) q8 hetente, három kezdeti havi betöltő dózis után.3
A későbbi vizsgálatok lehetővé tették, hogy értékeljük e gyógyszerek hatékonyságát ritkább adagolási intervallumok alkalmazásával, beleértve a negyedéves, pro re nata (PRN) és a treat-and-extend sémákat. A PIER vizsgálatban a ranibizumab negyedéves adagolását vizsgálták három havi betöltő dózis után, és bár a megfigyelésnél jobb eredményt értek el, a PIER betegek egy év múlva 2,3 betűt vesztettek a kiindulási értékhez képest.4
A legkorábbi kivételek egyike a PrONTO volt, egy I/II. fázisú vizsgálat, amely 40 beteget vizsgált két éven keresztül havi megfigyeléssel és PRN-újrakezeléssel a látásélesség, a klinikai vizsgálat és az optikai koherencia tomográfia paraméterei alapján.5 A látásélesség eredményei megközelítették az ANCHOR és a MARINA vizsgálat eredményeit közel feleannyi injekcióval, de a vizsgálatból hiányzott a havi kezelést ellenőrző kar. Ezeket az eredményeket a későbbi PRN vizsgálatokban nem sikerült megismételni.
A HARBOR vizsgálatban a ranibizumab havi és PRN adagolását hasonlították össze. A havi 0,5 mg-os csoport 9,1 betűt nyert 24 hónap alatt, míg a PRN csoport 7,9 betűt. Bár ez a különbség statisztikailag nem volt szignifikáns, az injekciók medián száma (de nem a vizitek száma) 21,4-ről 13,3-ra csökkent.6
A CATT és az IVAN hasonló vizsgálatok voltak, amelyek a ranibizumab és az off-label bevacizumab (Avastin, Roche/Genentech) havi és PRN adagolását hasonlították össze. Két év elteltével a PRN adagolás mindkét vizsgálatban nem bizonyult rosszabbnak a havi kezelésnél (kivéve a PRN bevacizumabot a CATT-ban), bár a havi adagolású csoportokban tendencia volt a jobb látás felé.7,8
TREX a havi ranibizumabot hasonlította össze a kezelést és meghosszabbítást (T&E) tartalmazó kezeléssel.9 A látásélességbeli különbség ismét nem volt statisztikailag szignifikáns (10,5 a havi csoportban és 8,7 a T&E csoportban), de tendencia volt a jobb látás felé a havi csoportban. Az injekciók átlagos száma 25,5 vs. 18,6 volt két év alatt. Emellett a havi kohorsz egyetlen betege sem veszített 2 betűnél többet, míg öt T&E beteg legalább 3 sornyi látást veszített.
Míg ezek a vizsgálatok rövid távon statisztikailag hasonló eredményeket mutattak a havi adagolással, az abszolút adatok alapján az eredmények szinte egyöntetűen jobbnak bizonyultak az anti-VEGF szerek havi adagolásával.
Mi történik két év után?
A két éven túli adatokat ezekből a klinikai vizsgálatokból nem olyan könnyű értelmezni és alkalmazni, mint a klinikai vizsgálati adatokat, elsősorban azért, mert ezek a kiterjesztő vizsgálatok elsősorban a hosszú távú gyógyszerbiztonságot értékelték. Tehát a követési és kezelési ütemtervek nem voltak olyan szigorúak.

A HORIZON a MARINA, ANCHOR és FOCUS vizsgálatokban részt vevő betegek kiterjesztő vizsgálata volt. Ezek a betegek nem követtek protokollt; a három-hathavonta végzett értékelő látogatások során a vizsgálók belátása szerint kapták a kezelést. Négy év elteltével a HORIZON-betegek lényegében elvesztették a kezdeti látásjavulást, és visszafejlődtek a kiindulási látásszintre (-0,1 betű).10 A további adatelemzés összefüggést talált a jobb látás és a több injekció között.
A CATT ötéves vizsgálatban a vizsgálat első két éve után a vizsgálók döntése szerint megfigyelt és kezelt betegeket értékelték. A betegek átlagosan 3 betűt veszítettek a kiindulási látáshoz képest. A betegeket évente átlagosan nyolcszor látták, és évente átlagosan öt kezelésben részesültek.11 Némi vita alakult ki arról, hogy a látásvesztés a nem megfelelő kezelés vagy a makula atrófia kialakulása miatt következett-e be, de a vizsgálat nem volt eléggé hatékony ahhoz, hogy ezt a különbséget kiderítse.12
A VIEW 1 kiterjesztő vizsgálatban a betegeket szigorúbban követték nyomon. A résztvevők fix intervallumú >q8 hetes adagolásban részesültek, de gyakrabban is kaphattak kezelést, ha megfeleltek az előre meghatározott kritériumoknak. Ebben a kiterjesztésben a betegek sokkal jobb látást őriztek meg, az átlagos látásjavulás 7,1 betű volt a kiindulási értékhez képest (szemben az egyéves elsődleges végpontnál tapasztalt 10,4 betűs látásjavulással).13
Mi történik hosszú távon, és számít-e az adagolás gyakorisága?

A legjobb hosszú távú adataink megfigyeléses vizsgálatokból származnak. A SEVEN-UP tanulmány a ranibizumab-kísérletek kiterjesztése volt. Bár nem volt előre meghatározott látogatási ütemterv vagy injekciós protokoll, az adatok némi információval szolgálnak. Hét év elteltével a betegek átlagosan 8,6 betűt vesztettek a kiindulási értékhez képest. Azok a betegek, akik a következő három évben nem kaptak injekciót, 8,7 betűt vesztettek a kiindulási értékhez képest; azok, akik egy-öt injekciót kaptak, 10,8 betűt vesztettek; azok, akik hat-tíz injekciót kaptak, 6,9 betűt vesztettek; és azok, akik több mint 11 injekciót kaptak, 3,9 betűt nyertek a kiindulási értékhez képest.14
A Fight Retinal Blindness Study Group Ausztráliából hét éven keresztül figyelte az anti-VEGF-fel kezelt betegeket. Ezek a betegek átlagosan 2,6 betűt vesztettek a kiindulási értékhez képest, miután évente átlagosan öt injekciót kaptak a második év után, amikor a kiindulási értékhez képest 4 betűt nyertek.15
A FIDO-vizsgálat végül egy egyközpontos megfigyeléses vizsgálat volt, amely az első két évben q4 hetes fix adagolást alkalmazott, majd >q8 hetet követően. Ezek a betegek 12,1 betűt nyertek a kiindulási értékhez képest (a két év alatt elért 16,1 betűs csúcsértékről), évente átlagosan 10,5 injekcióval.16
A hosszú távú megfigyeléses vizsgálatok központi üzenete az, hogy a több injekció átlagosan egyértelműen jobb látást eredményezett.

Már 10 éves adatokkal rendelkezünk
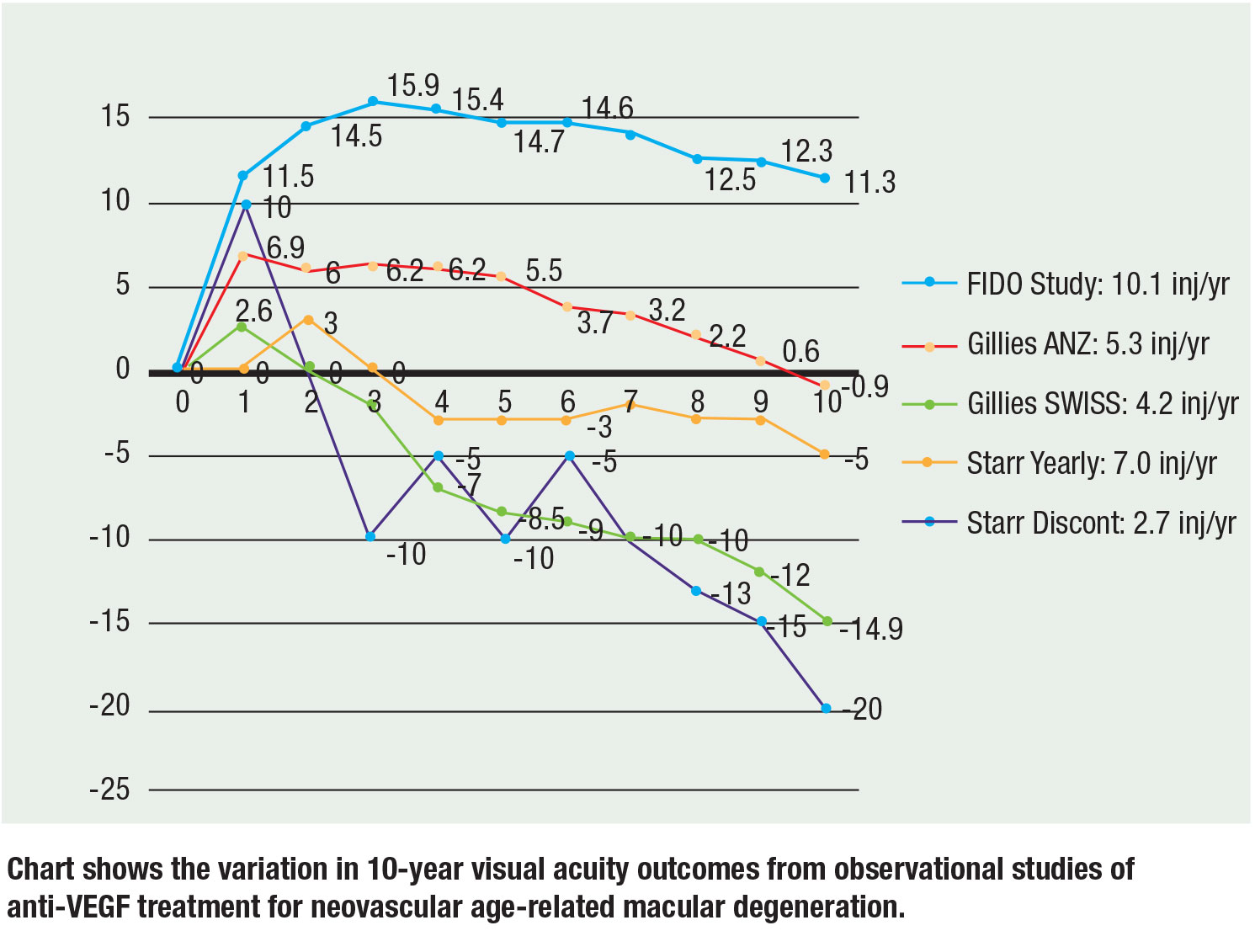
A közelmúltban három nagy megfigyeléses vizsgálat jelentett 10 éves adatokat, és az eredmények továbbra is következetesek: A több injekció jobb látásélességet eredményez. Dr. Mark Gillies és munkatársai megfigyelési adatokat közöltek Ausztráliából-Új-Zélandról és Svájcból. Az ANZ-beli betegeknél az átlagos látás 10 év múlva 0,9 betűvel csökkent a kiindulási értékhez képest, a T&E-kezeléssel kapott 5,3 injekció/év mediánjával, szemben a svájci betegekkel, akiknél a PRN-kezeléssel kapott 4,2 injekció/év mediánjával átlagosan 14,9 betűvel csökkent a látás. Következtetésük az volt, hogy a folyamatos kezelés és a több injekció jobb látást eredményezett.17
Matthew Starr, MD és munkatársai egy olyan kohorszot értékeltek, amely olyan betegeket tartalmazott, akik legalább két injekciót kaptak. A betegek átlagosan évente öt-hét injekciót kaptak. Az évente legalább egy injekciót kapó szemek körülbelül 7 betűt vesztettek a kiindulási értékhez képest, míg azok a szemek, amelyek nem kaptak évente legalább egy injekciót, 15 betűt vesztettek a kiindulási értékhez képest.18
A mi 10 éves FIDO-kohorszunk átlagosan 11,3 betű látásnövekedést ért el a 15,9-es csúcsértékről, a vizsgálati időszak alatt évente átlagosan 10,1 injekcióval.19
Nem szabad elfelejteni, hogy az eltérő kezdeti látásélesség és a betegpopulációk miatt a keresztvizsgálatok összehasonlításában rejlő kockázatok vannak, de a meredekségek és a tendenciák fenntartják a több injekció és a jobb látás összefüggését. Az ábra (29. oldal) a három vizsgálat 10 éves adatait foglalja össze.
A gyakori kezelés geografikus atrófiához vezethet?
A VEGF-ellenes kezelés mellett a geografikus atrófia progressziója aggodalomra ad okot, és gyakran felhozott érv a gyakori kezelés mellőzése mellett. Bizonyos bizonyítékok arra utalnak, hogy az alulkezelésből eredő látásvesztés kockázata messze felülmúlja ezt a potenciális aggodalmat. A SEVEN-UP vizsgálat a GA nagyobb előfordulását mutatta ki a társ szemekben, mint az anti-VEGF-fel kezelt szemekben14.
A FIDO 10 éves adatai továbbá azt mutatták, hogy a látásvesztéssel járó GA előfordulása 10 év múlva valamivel alacsonyabb volt a kezelt szemekben, mint a kezeletlen társszemekben (15 vs. 19 százalék).19 Valószínű, hogy a valódi GA progressziója független
az anti-VEGF kezeléstől, és ami megfigyelhető, az a neovaszkuláris komplexum kiszáradása, amely úgy néz ki, mint a GA, de kevésbé káros hatással van a látásra.
Legfontosabb
A folyamatos, rendszeres anti-VEGF szerekkel történő kezelés kiváló eredményeket biztosít a nedves AMD kezelésében. A hosszú távú adatok azt mutatják, hogy a látásvesztés kockázata nagyobb az alulkezelésből, mint a folyamatos, rendszeres időközönkénti kezelésből, ahogyan azt jelenleg a fix intervallumú adagolás vagy a konzervatív “treat-and-extend” sémák esetében alkalmazzák. Az olyan hosszú távú adagolási platformok, mint a portos adagolási rendszer és a génterápia ígéretesnek tűnnek, mivel csökkentik a be nem tartás akadályait, a gyakori látogatások terhét és a változó egyéni adagolási követelményekből adódó kihívásokat. RS
1. Brown DM, Kaiser PK, Michels M, et al. Ranibizumab versus verteporfin for neovascular age-related macular degeneration. N Engl J Med. 2006;355:1432-1444.
2. Rosenfeld PJ, Brown DM, Heier JS, et al. MARINA Study Group, Ranibizumab for neovascular age-related macular degeneration. N Engl J Med. 2006;355:1419-1431.
3. Schmidt-Erfurth U, Kaiser PK, Korobelnik JF, et al. Intravitreális aflibercept injekció neovaszkuláris, korral járó makuladegeneráció kezelésére: a VIEW vizsgálatok kilencvenhat hetes eredményei. Ophthalmology. 2014;121:193-201.
4. Regillo CD, Brown DM, Abraham P, et al. Randomized, double-masked, sham-controlled trial of ranibizumab for neovascular age-related macular degeneration: PIER tanulmány 1. éve. Am J Ophthalmol. 2008;145:239-248.
5. Lalwani GA, Rosenfeld PJ, Fung AE, et al. A variable-dosing regimen with intravitreal ranibizumab for neovascular age-related macular degeneration: year 2 of the PrONTO Study. Am J Ophthalmol. 2009;148:43-58.
6. Ho AC, Busbee BG, Regillo CD, et al, for the HARBOR Study Group. A 0,5 vagy 2,0 mg ranibizumab huszonnégy hónapos hatékonysága és biztonságossága subfovealis neovaszkuláris, korral járó makuladegenerációban szenvedő betegeknél. Ophthalmology. 2014;121:2181-2192.
7. Martin DF, Maguire MG, Fine SL, et al, for the Comparison of Age-related Macular Degeneration Treatments Trials (CATT) Research Group. Ranibizumab és bevacizumab a neovaszkuláris, korral járó makuladegeneráció kezelésére: kétéves eredmények. Ophthalmology. 2012;119:1388-1398.
8. Chakravarthy U, Harding SP, Rogers CA, et al. Alternative treatments to inhibit VEGF in age-related choroidal neovascularization: 2-year findings of the IVAN randomized control trial. Lancet. 2013;382:1258-1267.
9. Wykoff CC, Ou WC, Brown DM, et al. Randomized trial of treat-and-extend versus monthly dosing for neovascular age-related macular degeneration: 2-year results of the TREX-AMD study. Ophthalmol Retina. 2017;1:314-321.
10. Singer MA, Awh CC, Sadda S, et al. HORIZON: An open-label extension trial of ranibizumab for choroidal neovascularization secondary to age-related macular degeneration. Ophthalmology. 2012;119:1175-1183.
11. Maguire MG, Martin DF, Ying GS, et al. Ötéves eredmények a neovaszkuláris, korral járó makuladegeneráció neovaszkuláris endothelialis növekedési faktor elleni kezelésével: Az időskori makuladegenerációval kapcsolatos kezelési vizsgálatok összehasonlítása. Ophthalmology. 2016;123:1751-1761.
12. Grunwald JE, Pistilli M, Ying GS, et al. A földrajzi atrófia növekedése az életkorral összefüggő makuladegenerációs kezelések összehasonlítása vizsgálatokban. Ophthalmology. 2015;122:809-816.
13. Kaiser PK, Singer M, Tolentino M, et al. Az intravitreális aflibercept hosszú távú biztonságossága és vizuális eredménye neovaszkuláris, korral járó makuladegenerációban. Ophthalmol Retina. 2017;1:304-313.
14. Rofagha S, Bhisitkul RB, Boyer DS, Sadda SR, Zhang K, a SEVEN-UP tanulmánycsoport nevében. et al. Seven-year outcomes in ranibizumab-treated patients in ANCHOR, MARINA, and HORIZON: A multicenter cohort study (SEVEN-UP). Ophthalmology. 2013;120:2292-2299.
15. Gillies MC, Campain A, Barthelmes D, et al, for the Fight Retinal Blindness Study Group. A neovaszkuláris időskori makuladegeneráció kezelésének hosszú távú eredményei: Data from an observational study. Ophthalmology. 2015;122:1837-1845.
16. Peden MC, Suñer IJ, Hammer ME, Grizzard WS. A vaszkuláris endothelialis növekedési faktor elleni szerek fix intervallumú adagolásában részesülő szemek hosszú távú kimenetele nedves időskori makuladegeneráció esetén. Ophthalmology. 2015;122:803-808.
17. Gillies M, Arnold J, Bhandari S, et al. Tízéves kimenetelű neovaszkuláris időskori makuladegeneráció két régióból. Am J Ophthalmol. 2020;210:116-124.
18. Starr MR, Kung FF, Bui YT, et al. Tízéves követés az intravitreális anti-vaszkuláris endothelialis növekedési faktor injekcióval kezelt exudatív, korral járó makuladegenerációban szenvedő betegeknél. Retina. Online közzététel: 2019. november 13.
19. Suñer IJ, Peden MC, Hammer ME, Grizzard WS. Tízéves kimenetel az anti-vascularis endothelialis növekedési faktor elleni szerek fix intervallumú adagolásában részesülő szemekben nedves időskori makuladegeneráció esetén. Paper presented at Retina Society 2019; September 12, 2019; London, U.K.
20. Campochiaro PA, Marcus DM, Awh CC, et al. A port adagoló rendszer ranibizumabbal neovaszkuláris, korral járó makuladegenerációban: a randomizált 2. fázisú LADDER klinikai vizsgálat eredményei. Ophthalmology. 2019;126:1141-1154.
21. Ho AC; a Janssen/ORBIT tanulmányozócsoport. Precíziós szállítási programok sejt- és génterápiához. Paper presented at: Vail Vitrectomy Meeting; 2019. február 10.; Vail, CO.
22. ADVM-022 génterápia nedves AMD kezelésére (OPTIC). Szponzor: Adverum Biotechnologies. ClinicalTrials.gov azonosító: NCT03748784. Elérhető a következő címen: https://clinicaltrials.gov/ct2/show/NCT03748784. Hozzáférés 2020. április 18.
23. A RegenxBio 2019 első negyedéves pénzügyi és működési eredményekről és további pozitív időközi I/IIa fázisú vizsgálati eredményekről számol be a nedves AMD kezelésére szolgáló RGX-314 esetében. Rockville, MD; 2019. május 7. https://www.prnewswire.com/news-releases/regenxbio-reports-first-quarter-2019-financial-and-operating-results-and-additional-positive-interim-phase-iiia-trial-update-for-rgx-314-for-the-treatment-of-wet-amd-300845423.html Hozzáférés: 2020. július 9.
