- Mi az entrópia?
- Mi a termodinamika harmadik törvénye?
- A termodinamika harmadik törvényének jelentősége
A termodinamika harmadik törvénye kimondja, hogy ahogy egy rendszer hőmérséklete közelít az abszolút nullához, az entrópia állandóvá válik, vagy az entrópia változása nulla. A termodinamika harmadik törvénye megjósolja egy rendszer tulajdonságait és az entrópia viselkedését az abszolút hőmérsékletnek nevezett egyedi környezetben.
A korlátos vagy izolált rendszer entrópiája állandóvá válik, amint hőmérséklete az abszolút hőmérséklethez (abszolút nulla) közelít.
A termodinamika a fizikai tudományok egyik legfontosabb és legszélesebb körben vizsgált ága. Azon kívül, hogy a gépészmérnökhallgatókat gyötri akadémiai életük nagy részében, mindenütt jelen van a légkondicionálóm hideg fuvallatától kezdve az ipari korszak egyik csúcspontjáig – a gőzgépig. Végrehajtását három törvény szabályozza, amelyeket a termodinamika törvényei néven ismerünk. A törvények meghatározzák, hogy a munka, a hő és az energia hogyan hat egy rendszerre. A rendszer az Univerzum bármely olyan végesen behatárolt területe, amelyen keresztül energia kerül átvitelre. Minden, ami ezen a határon kívül van, az a környezete.
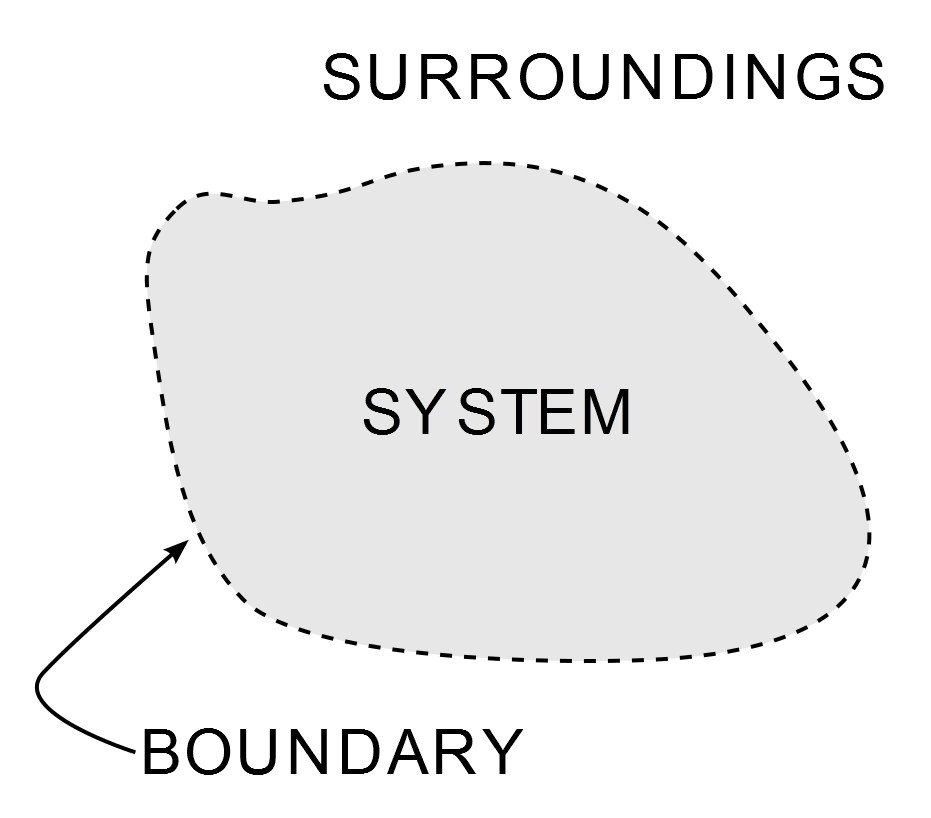
A rendszer ábrázolása a termodinamikában. (Photo Credit : Wavesmikey / Wikipedia Commons)
Mi az entrópia?
Míg a termodinamika első törvénye azt jelenti, hogy az Univerzum véges felhasználható energiával kezdődött, ahol egy energiát felvevő rendszer részben munkára, részben pedig belső hőmérsékletének növelésére fordítja azt, a második törvény ennek következményeit vizsgálja. Ez magában foglalja ennek a véges felhasználható energiának a felhasználhatatlan energiává való átalakulását; például az anyag keletkezését, amely évmilliárdokkal ezelőtt következett be az Univerzum kezdeti energiájának sűrűsödése következtében. Ebben a folyamatban a véges felhasználható energia most már használhatatlan energiává alakul át.
Ezt a használhatatlan energiát az “entrópia” nevű valamivel mérik, ami egy barométer egy rendszer véletlenszerűségének vagy rendezetlenségének mérésére.
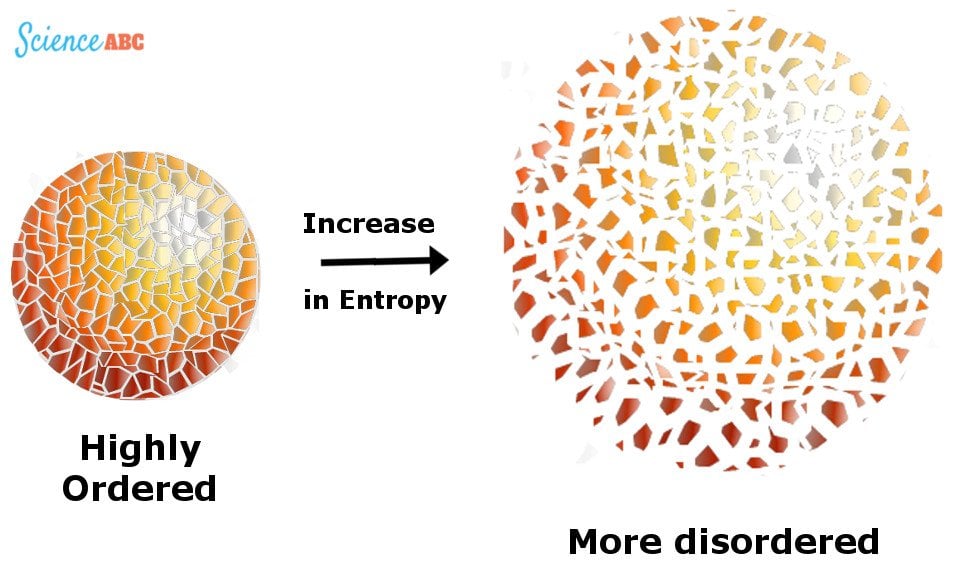
Az entrópia mint a rendezetlenség növekedése ábrázolása.
A Világegyetem olyan, mint egy rendezetlenül szanaszét heverő ruhákkal teli szoba. Ennek a rendszernek az entrópiája növekszik, ahogy egyre több ruhát használnak és dobnak el, kiegészítve a rendetlenséget, hacsak a lakó nem tesz erőfeszítést arra, hogy összeszedje és rendszerezze őket, ami csökkenti ezt a rendetlenséget.
Az Univerzumot egyetlen rendszernek tekintve, a környezetében nincs semmi, amiből energiát nyerhetne, így az összes energiáját használhatatlan energiává alakítva csak egy hideg, sötét hely marad utána. Ezt hívják hőhalálnak, és ez az egyik módja annak, hogy az Univerzum véget érhet. Egy olyan határolt rendszer, mint a mi Univerzumunk, véges energiaforrásokkal rendelkezik, mint például fényes csillagai, amelyek eónokig égnek, mielőtt megadnák magukat a természet kegyetlen törvényeinek.

Mi a termodinamika harmadik törvénye?
A termodinamika harmadik törvénye megjósolja egy rendszer tulajdonságait és az entrópia viselkedését egy egyedi környezetben, amelyet abszolút hőmérsékletnek neveznek. Az abszolút hőmérséklet a legalacsonyabb ismert hőmérséklet, és meghatározza az Univerzum hőmérsékleti tartományának alsó határát.
Milyen király! Nem, komolyan, milyen hideg ez? Az abszolút hőmérséklet 0 Kelvin, a hőmérséklet szabványos mértékegysége, vagyis -273,15 Celsius fok! Az abszolút hőmérsékletet egyes körökben és országokban abszolút nullának is nevezik. Ez a skála ad némi támpontot.
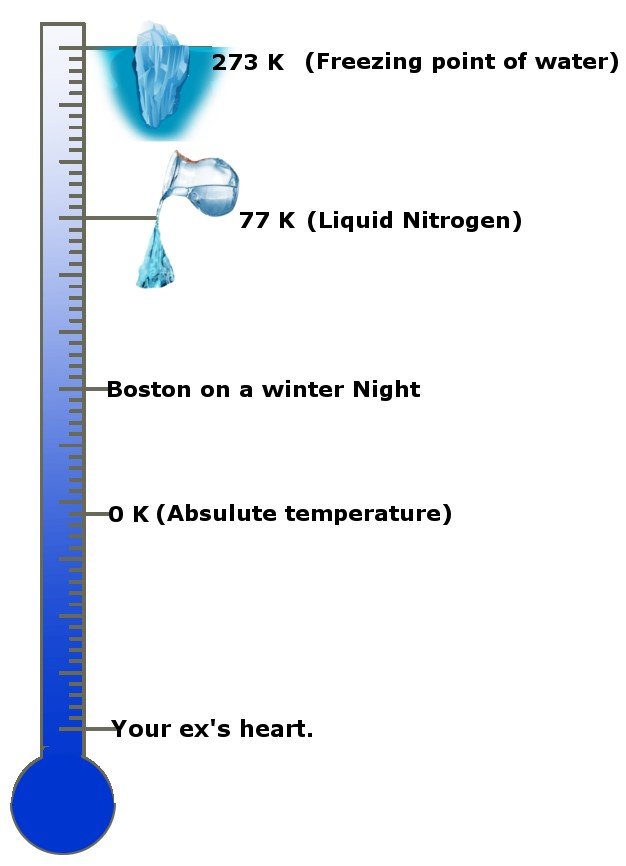
A harmadik törvény kimondja, hogy ahogy egy rendszer hőmérséklete közelít az abszolút nullához, az entrópia állandóvá válik, vagy az entrópia változása nulla.

A kijelentést ez az egyenlet ábrázolja, ahol T a hőmérsékletre hasonlít, delta S pedig a rendszer entrópiájának változása. A nulla felé mutató nyíllal ábrázolt “nullára tendál” jelölés azt jelenti, hogy ahogy a hőmérséklet végtelenül kicsi értékre csökken, a rendszer úgy éri el az állandó entrópiát, hogy energiát von el a környezetéből, de ahogy az első törvény diktálja, ennek az energiának egy része hozzáadódik a rendszer belső energiájához, és ezzel tagadja az állandó entrópiájú állapotot.
A termodinamika harmadik törvényének jelentősége
A harmadik törvény ritkán alkalmazható a mindennapi életünkben, és a legalacsonyabb ismert hőmérsékleten lévő tárgyak dinamikáját szabályozza. Meghatározza az úgynevezett “tökéletes kristályt”, amelynek atomjai a helyükön ragadnak. A tökéletes kristály tehát egyáltalán nem rendelkezik entrópiával, ami csak az abszolút hőmérsékleten érhető el.
Az entrópia fogalma az idő folyamatos folyását objektíven meghatározó egyes elméletekben is népszerű, mint például az Univerzum entrópiájának lineáris növekedése.
Az anyag keletkezésére vonatkozó reakciók entrópiaváltozása 0 Kelvin hőmérsékleten valójában nulla lesz, bár gyakorlatilag minden anyagban megnyilvánul valamilyen mértékű entrópia, a legapróbb hőmennyiség jelenléte miatt. A leghidegebb, amit eddig mértünk, 3 K, az Univerzum távoli mélységeiben, a csillagokon és galaxisokon túl.
Más szóval, élvezzük a nyarat, amíg tart!
Mi a termodinamika első törvénye?
Mi a termodinamika második törvénye?
