A site-directed mutagenesis (SDM) egy olyan technika, amelyet egy vagy több bázis mutációjára használnak egy plazmidban. Ez a megközelítés megváltoztathatja az aminosav-összetételt, megsemmisítheti a transzkripciós faktorok kötőhelyeit, vagy fúziós fehérjéket hozhat létre – hogy csak néhány példát említsünk.
Bár az SDM-et leginkább a nukleinsavak és fehérjék szerkezetének és biológiai aktivitásának vizsgálatára használják, hasznos a restrikciós enzimek felismerőhelyeinek bevezetésére vagy eltávolítására is a klónozás elősegítése érdekében.
Az SDM továbbá hasznos kodon-optimalizálási eszköz lehet a ritka kodonok helyettesítésére az expressziós vektorokban a heterológ fehérjék expressziós hatékonyságának javítása érdekében. Erre néha a codon bias miatt van szükség, egy olyan jelenség miatt, amikor az organizmusok bizonyos kodonokat előnyben részesítenek másokkal szemben, attól függően, hogy a sejtben milyen tRNS-ek állnak rendelkezésre. A kodonhasználatról és a kodon torzításról itt olvashat bővebben.
A kódoló szekvencia megváltoztatásakor az SDM olyan specifikus mutáns konstrukciókat hoz létre, amelyekből hiányoznak a kritikus maradékok vagy fehérjetartományok, amelyek részt vesznek a poszt-transzlációs módosításokban vagy a fehérje stabilitásának szabályozásában. A kritikus maradékok vagy régiók, például foszforilációs helyek vagy kritikus domének eltávolítása a plazmidokban egy módot biztosít bizonyos fehérjejellemzők fontosságának bemutatására. Például a foszforilációs helyek, például a szerin nem reaktív alaninná vagy foszfomimetikumokká, például aszparaginsavvá történő módosítása megbízható bizonyítékot szolgáltat a fehérje helyspecifikus foszforilációjára. Lehetővé teszi az ilyen poszt-transzlációs módosítások in vitro hatásainak vizsgálatát.
A hely-irányított mutagenezis hagyományos megközelítései
Inverz PCR
A >50 bp méretű deléciók vagy inszerciók esetében az inverz PCR a legnépszerűbb megközelítés. Az inverz PCR back-to-back primereket használ a teljes plazmid amplifikálásához, majd a lineáris termék ligálásával kör alakú DNS-t képez. Ez a technika alkalmas nagyobb inszerciók vagy deléciók, pl. egy szabályozó domén eltávolítása egy fehérjéből.
Deléciók esetében a kiválasztott területet olyan primerek tervezésével lehet eltávolítani, amelyek a célzott deléciós zóna két oldalán kapcsolódnak. Az amplifikáció ettől a területtől kifelé halad, így kizárva ezt a régiót a PCR-termékből. A lineáris termék ligálása után az új konstrukcióból hiányozni fog ez a deléciós tartomány. Ezt a folyamatot az alábbi 1. ábra vázolja fel vázlatosan.
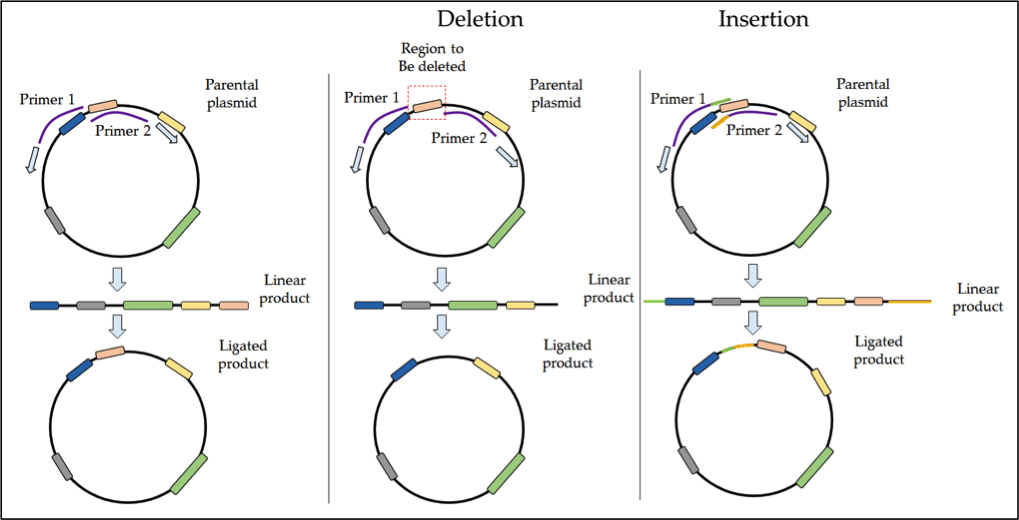
1. ábra. Az inverz PCR protokollja az SDM-ben.
Az inszerciókat a megfelelő extra bázisokat tartalmazó flankáló szekvenciákkal átfedő primerek használatával lehet elérni. Az inverz PCR-rel kapcsolatos további információkért tekintse meg ezeket a forrásokat:
- Ochman et al. (1998) Genetic Applications of an Inverse Polymerase Chain Reaction. Genetics. 120:621-623.
- Clifford N. Dominy és David W. Andrews. Hely-irányított mutagenezis inverz PCR segítségével.
SDM módosított primerek használatával
Ez a technika módosított primereket használ a kis bázispár-változások plazmidba történő beépítésére, és a helyspecifikus mutációkhoz választott módszer. Először is meg kell terveznünk néhány primert. De mielőtt belekezdenél:
- Nyomtass ki egy aminosav-kódontáblázatot
- Legyen készenlétben a plazmid vagy a fehérje szekvenciája.
- Győződj meg róla, hogy tudod, hol van a startkódon, és milyen olvasási keretben olvassák a szekvenciádat.
primerek tervezése
Közel 30 bp hosszúságú SDM-primerekre törekedjen, amelyekben a mutált hely a lehető legközelebb van a központhoz. Bár elfogadható, hogy a primerek szükség szerint kicsit hosszabbak vagy rövidebbek legyenek, a mutált hely mindkét oldalán legalább 12 bp-nek kell lennie.
Ha segítségre van szüksége a primerek tervezéséhez, a http://molbiol-tools.ca/PCR.htm felsorol néhány igazán hasznos forrást, hogy elindulhasson az úton.
Válassza ki a megfelelő reagenseket
A közönséges Taq-polimeráz egyszerűen nem elég, ha SDM-ről van szó – egy korrektorenzimet kell használnia. Számos kereskedelmi forgalomban kapható polimeráz-készlet létezik, amelyek megfelelnek a feladatnak, és számos funkciót tartalmaznak, beleértve a nagy hűséget (korrektorolvasási képességet) és a hot start aktiválást. Az egyik lehetőség a Takara In-Fusion HD Cloning Plus – egy minden az egyben megoldás, amely tartalmaz egy nagy hűségű polimerázt, egy PCR-tisztító készletet, klónozó enzimet és kompetens sejteket a hely-irányított mutagenezishez.
Ne feledjük, hogy mint a legtöbb laboratóriumi reagensnek, sok polimeráznak megvannak a maga előnyei és hátrányai – általában a laboratóriumoknak történelmi okai vannak arra, hogy az egyiket a másik helyett válasszák, és ritkán térnek el ettől. Bár ésszerű ragaszkodni ahhoz, ami működik, nem árt, ha elolvassa a szakirodalmat más elérhető forrásokon, hogy megbizonyosodjon arról, hogy a legjobb reagenseket használja a munkához!
PCR-reakció
A használt PCR-körülmények a választott kit és polimeráz, valamint az Ön által tervezett primerek és a termék mérete függvényében változnak. Az alábbiakban bemutatott példa azonban jó kiindulópont.
| Step | Temp (°C) | Time (s) | Cycles |
|---|---|---|---|
| Denature | 94 | 15 | 18 |
| Anneal | 60 | 30 | 18 |
| Extension | 72 | 20/kb plazmid | 18 |
1. táblázat:
A ciklusok számának alacsonyan tartása megakadályozza a nem kívánt mutációk kialakulását. Tizennyolc ciklusnak ésszerű mennyiségű mutált terméket kell eredményeznie nemkívánatos mutációk beépítése nélkül. Vegye figyelembe, hogy a ciklusok száma a hibakeresés során szükség esetén megváltoztatható.
Feldolgozza!
Most, hogy a PCR-termék készen áll, ne feledkezzen meg a kritikus lépésről – a feltárásról! Itt megemészted a szülői templát DNS-t, hogy biztosítsd, hogy csak a mutált plazmidot kapod a bakteriális transzformációhoz. A standard protokollok szerint 1 órán át kell inkubálni 37°C-on a Dpn1 endonukleázzal, hogy minden dam-metilált és hemi-metilált szülői DNS-t megemésszünk, és így a kívánt mutált plazmidot kapjuk.
Transzformálás és szekvenálás
Transzformáljuk a plazmidot kompetens sejtekbe, ahogyan bármely más expressziós plazmiddal tennénk, és izoláljuk az egyes kolóniákat a plazmid izolálásához.
Most már rendelkeznünk kell egy kis mennyiséggel a kívánt plazmidból. Mielőtt kísérletezni kezdene, küldjön el egy mintát szekvenálásra, hogy megerősítse a kívánt módosítás(ok) jelenlétét. Ugyanilyen fontos a másodlagos nemkívánatos mutációk hiányának biztosítása.
Ha a szekvenálás pozitív eredménnyel tér vissza – gratulálok, Ön egy SDM-profi! De ha a szekvenálás negatív eredménnyel tér vissza – ne bosszankodjon! Bármikor megpróbálhatja újra – az SDM hibaelhárításával kapcsolatos szakértői tippjeink segítenek Önnek visszatérni a helyes útra!
Most az oligonukleotidszintézis csökkenő költségei és a szintetikus biológia fejlődése azt jelenti, hogy a szintetikus megközelítések egyre nagyobb teret nyernek a hely-irányított mutagenezissel szemben. Továbbá a CRISPR/Cas9 technológia megjelenése szintén leegyszerűsítette a génszerkesztést, így a mutagenezis ma már in vitro és in vivo is elvégezhető néhány egyszerű lépésben. Mindazonáltal az SDM továbbra is a molekuláris biológia eszköztárának egyik legfontosabb eleme, és nem fog egyhamar sehová sem tűnni.
Eredetileg 2016-ban jelent meg. Frissítve és újraközölve 2018-ban.

Segített ez Önnek? Akkor kérjük, ossza meg a hálózatával.
