A diasztereotópia sztereokémiai kifejezés egy molekulában lévő két olyan csoport közötti kapcsolatra utal, amelyek kicserélése esetén diasztereomer vegyületek keletkeznének. A diasztereotóp csoportok gyakran, de nem mindig azonos csoportok, amelyek ugyanahhoz az atomhoz kapcsolódnak egy molekulában, amely legalább egy királis központot tartalmaz.
Például az (S)-2-bromobutánban lévő CH2-rész két hidrogénatomja diasztereotóp. Az egyik hidrogénatom (kék színű) brómatomra cserélésével (2S,3R)-2,3-dibrombután keletkezik. A másik hidrogénatom (piros színű) brómatomra cserélése a (2S,3S)-2,3-dibrombután diasztereomert eredményezi.
 |
 |
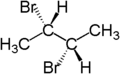 |
| (S)-2-bromobután | (2S,3R)-2,3-dibromobutane | (2S,3S)-2,3-dibromobután |
A diasztereotóp csoportokat tartalmazó királis molekulákban, mint például a 2-bromobutánban, nem követelmény az enantiomer vagy optikai tisztaság; arányától függetlenül minden egyes enantiomer a diasztereomerek enantiomer halmazát fogja létrehozni a diasztereotóp csoportok helyettesítésével (bár, mint a 2-brombután brómmal történő helyettesítésénél, a mezo-izomerek szigorúan véve nem rendelkeznek enantiomerrel).
A diasztereotóp csoportok nem tükörképei egymásnak semmilyen sík körül. Mindig különböznek egymástól, bármilyen környezetben, de nem biztos, hogy megkülönböztethetők. Például az etil-fenilalaninát-hidrokloridban (PhCH2CH(NH3+)COOCH2CH3 Cl-) mindkét CH2-hidrogénpár diasztereotóp, és mindkettő különálló 1H-NMR jelpárokat ad DMSO-d6-ban 300 MHz-en, de a hasonló etil-2-nitrobutanoátban (CH3CH2CH(NO2)COOCH2CH3) csak a királis centrum melletti CH2-csoport ad különálló jeleket a két hidrogénjéről ugyanazzal a műszerrel CDCl3-ban. Az ilyen jelek gyakran összetettek a kémiai eltolódás kis különbségei, az átfedés és a geminális hidrogének közötti további erős csatolás miatt. Másrészt az ipszenol két CH3-csoportja, amelyek három kötéssel távolabb vannak a királis centrumtól, külön 1H-dubletteket ad 300 MHz-en és külön 13C-NMR-jeleket CDCl3-ban, de az etil-alaninát-hidroklorid diasztereotópos hidrogénjei (CH3CH(NH3+)COOCH2CH3 Cl-), amelyek szintén három kötéssel távolabb vannak a királis centrumtól, alig megkülönböztethető 1H-NMR-jeleket mutatnak DMSO-d6-ban.

Achirális molekulákban is előfordulnak diasztereotópos csoportok. Például a 3-pentanolban (1. ábra) bármelyik CH2-hidrogénpár diasztereotóp, mivel a két CH2-szénatom enantiotóp. A négy CH2-hidrogén bármelyikének szubsztitúciója egyszerre két királis centrumot hoz létre, és a két lehetséges hidrogénszubsztitúciós termék bármelyik CH2-szénatomon diasztereomer lesz. Ez a fajta kapcsolat gyakran könnyebben kimutatható ciklikus molekulákban. Például a ciklopentanol (2. ábra) bármely CH2-hidrogénpárja hasonlóan diasztereotóp, és ez könnyen felismerhető, mivel a párban az egyik hidrogén cisz viszonyban áll az OH-csoporttal (a gyűrűfelület azonos oldalán), míg a másik transz viszonyban áll hozzá (az ellentétes oldalon).
A diasztereotóp kifejezést alkalmazzák az alkénrész azonos végéhez kapcsolódó azonos csoportokra is, amelyek kicserélése esetén geometriai izomereket hoznának létre (amelyek szintén a diasztereomerek kategóriájába tartoznak). Így a propén CH2-hidrogénjei diasztereotópok, az egyik cisz-, a másik transz-irányú a CH3-csoporthoz képest, és az egyik vagy a másik CH3-mal való helyettesítése cisz- vagy transz-2-butént eredményezne.

A diasztereotópia nem korlátozódik a szerves molekulákra, sem a szénhez kötött csoportokra, sem a királis tetraéderes (sp3-hibridizált) centrummal rendelkező molekulákra: például a trisz(etiléndiamin)króm(III)ion (Cr(en)33+) bármely CH2 vagy NH2 csoportjában lévő hidrogénpár, ahol a fémcentrum királis, diasztereotóp (2. ábra).
Az enantiotóp és diasztereotóp kifejezések a síkbeli csoportok (különösen a karbonilcsoportok és az alkénmozzanatok) oldalaira is alkalmazhatók. Lásd a Cahn-Ingold-Prelog prioritási szabályt.
