Momenty dipolowe
Asymetryczny rozkład ładunków w substancji polarnej, takiej jak HCl, wytwarza moment dipolowy, gdzie ∗ Qr ∗ w metrach (m). jest skracany grecką literą mu (µ). Moment dipolowy definiuje się jako iloczyn ładunku cząstkowego Q na związanych atomach i odległości r między ładunkami cząstkowymi.
Gdy cząsteczka z momentem dipolowym znajdzie się w polu elektrycznym, ma tendencję do orientowania się względem pola elektrycznego ze względu na asymetryczny rozkład ładunków (Rysunek rzedstawiający rozkład ładunków).
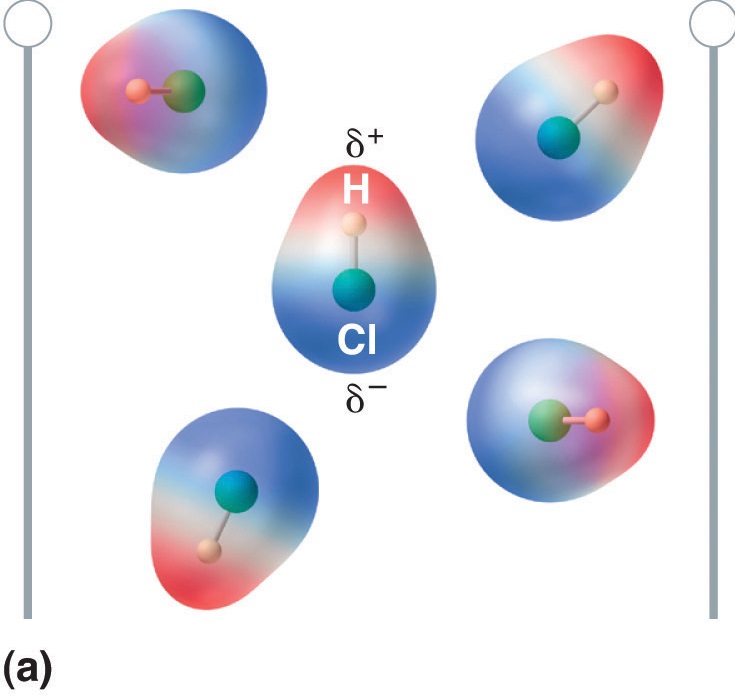
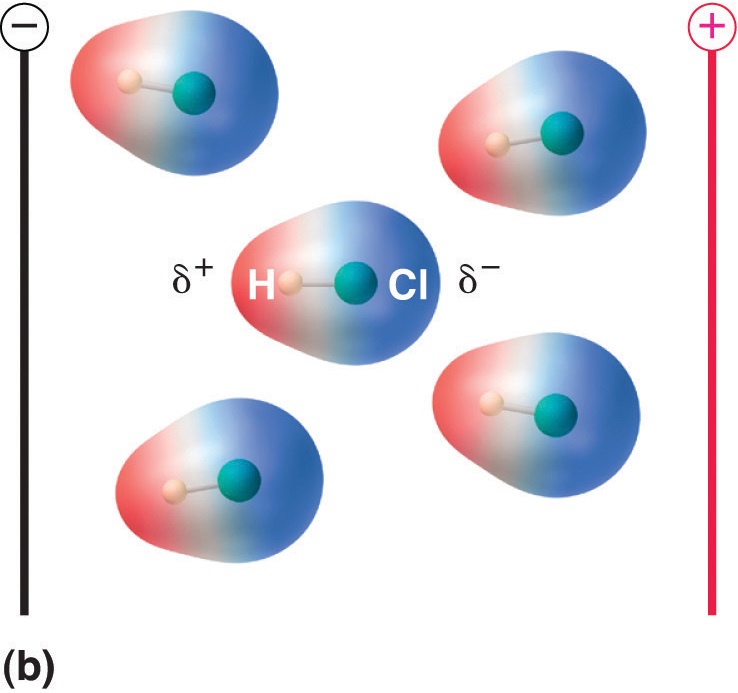
Rysunek rzedstawiający rozkład ładunków (Rysunek rzedstawiający rozkład ładunków): Molekuły posiadające moment dipolowy częściowo wyrównują się pod wpływem przyłożonego pola elektrycznego. Przy braku pola (a), cząsteczki HCl są losowo zorientowane. Gdy przyłożone jest pole elektryczne (b), cząsteczki mają tendencję do ustawiania się w linii z polem, tak że dodatni koniec dipola cząsteczkowego wskazuje w kierunku ujemnego końca i odwrotnie.
Zmierzony moment dipolowy HCl wskazuje, że wiązanie H-Cl ma około 18% charakter jonowy (0,1811 × 100), lub 82% charakter kowalencyjny. Zamiast pisać HCl jako
możemy zatem wskazać separację ładunków ilościowo jako
Nasze obliczone wyniki zgadzają się z różnicą elektronegatywności pomiędzy wodorem i chlorem χH = 2,20; χCl = 3,16, χCl – χH = 0,96), wartością mieszczącą się w zakresie dla polarnych wiązań kowalencyjnych. Moment dipolowy oznaczamy pisząc strzałkę nad cząsteczką. Z matematycznego punktu widzenia momenty dipolowe są wektorami i posiadają zarówno wielkość jak i kierunek. Moment dipolowy cząsteczki jest sumą wektorową dipoli poszczególnych wiązań. W HCl, na przykład, moment dipolowy jest pokazany w następujący sposób:
![]()
Strzałka pokazuje kierunek przepływu elektronów, wskazując w stronę bardziej elektroujemnego atomu.
Ładunek na atomach wielu substancji w fazie gazowej może być obliczony przy użyciu zmierzonych momentów dipolowych i odległości między wiązaniami. Rysunek przedstawia wykres procentowego charakteru jonowego w zależności od różnicy w elektroujemności wiązanych atomów dla kilku substancji. Zgodnie z wykresem, wiązanie w takich gatunkach jak NaCl(g) i CsF(g) jest znacznie mniejsze niż 100% charakteru jonowego. Jednak w miarę kondensacji gazu w ciało stałe, oddziaływania dipolowo-dipolowe pomiędzy spolaryzowanymi gatunkami zwiększają separację ładunków. W krysztale następuje więc przeniesienie elektronu z metalu na niemetal, a substancje te zachowują się jak klasyczne związki jonowe. Dane na rysunku pokazują, że gatunki dwuatomowe o różnicy elektroujemności mniejszej niż 1,5 mają charakter jonowy w mniej niż 50%, co jest zgodne z naszym wcześniejszym opisem tych gatunków jako zawierających polarne wiązania kowalencyjne. Wykorzystanie momentów dipolowych do określenia jonowego charakteru wiązania polarnego jest zilustrowane w Przykładzie
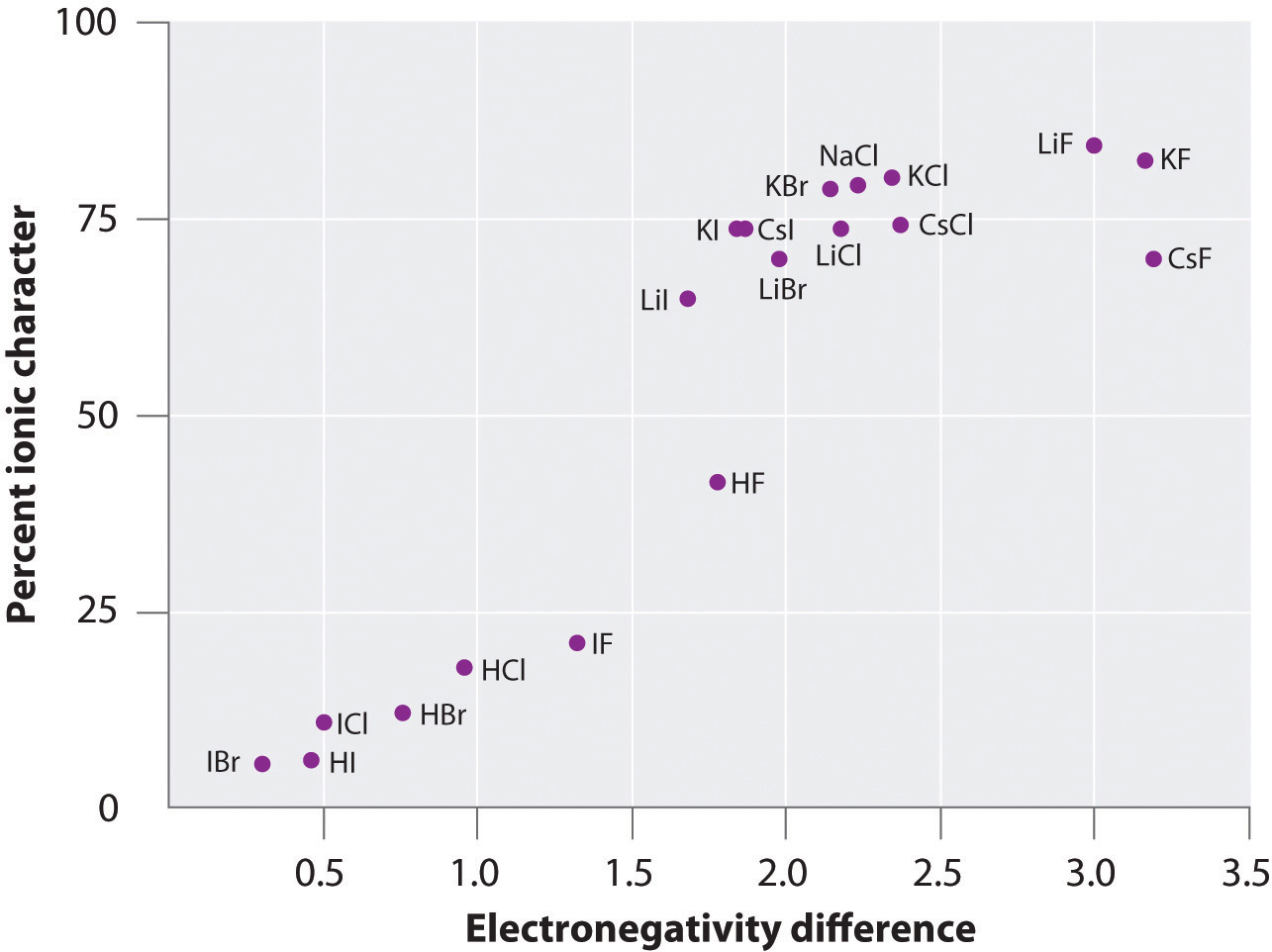
Rycina \(\PageIndex{6}}: A Plot of the Percent Ionic Character of a Bond as Determined from Measured Dipole Moments versus the Difference in Electronegativity of the Bonded Atoms.In the gas phase, even CsF, which has the largest possible difference in electronegativity between atoms, is not 100% ionic. Stały CsF, jednakże, jest najlepiej postrzegany jako 100% jonowy z powodu dodatkowych oddziaływań elektrostatycznych w sieci.
.
