Enthalpy
Termodynamika jest badanie związku między ciepłem (lub energii) i pracy. Entalpia jest głównym czynnikiem w termodynamice. Jest to zawartość ciepła w systemie. Ciepło, które przechodzi do lub z systemu podczas reakcji to zmiana entalpii. To, czy entalpia układu wzrasta (tzn. kiedy energia jest dodawana) czy maleje (ponieważ energia jest oddawana) jest kluczowym czynnikiem, który określa, czy reakcja może zajść.
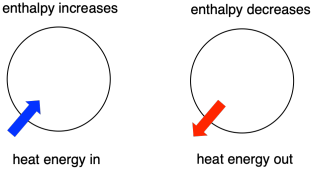
Niekiedy nazywamy energię cząsteczek podlegających zmianie „entalpią wewnętrzną”. Czasami nazywamy ją „entalpią układu”. Te dwa wyrażenia odnoszą się do tej samej rzeczy. Podobnie, energia cząsteczek, które nie biorą udziału w reakcji nazywana jest „entalpią zewnętrzną” lub „entalpią otoczenia”.
Z grubsza rzecz biorąc, zmiany energii, którym przyglądaliśmy się we wprowadzeniu do termodynamiki, były zmianami entalpii. W następnym rozdziale zobaczymy, że istnieje inny czynnik energetyczny, entropia, który również musimy brać pod uwagę w reakcjach. Na razie przyjrzymy się tylko entalpii.
- Entalpia to zawartość ciepła w systemie.
- Zmiana entalpii w reakcji jest w przybliżeniu równoważna ilości energii utraconej lub uzyskanej podczas reakcji.
- Reakcja jest faworyzowana, jeśli entalpia układu maleje w czasie trwania reakcji.
To ostatnie stwierdzenie jest bardzo podobne do opisu energetyki na poprzedniej stronie. Jeśli układ przechodzi reakcję i oddaje energię, jego własna zawartość energii maleje. Pozostaje mu mniej energii, jeśli trochę jej oddał. Dlaczego energia zestawu molekuł zmienia się, gdy zachodzi reakcja? Aby odpowiedzieć na to pytanie, musimy zastanowić się, co dzieje się w reakcji chemicznej.
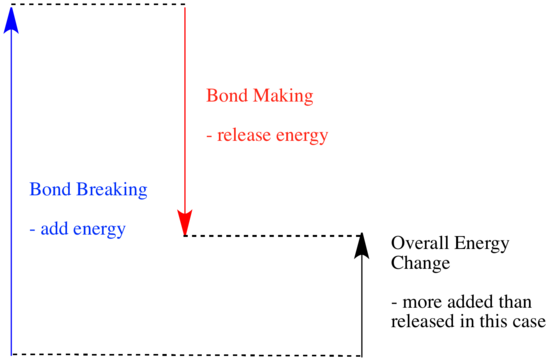
W reakcji dochodzi do zmiany wiązania chemicznego. Niektóre z wiązań w reaktorach są zerwane, a nowe wiązania są tworzone w celu utworzenia produktów. Zerwanie wiązań kosztuje energię, ale energia jest uwalniana, gdy tworzone są nowe wiązania.
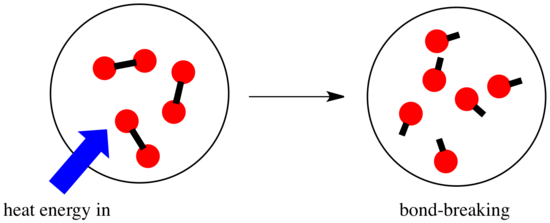
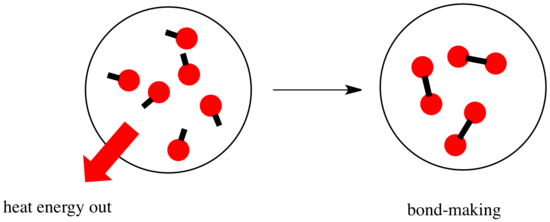
To, czy reakcja jest w stanie postępować, może zależeć od równowagi między etapami tworzenia i zrywania wiązań.
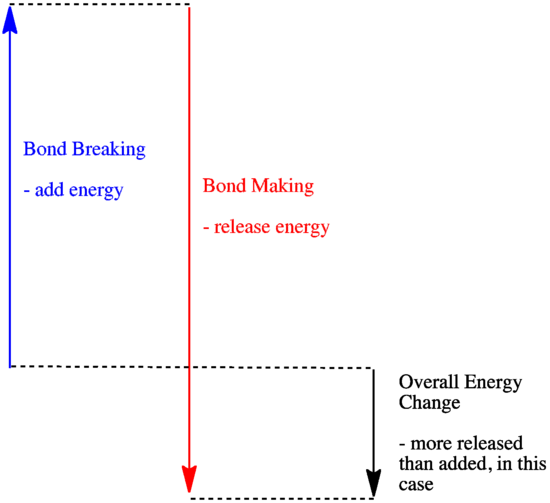
- Reakcja jest egzotermiczna, jeśli więcej energii jest uwalniane przez tworzenie nowych wiązań niż zużywane przez zrywanie starych wiązań.
- Reakcja jest egzotermiczna, jeśli słabsze wiązania są wymieniane na silniejsze.
- Reakcja jest endotermiczna, jeśli rozerwanie wiązania kosztuje więcej energii niż ta, która jest dostarczana podczas tworzenia wiązania.
Energie wiązań (ilość energii, która musi być dodana, aby rozerwać wiązanie) są ważnym czynnikiem w określaniu, czy reakcja zajdzie. Energie wiązań nie zawsze są łatwe do przewidzenia, ponieważ siła wiązania zależy od wielu czynników. Jednakże, wiele osób wykonało wiele pracy mierząc siłę wiązań i zebrali informacje w tabelach, więc jeśli chcesz wiedzieć jak silne jest wiązanie, możesz po prostu poszukać potrzebnych informacji.
| Wiązanie | Energia wiązania (kcal/mol) | Wiązanie | Energia wiązania (kcal/mol) |
| H-H | 104 | O-H | 111 |
| C-C | 83 | C-H | 99 |
| O=O | 119 | N-H | 93 |
| N=N | 226 | C=O | 180 |
Na przykład, Załóżmy, że chciałeś wiedzieć, czy spalanie metanu jest reakcją egzotermiczną czy endotermiczną. Zgaduję, że jest egzotermiczna, ponieważ ta reakcja (i inne podobne) jest używana do dostarczania ciepła do wielu domów poprzez spalanie gazu ziemnego w piecach.
„Spalanie” metanu oznacza, że jest on spalany w powietrzu, tak że reaguje z tlenem. Produktami spalania węglowodorów są głównie dwutlenek węgla i woda. Atom węgla w metanie (CH4) zostaje włączony do cząsteczki dwutlenku węgla. Atomy wodoru zostają włączone do cząsteczek wody. W metanie są cztery atomy wodoru, więc to wystarczy, aby utworzyć dwie cząsteczki H2O.
- Cztery wiązania C-H muszą zostać przerwane podczas spalania metanu.
- Cztery nowe wiązania O-H są tworzone, gdy hydrogeny z metanu są dodawane do nowych cząsteczek wody.
- Dwa nowe wiązania C=O są wykonane, gdy węgiel z metanu jest dodawany do cząsteczki CO2.
Innym elementem układanki jest źródłem tlenu dla reakcji. Tlen jest obecny w atmosferze głównie jako O2. Ponieważ potrzebujemy dwóch atomów tlenu w cząsteczce CO2 i dwóch kolejnych atomów tlenu dla dwóch cząsteczek wody, potrzebujemy w sumie czterech atomów tlenu do reakcji, które mogą być dostarczone przez dwie cząsteczki O2.
-
Dwa wiązania O=O muszą zostać zerwane, aby dostarczyć atomy tlenu dla produktów.
W sumie, to cztery wiązania C-H i dwa O=O zerwane, plus dwa C=O i cztery O-H utworzone. To jest 4 x 99 kcal/mol dla wiązań C-H i 2 x 119 kcal/mol dla wiązań O=O, w sumie 634 kJ/mol dodane. Reakcja uwalnia 2 x 180 kcal/mol dla wiązań C=O i 4 x 111 kcla/mol dla wiązań OH, w sumie 804 kcal/mol. W sumie jest o 170 kcal/mol więcej uwolnionych niż zużytych.
To oznacza, że reakcja jest egzotermiczna, więc wytwarza ciepło. Jest to prawdopodobnie dobry sposób na ogrzanie twojego domu.
