Wprowadzenie
Przewlekła obturacyjna choroba płuc (POChP) jest istotną przyczyną umieralności i zachorowalności we współczesnym świecie. Śmiertelność z powodu tej choroby wzrasta i przewiduje się, że do 2020 r. stanie się ona trzecią główną przyczyną zgonów na świecie.1 Nie jest możliwe zdefiniowanie POChP wyłącznie na podstawie natężonej objętości wydechowej w 1 s (FEV1), dlatego Światowa Inicjatywa na rzecz Przewlekłej Obturacyjnej Choroby Płuc (GOLD) opracowała wielowymiarową definicję oceny POChP.2 Nowa definicja uwzględnia występowanie objawów i wcześniejszą historię zaostrzeń oprócz wartości FEV1, a także kładzie nacisk na ocenę chorób współistniejących. W celu oceny objawów zaleca się stosowanie zmodyfikowanego testu Medical Research Council (mMRC) lub COPD Assessment Test (CAT). Dodatkowo do oceny wpływu choroby na życie codzienne zastosowano specyficzną dla choroby skalę jakości życia (SGRQ, SF-36, CCQ). George’s Respiratory Questionnaire (SGRQ).3,4 Ladeira i wsp.5 wykazali, że CAT był skorelowany ze wskaźnikiem BODE.
COPD jest chorobą złożoną i obejmuje komponenty genetyczne, komórkowe i molekularne. Istnieje wiele różnych komórek i cząsteczek zaangażowanych w szlaki zapalne. Do wykazania potencjalnego zapalenia ogólnoustrojowego związanego z chorobą wykorzystano kilka wskaźników.6-9 Zapalenie dróg oddechowych i miąższu płuc jest głównym mechanizmem patogenetycznym POChP. Ponadto utrzymujący się ogólnoustrojowy stan zapalny może być związany z różnymi pozapłucnymi chorobami współistniejącymi i skutkami płucnymi.10 Ostatnie badania dostarczyły dowodów na istnienie odrębnego „nowego ogólnoustrojowego fenotypu zapalnego POChP”. 7 W ostatnim badaniu wykazano, że współwystępowanie chorób sercowo-naczyniowych i cukrzycy było związane z wyższymi poziomami niektórych markerów zapalenia ogólnoustrojowego.11 Dlatego obciążenie genetyczne, zapalenie ogólnoustrojowe i choroby towarzyszące są związane z różnymi fenotypami POChP. Istotne jest, aby opracować nowe perspektywy postępowania w tej chorobie.
Obecnie CAT jest coraz częściej wykorzystywana do oceny i monitorowania POChP. Chociaż zdefiniowano kilka biomarkerów surowicy w POChP, nie ma jednego wystarczającego i skutecznego pojedynczego biomarkera, który mógłby być stosowany do oceny stanu pacjentów z POChP. Wykazano, że biomarkery są związane z kilkoma parametrami, takimi jak zapalenie, hospitalizacja i śmiertelność.7-13 Jednak związek między CAT a biomarkerami nie został jednoznacznie wykazany. Dlatego niniejsze badanie ma na celu zbadanie poziomu ogólnoustrojowego stanu zapalnego w POChP i określenie zależności między CAT a markerami stanu zapalnego i jakością życia.
Materiał i metodyProjekt badania
Było to przekrojowe badanie obserwacyjne z pojedynczą wizytą. Stu dziesięciu pacjentów z POChP rozpoznaną według kryteriów GOLD14 oraz sześćdziesięciu pięciu osób z grupy kontrolnej zrekrutowano w okresie od lutego 2013 do sierpnia 2013 roku. Osoby z grupy kontrolnej wybrano spośród pacjentów skierowanych do kliniki pulmonologii i chorób wewnętrznych szpitala uniwersyteckiego w Balikesir, poddawanych rutynowym badaniom. Pisemną świadomą zgodę uzyskano od wszystkich uczestników, a badanie zostało zatwierdzone przez Instytucjonalną Komisję Etyczną Wydziału Medycyny Uniwersytetu Balikesir.
Wszystkich pacjentów poddano badaniu fizykalnemu, badaniu rentgenowskiemu klatki piersiowej, badaniu czynności układu oddechowego i rutynowym badaniom analitycznym krwi. Rejestrowano liczbę zaostrzeń w poprzednim roku oraz historię palenia tytoniu. Ocenę duszności CAT, mMRC przeprowadzono w bezpośrednim wywiadzie z pulmonologiem. Wyniki SGRQ były podawane przez pacjentów. W zdrowej grupie kontrolnej wykonano jedynie badanie czynności układu oddechowego i rutynowe badania analityczne krwi.
Populacja badania
Kryteria włączenia: Pacjenci zostali włączeni do badania, jeśli; (1) byli starsi niż 40 lat; (2) byli aktualnymi lub byłymi palaczami z historią palenia ≥10 pack-years; (3) wykazywali post-bronchodilatorową FEV1
80% i FEV1/FVC0,7. Do badania włączono osoby z grupy kontrolnej, jeśli: (1) byli starsi niż 40 lat; (2) byli wolni od choroby płuc stwierdzonej przez lekarza; (3) mieli prawidłową spirometrię (FEV1>85% i FEV1/FVC>0,7); oraz (4) mieli historię palenia
Kryteria wykluczenia: Wykluczono pacjentów, którzy; (1) mieli zaostrzenie POChP w ciągu poprzednich 6 tygodni; (2) mieli zaburzenie układu oddechowego inne niż POChP lub nowotwór złośliwy; (3) mieli przewlekłą chorobę zapalną (zapalenie naczyń, nieswoiste zapalenie jelit, reumatoidalne zapalenie stawów itp.) (4) miał niekontrolowaną lub ciężką chorobę towarzyszącą (MI, arytmia itp.).
Pomiary
Cechy demograficzne, wiek, płeć, nawyki palenia, przyjęcie do służby ratowniczej lub hospitalizacja w ciągu ostatniego roku, choroby towarzyszące i istniejące leczenie zostały odpowiednio zarejestrowane. Zdefiniowaliśmy zaostrzenie jako pogorszenie objawów, które wymagało doustnych kortykosteroidów i/lub antybiotyków i/lub hospitalizacji. Choroby współistniejące ustalono na podstawie wywiadu klinicznego i wyników badania fizykalnego podczas wizyty oraz poparto przeglądem dostępnej dokumentacji medycznej. Udokumentowano aktualnie stosowane leki, w tym inhalatory, leki przeciwnadciśnieniowe i inne. Dokonano pomiaru wzrostu, masy ciała i wskaźnika BMI, a także wykonano spirometrię zgodnie z międzynarodowymi wytycznymi (ATS/ERS).15 Chorobę sklasyfikowano zgodnie ze starą i nową wersją klasyfikacji GOLD.14 Po pierwsze, klasyfikacja spirometryczna GOLD (FEV1 based (1-4) staging) i po drugie, klasyfikacja GOLD (klasa A-D). Duszność oceniano za pomocą skali duszności mMRC.16 Pacjentów z POChP podzielono na kategorie A, B, C i D, łącząc ocenę objawów za pomocą skali duszności mMRC i ryzyko zaostrzenia.
CAT: Ważność i rzetelność tureckiej wersji tej skali została wcześniej zweryfikowana.17 CAT obejmuje 8 pozycji i daje całkowitą punktację od 0 do 40; wyższe wyniki wskazują na poważniejsze pogorszenie stanu zdrowia lub mniej skuteczną kontrolę POChP.3
Kwestionariusz jakości życia: Jakość życia oceniano za pomocą tureckiego tłumaczenia Kwestionariusza Chorób Układu Oddechowego św. Jerzego (SGRQ).18
Biomarkery
Biomarkery wybraliśmy na podstawie wcześniejszych badań.7,9-13 Próbki krwi pobrane od wszystkich badanych odwirowano i przechowywano w temperaturze -80°C. Wszystkie próbki były analizowane po zakończeniu badania. Surowicę badano w urządzeniu diagnostycznym (BioTek, ELx 800, USA) przy użyciu komercyjnych zestawów (eBioscience, Human TNF-α i Human IL-6 Platinum ELISA, Austria) oraz metodami enzymatycznego testu immunoenzymatycznego (ELISA) poziomu martwicy nowotworów alfa (TNF-α) i interleukiny-6 (IL-6). Poziom białka C-reaktywnego (CRP) oceniano za pomocą analizatora chemii klinicznej (Cobes Integra 800, Roche diagnostics) przy użyciu komercyjnego zestawu. Wartość referencyjna CRP wynosi 0-0,5mg/L, natomiast analizowana najniższa wartość IL-6 wynosi 0,92pg/ml. Analizowana najniższa wartość TNFα wynosi 2,3pg/ml. Stężenia TNF-α i IL-6 w niektórych próbkach były poniżej dolnej granicy oznaczalności (LLQ). W analizie osób z wartościami poniżej LLQ zastosowano poziom nominalny równy połowie wartości LLQ, aby uniknąć odchylenia w dół danych populacyjnych.19
Analiza statystyczna
Średnie wartości CRP w grupie chorych na POChP i grupie kontrolnej (3,2 (1,5,7,1), 1,3 (0,6,2,7)) zostały zidentyfikowane na podstawie podobnych badań.7 Następnie w każdej grupie obliczono wielkość próby za pomocą wzoru obliczeniowego średniej z 80% dokładnością i 5% błędem. Ustalono, że wielkość próby powinna wynosić co najmniej 55 osób w każdej grupie. Wyniki przedstawiono w postaci średniej±SD, mediany lub procentu, zależnie od sytuacji. Do testów parametrycznych zastosowano test t-Studenta i ANOVA, a do testów nieparametrycznych testy U Manna-Whitneya, Kruskala-Wallisa i chi-square do porównań grupowych. Dokładnym testem Fishera oceniano różnice między odsetkami chorób współistniejących oraz różnice między płciami. Testem chi kwadrat oceniano różnice między odsetkami chorób współistniejących. Korelację między parami zmiennych ciągłych u chorych na POChP badano za pomocą korelacji Pearsona. Wartość p
0,05 uznawano za istotną statystycznie. Wszystkie analizy statystyczne przeprowadzono przy użyciu oprogramowania SPSS (wersja 20.0).WynikiCharakterystyka kliniczna badanych
Badaniem objęto 110 chorych (średni wiek 64±8,9 lat; 100 mężczyzn (90,9%)) oraz 65 osób z grupy kontrolnej (średni wiek 61,5±9,2 lat, 55 mężczyzn (84,6%)). Charakterystykę demograficzną i kliniczną grupy pacjentów i grupy kontrolnej przedstawiono w tabeli 1. Czterdziestu pięciu (40,9%) chorych na POChP miało chorobę towarzyszącą (choroba niedokrwienna serca (n=21), nadciśnienie tętnicze (n=13), cukrzyca (n=8), inne (n=3)). Średnia FEV1 wynosiła 48,8% wartości przewidywanej, a średnia FEV1/FVC: 55,4% w grupie chorych na POChP. Średnia punktacja CAT wynosiła 22,6 (±9,2), mMRC: 1,9 (±0,9), a całkowita SGRQ: 58,4 (±22,2). Spośród 110 pacjentów, 9,1% było w stadium 1, 37,3% w stadium 2, 42,7% w stadium 3, 10,9% w stadium 4 według klasyfikacji spirometrycznej GOLD. Kiedy pacjenci zostali sklasyfikowani w odniesieniu do GOLD staging, 27,3% stanowiło grupę A, 30,9% grupę B, 7,3% grupę C i 34,5% grupę D.
Cechy demograficzne, funkcjonalne, kliniczne grupy pacjentów i grupy kontrolnej.
| Pacjent (n=110) | Kontrola (n=65) | p-value | |
|---|---|---|---|
| Wiek | 64.0±8.9 | 61.5±9.2 | 0,080 |
| Mężczyźni n, (%) | 100 (90,9) | 55 (84.6) | 0,224 |
| BMI, kg/m2 | 26,5±5,6 | 25±2,6 | 0.064 |
| Pack-years | 38.9±23 | 0.1±1.2 | |
| Co-morbidities, n (%) | |||
| Any | 65 (59.1) | 42 (64,6) | 0,95 |
| Choroba niedokrwienna serca | 21(19,1) | 11 (16,9) | |
| HT | 13 (11.8) | 6 (9.2) | |
| DM | 8 (7.3) | 4 (6.2) | |
| Inne | 3 (2.7) | 2 (3.1) | |
| mMRC | 1.94±0.9 | 0.04±0.2 | |
| FEV1, % przewidywany | 48.8±17.8 | 89.4±5.6 | |
| FVC, % predicted | 68.7±17.8 | 92.1±5.8 | |
| FEV1/FVC, % | 55.4±12,9 | 89,6±4,7 | |
| GOLD stadium spirometryczne, n (%) | |||
| 1 | 10 (9.1) | ||
| 2 | 41 (37.3) | ||
| 3 | 47 (42.7) | ||
| 4 | 12 (10.9) | ||
| Złote stadium, n (%) | |||
| A | 30 (27.3) | ||
| B | 34 (30.9) | ||
| C | 8 (7.3) | ||
| D | 38 (34.5) | ||
| SGRQ-total score | 58.4±22.2 | ||
| CAT score | 22.6±9,2 | ||
| TNFα (pg/ml) | 109,5±58 | 14,6±18 | |
| IL-6 (pg/ml) | 10.3±18 | 2,14±1,9 | |
| CRP (mg/L) | 1,6±1,7 | 0,4±0,3 | |
Skróty: BMI, wskaźnik masy ciała, HT: nadciśnienie tętnicze, DM: cukrzyca, FEV1: natężona objętość wydechowa w 1 sekundzie, FVC: natężona pojemność życiowa, CAT: COPD assessment test.
Porównania POChP/kontrola
Nie stwierdzono istotnej różnicy między wiekiem (p=0,080, test t-Studenta) i płcią obu grup (p=0,453, dokładny test Fishera) (Tabela 1). Grupy wykazywały podobną częstość występowania chorób współistniejących (p=0,095, test χ2). Zgodnie z oczekiwaniami, chorzy na POChP mieli istotnie niższe parametry czynności płuc (FEV1, FVC, FEV1/FVC) w porównaniu z grupą kontrolną (p
0,001, test t-Studenta). Ogólnie, chorzy na POChP wykazywali wyższe stężenia CRP (1,6±1,7mg/L) i TNF-α (109,5±58pg/ml) oraz IL-6 (10,3±18pg/ml) w surowicy krwi w porównaniu ze zdrowymi kontrolami (CRP: 0,4±0,3mg/L, p0,001; TNF-α: 14,6±18pg/ml, p0,001; IL-6: 2,14±1,9pg/ml, p0,001, test t-Studenta) (Tabela 1).Związek kwestionariuszy CAT z charakterystyką pacjentów
Zaobserwowano korelację pomiędzy wynikiem CAT a stopniem spirometrycznym GOLD (Pearson’s r=0,43; p
0,001). Wynik CAT wzrastał równolegle z ciężkością choroby. Stwierdzono istotną statystycznie zależność między punktacją CAT a liczbą zaostrzeń w poprzednim roku (r=0,35 Pearsona, p0,001), czasem trwania choroby (r=0,29 Pearsona, p0,001), paleniem tytoniu (pack-year) (r=0,27 Pearsona, p=0,014) i mMRC (r=0,59 Pearsona, p0,001). Stwierdzono, że wynik CAT jest istotnie skorelowany z FEV1 (r=-0,39 Pearsona, p0,001) i FVC (r=-42 Pearsona, p=0,003). Jednocześnie zaobserwowano silną korelację pomiędzy punktacją CAT a punktacją SGRQ symptom, activity, impact i total (Pearson’s r=0,72; p0,001).Związek pomiędzy biomarkerami a charakterystyką pacjenta
Porównywano markery zapalne i parametry funkcji płuc. W miarę spadku FEV1 poziomy biomarkerów istotnie wzrastały. Poziom CRP był skorelowany z FEV1 (Pearson’s r=-0,39, p
0,001), FVC (Pearson’s r=-0,33, p0,001) i FEV1/FVC (Pearson’s r=-0,38, p0,001). Poziom TNF-α był również skorelowany z FEV1 (Pearson’s r=-0,57, p0,001), FVC (Pearson’s r=-0,37, p0,001) i FEV1/FVC (Pearson’s r=-0,66, p0,001). Poziom IL-6 był również skorelowany z FEV1 (Pearson’s r=-0,31, p0,001), FVC (Pearson’s r=-0,32, p0,001) i FEV1/FVC (Pearson’s r=-0,34, p0,001). Stwierdzono istotną korelację między CRP, TNF-α, IL-6 a paleniem tytoniu (pack-year) (odpowiednio: r=0,35, r=0,44, r=0,27, p0,001 wg Pearsona). Chorzy na POChP z chorobami układu krążenia mieli podwyższone stężenie CRP (2,98±2.4mg/L) w porównaniu do pacjentów bez chorób współistniejących (1,56±1,5mg/L, p=0,008 test ANOVA, a następnie test post hoc LSD). Nie stwierdzono istotnego związku z innymi biomarkerami i chorobami współistniejącymi. Wraz ze wzrostem IL-6 wzrastał wynik mMRC, ale zależność ta nie była istotna statystycznie (p=0,06). Gdy porównano markery stanu zapalnego z punktacją CAT, wykazano istotną korelację między poziomem CRP (r=0,43, p0,001) (ryc. 1), natomiast nie zaobserwowano korelacji z TNF-α i IL-6. Stwierdzono korelację pomiędzy poziomem CRP a TNF-α (r=0,48, p0,001). Nie zaobserwowano bezpośredniego związku pomiędzy biomarkerami a klasą A-D lub stopniami spirometrycznymi.
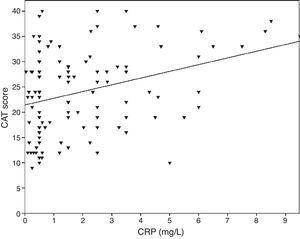
Zależność między punktacją CAT a CRP (r=0,43, p0,001).
Dyskusja
Do oceny POChP stosuje się niektóre narzędzia oceny, takie jak testy kliniczne (CAT, BODE), markery stanu zapalnego oraz kwestionariusze jakości życia. Powszechnie przyjmuje się, że do zrozumienia i zarządzania chorobą konieczna jest wielowymiarowa ocena. POChP jest złożonym zaburzeniem z komponentą ogólnoustrojową, a u niektórych chorych wydaje się występować fenotyp zapalny. W tym badaniu CAT przeprowadzono jako nowy test kliniczny i zbadano związek CAT z innymi składowymi POChP.
Jedną z tych składowych jest ogólnoustrojowy stan zapalny. Najczęściej badane w POChP biomarkery wskazujące na ogólnoustrojowy stan zapalny, które są powszechnie stosowane, to CRP, IL-6, TNF-α, IL-8 i fibrynogen. W kilku badaniach wykazano podwyższone krążące poziomy tych markerów u pacjentów ze stabilną POChP.6-9,20-23 W ostatnim badaniu Agustí i wsp. wykazali, że 30% pacjentów z POChP nie wykazywało oznak ogólnoustrojowego stanu zapalnego, a 16% pacjentów wykazywało utrzymujący się ogólnoustrojowy stan zapalny.7 Co ciekawe, w tym badaniu stwierdzono, że poziomy TNF-α i IL-8 w surowicy były wyższe u palaczy z prawidłową spirometrią w porównaniu z pacjentami z POChP. Pozostałe markery, takie jak krwinki białe, IL-6, CRP i fibrynogen były wyższe u chorych na POChP niż u palaczy z prawidłową spirometrią i osób niepalących. W badaniach własnych stężenia CRP, TNF-α, IL-6 były znamiennie wyższe u wszystkich chorych na POChP w porównaniu z grupą kontrolną. Stwierdzono, że wszystkie biomarkery są skorelowane z kumulatywną ekspozycją na palenie tytoniu i obniżeniem parametrów testu czynności płuc (FEV1, FVC, i FEV1/FVC). Poziom biomarkerów wiąże się ze stopniem obturacji przepływu powietrza. Wyniki te są zgodne z wynikami poprzednich badań przekrojowych.13 W innym badaniu, w którym analizowano wyniki badania ECLIPSE, choroby współistniejące w układzie sercowo-naczyniowym i cukrzyca były skorelowane z niektórymi markerami ogólnoustrojowego stanu zapalnego.9 W naszym badaniu pacjenci z POChP z chorobą sercowo-naczyniową mieli zwiększony poziom CRP w porównaniu z pacjentami bez chorób współistniejących. Zwiększone ogólnoustrojowe zapalenie w POChP z chorobami układu sercowo-naczyniowego przemawia za patofizjologicznym mechanizmem między POChP a tymi chorobami współistniejącymi.
Zależność między CAT a ogólnoustrojowym zapaleniem nie została wyjaśniona w dotychczas przeprowadzonych badaniach. W jednym z badań wykazano istotną korelację między LCN1, LCN2 i CAT.8 W naszym badaniu wykazano istotną zależność między CAT i CRP. Nie udało się jednak wykazać podobnej korelacji z TNF-α i IL-6.
W niniejszym badaniu chorych na POChP podzielono na cztery grupy (A-D) i etapy (1-4) według starej i nowej wersji klasyfikacji GOLD. Można zauważyć, że stadium 1 i stadium 4 stanowią najmniejszy odsetek populacji – po 10% według starej klasyfikacji. W nowej wersji populacja była podzielona prawie równo między grupy A, B i D; najmniejszy rozkład dotyczył grupy C. W innych badaniach również wykazano, że grupa C stanowi najmniejszy odsetek rozkładu.24,25 Nowa klasyfikacja wskazuje, że mogą istnieć chorzy z licznymi objawami, ale łagodną obturacją dróg oddechowych, jak również chorzy z niewielką liczbą objawów, ale z ciężką obturacją dróg oddechowych. Choroby współistniejące i ogólnoustrojowy stan zapalny mogą prowadzić do nasilenia zaostrzeń i objawów u pacjentów z łagodną/umiarkowaną obturacją i w ten sposób powodują, że pacjenci ci są umieszczani w grupach wysokiego ryzyka (klasa C lub D). W jednym z badań wykazano, że podtyp C obejmuje pacjentów z wyższym stanem chorobowości, a podtyp D obejmuje pacjentów z najcięższymi zaostrzeniami, wysokim odsetkiem zaostrzeń związanych z hospitalizacją i najgorszymi wynikami leczenia.26 W ostatnim badaniu Agustí i wsp. porównali dwie grupy z i bez przetrwałego systemowego zapalenia i wykazali, że pacjenci z przetrwałym zapaleniem w trakcie obserwacji mieli zwiększony wskaźnik zaostrzeń na rok w porównaniu z drugą grupą, chociaż nieprawidłowości płucne były podobne w tych dwóch grupach.7
GOLD zaleca stosowanie skali CAT lub mMRC do oceny objawów. Do przypisania do grupy użyliśmy skali mMRC, ponieważ gdy rozpatrywaliśmy objawy na podstawie CAT, liczba pacjentów z mniej niż 10 punktami załamania była bardzo mała (8 pacjentów). Wyższe wyniki CAT mogą być związane z wyższą percepcją objawów przez pacjentów. Wykazano również, że CAT i mMRC nie są równoważne, co może powodować pewne różnice w klasyfikacji.24,25,27 W nowej klasyfikacji pozostałe punkty odcięcia składają się z liczby zaostrzeń w ciągu roku. Wykazano związek między podstawową punktacją CAT a częstością zaostrzeń u chorych na POChP.28 Pothirat i wsp. wykazali, że zmiana punktacji CAT podczas wizyt kontrolnych jest użytecznym narzędziem do wykrywania ostrego pogorszenia stanu zdrowia chorych na POChP.29 W naszym badaniu zaobserwowano silny związek między CAT, mMRC i częstością zaostrzeń. Stwierdzono, że CAT koreluje również z czasem trwania choroby i paleniem tytoniu (pack-year). Średnia FEV1 pacjentów wynosiła 48,8% wartości przewidywanej, a średni wynik CAT – 22,6. Wykazano silny związek między CAT a FEV1, FVC i stopniem spirometrycznym GOLD. Wraz z obniżeniem FEV1 i FVC wzrastała punktacja CAT. Wynik CAT korelował również dodatnio z cięższym stopniem zaawansowania GOLD. Wyniki te wskazują, że CAT bardzo dobrze odzwierciedla ciężkość choroby.
Innym ważnym elementem postępowania w POChP jest jakość życia. Do oceny wpływu choroby na życie codzienne stosowano wiele różnych kwestionariuszy życiowych. Rzetelność i ważność tureckiej wersji SGRQ została udowodniona.30 W kilku badaniach wykazano istotną korelację między CAT i SGRQ.3,4 W jednym z badań stwierdzono, że CAT jest wrażliwy na zmiany stanu zdrowia związane z zaostrzeniami POChP.31 W naszym badaniu wykazano silną zależność między CAT i SGRQ. Ponieważ CAT, w porównaniu z SGRQ, jest krótszym i łatwiejszym do zrozumienia testem, stosowanie CAT jest bardziej praktyczne.
Prezentowane badanie ma kilka ograniczeń, takich jak projekt przekrojowy, badanie w jednym ośrodku i mała liczebność próby. Ponadto markery zapalenia nie mogły być porównywane u palaczy, którzy mają prawidłową czynność płuc, ponieważ nie byli oni włączeni do obecnego badania. Leki stosowane przez pacjentów mogą wywierać wpływ na ogólnoustrojową odpowiedź zapalną oraz stan zdrowia i mogą również wpływać na wyniki.
Podsumowując, CAT jest testem, który może być stosowany w ocenie POChP, ponieważ jego wiarygodność i ważność zostały wyraźnie wykazane. Wyniki naszego badania wskazują na związek CAT z CRP, jak również z innymi składowymi POChP (parametry kliniczne, czynnościowe). Wymagane są jednak wieloośrodkowe badania podłużne, aby ocenić związek między CAT a biomarkerami.
Ujawnienia etyczneOchrona ludzi i zwierząt
Autorzy oświadczają, że na potrzeby tego badania nie przeprowadzano żadnych eksperymentów na ludziach ani zwierzętach.
Prawo do prywatności i świadoma zgoda
Autorzy uzyskali pisemną świadomą zgodę pacjentów lub podmiotów wymienionych w artykule. Odpowiadający autor jest w posiadaniu tego dokumentu.
Autorstwo
Projekt badania: NS, FE i AAH; Zbieranie danych: NS, CB; Analiza i interpretacja danych: NS, AAH i CB; Krytyczna korekta manuskryptu: NS, FE, CB i AAH.
Konflikt interesów
Autorzy oświadczają, że nie mają konfliktu interesów w przygotowaniu tego manuskryptu.
.
