


Dzięki terapii anty-VEGF pacjenci z neowaskularnym zwyrodnieniem plamki związanym z wiekiem zwykle uzyskują znaczącą poprawę ostrości wzroku i jakości życia. Podczas gdy krótkoterminowe wyniki nie są niczym innym jak spektakularnym, pozostaje kilka ważnych pytań dotyczących długoterminowego postępowania z tymi pacjentami. Należą do nich:
- Który środek jest najlepszy?
- Jak często należy leczyć?
- Czy długotrwałe dawkowanie tych środków powoduje utratę i uszkodzenie wzroku?
- Czy na horyzoncie są nowe platformy do długotrwałego podawania tych środków?
- W niniejszym artykule udzielono odpowiedzi na te pytania na podstawie wyników kluczowych badań klinicznych.
Czy wszystkie leki anty-VEGF są takie same? Jak często powinniśmy leczyć?
W 2006 roku w przełomowych badaniach ANCHOR i MARINA wykazano skuteczność i bezpieczeństwo stosowania ranibizumabu (Lucentis, Roche/Genentech) w comiesięcznym dawkowaniu. Pacjenci zyskali odpowiednio 10,7 i 6,6 litery w ciągu dwóch lat.1-2 Następnie w równoległych badaniach VIEW1 i VIEW2 wykazano średnią poprawę widzenia w ciągu dwóch lat przy zastosowaniu afliberceptu (Eylea, Regeneron Pharmaceuticals) w odstępach 8 tygodni po trzech początkowych miesięcznych dawkach obciążających.3
Kolejne badania pozwoliły na ocenę skuteczności tych leków przy zastosowaniu mniejszej częstotliwości dawkowania, w tym schematów kwartalnych, pro re nata (PRN) oraz treat-and-extend. W badaniu PIER badano kwartalne dawkowanie ranibizumabu po trzech comiesięcznych dawkach obciążających i, choć lepsze od obserwacji, pacjenci badania PIER stracili 2,3 litery od linii podstawowej w ciągu jednego roku.4
Jednym z najwcześniejszych wyjątków było badanie PrONTO, badanie I/II fazy, w którym oceniano 40 pacjentów przez dwa lata, stosując comiesięczne monitorowanie i rekonwalescencję PRN na podstawie parametrów ostrości wzroku, badania klinicznego i optycznej koherentnej tomografii.5 Wyniki ostrości wzroku zbliżyły się do wyników badań ANCHOR i MARINA przy prawie o połowę mniejszej liczbie wstrzyknięć, ale w badaniu tym brakowało ramienia kontrolnego z comiesięcznym leczeniem. Wyniki te nie zostały powtórzone w kolejnych badaniach PRN.
W badaniu HARBOR porównywano miesięczne i PRN dawkowanie ranibizumabu. Grupa przyjmująca co miesiąc 0,5 mg zyskała 9,1 litery w ciągu 24 miesięcy w porównaniu z 7,9 litery w grupie PRN. Chociaż różnica ta nie była istotna statystycznie, mediana liczby wstrzyknięć (ale nie liczby wizyt) została zmniejszona z 21,4 do 13,3.6
CATT i IVAN były podobnymi badaniami, w których porównywano miesięczne i PRN dawkowanie ranibizumabu i stosowanego off-label bevacizumabu (Avastin, Roche/Genentech). W ciągu dwóch lat dawkowanie PRN okazało się nie gorsze niż leczenie miesięczne w obu badaniach (z wyjątkiem bevacizumabu PRN w badaniu CATT), chociaż zaobserwowano trend w kierunku lepszego widzenia w grupach stosujących leczenie miesięczne.7,8
TREX porównywał comiesięczne podawanie ranibizumabu ze schematem treat-and-extend (T&E).9 Po raz kolejny różnica w ostrości wzroku nie była istotna statystycznie (10,5 w grupie comiesięcznej i 8,7 w grupie T&E), ale wykazywała tendencję w kierunku lepszego widzenia w grupie comiesięcznej. Średnia liczba wstrzyknięć wyniosła 25,5 vs. 18,6 w ciągu dwóch lat. Ponadto żaden z pacjentów z kohorty miesięcznej nie stracił więcej niż 2 litery, podczas gdy pięciu pacjentów z grupy T&E straciło co najmniej 3 linie widzenia.
Pomimo że badania te wykazały statystycznie podobne wyniki przy miesięcznym dawkowaniu w krótkim okresie, wyniki danych bezwzględnych były prawie jednogłośnie lepsze przy miesięcznym dawkowaniu środków anty-VEGF.
Co się dzieje po dwóch latach?
Dane z tych badań klinicznych po upływie dwóch lat nie są tak łatwe do interpretacji i zastosowania jak dane z badań klinicznych, przede wszystkim dlatego, że w tych badaniach przedłużających oceniano głównie długoterminowe bezpieczeństwo leku. Tak więc, obserwacja i harmonogramy leczenia nie były tak rygorystyczne.

HORIZON był badaniem przedłużającym dla pacjentów z badań MARINA, ANCHOR i FOCUS. Pacjenci ci nie stosowali się do protokołu; otrzymywali leczenie według uznania badaczy podczas wizyt oceniających co trzy do sześciu miesięcy. Po czterech latach pacjenci z badania HORIZON zasadniczo utracili początkowy przyrost VA i powrócili do poziomu widzenia wyjściowego (-0,1 litery).10 Dalsza analiza danych wykazała związek między lepszym widzeniem a większą liczbą wstrzyknięć.
W pięcioletnim badaniu CATT oceniano pacjentów monitorowanych i leczonych według uznania badaczy po pierwszych dwóch latach badania. Średnio pacjenci stracili 3 litery w porównaniu z wizją wyjściową. Pacjentów widziano średnio osiem razy w roku i poddawano średnio pięciu zabiegom rocznie.11 Wywiązała się dyskusja, czy utrata wzroku wynikała z niedoleczenia, czy z rozwoju zaniku plamki żółtej, ale badanie nie miało odpowiedniej mocy, aby wyjaśnić tę różnicę.12
Przedłużenie badania VIEW 1 bardziej rygorystycznie monitorowało pacjentów. Uczestnicy otrzymywali dawki w stałych odstępach >q8 tygodni, ale mogli otrzymywać częstsze leczenie, jeśli spełniali wstępnie określone kryteria. W tym rozszerzeniu pacjenci zachowali znacznie lepsze widzenie, ze średnim wzrostem widzenia o 7,1 litery od linii podstawowej (w porównaniu z 10,4-literowym wzrostem w jednorocznym pierwotnym punkcie końcowym).13
Co dzieje się w dłuższej perspektywie i czy częstotliwość dawkowania ma znaczenie?

Najlepsze długoterminowe dane, jakimi dysponujemy, pochodzą z badań obserwacyjnych. Badanie SEVEN-UP było rozszerzeniem badań nad ranibizumabem. Chociaż nie było wstępnie ustalonego harmonogramu wizyt ani protokołu wstrzyknięć, dane dostarczają pewnych informacji. W ciągu siedmiu lat pacjenci stracili średnio 8,6 litery w stosunku do wartości wyjściowej. Pacjenci nieotrzymujący zastrzyków w ciągu kolejnych trzech lat stracili 8,7 liter od linii podstawowej; pacjenci otrzymujący od jednego do pięciu zastrzyków stracili 10,8 liter; pacjenci otrzymujący od sześciu do 10 zastrzyków stracili 6,9 liter; a pacjenci otrzymujący więcej niż 11 zastrzyków zyskali 3,9 liter od linii podstawowej.14
Grupa Fight Retinal Blindness Study Group z Australii obserwowała pacjentów leczonych anty-VEGF przez siedem lat. Pacjenci ci stracili średnio 2,6 litery od linii podstawowej, otrzymując średnio pięć zastrzyków rocznie po drugim roku, kiedy to zyskali 4 litery od linii podstawowej.15
Wreszcie, badanie FIDO było jednoośrodkowym badaniem obserwacyjnym, w którym stosowano stałe dawki q4-tygodniowe przez pierwsze dwa lata i >q8 tygodni później. Pacjenci ci zyskali 12,1 litery od linii podstawowej (ze szczytowej wartości 16,1 litery w ciągu dwóch lat) przy średnio 10,5 wstrzyknięciach rocznie.16
Centralnym przesłaniem z tych długoterminowych badań obserwacyjnych jest to, że wyraźnie, średnio, więcej wstrzyknięć przekłada się na lepsze widzenie.
Mamy teraz dane 10-letnie
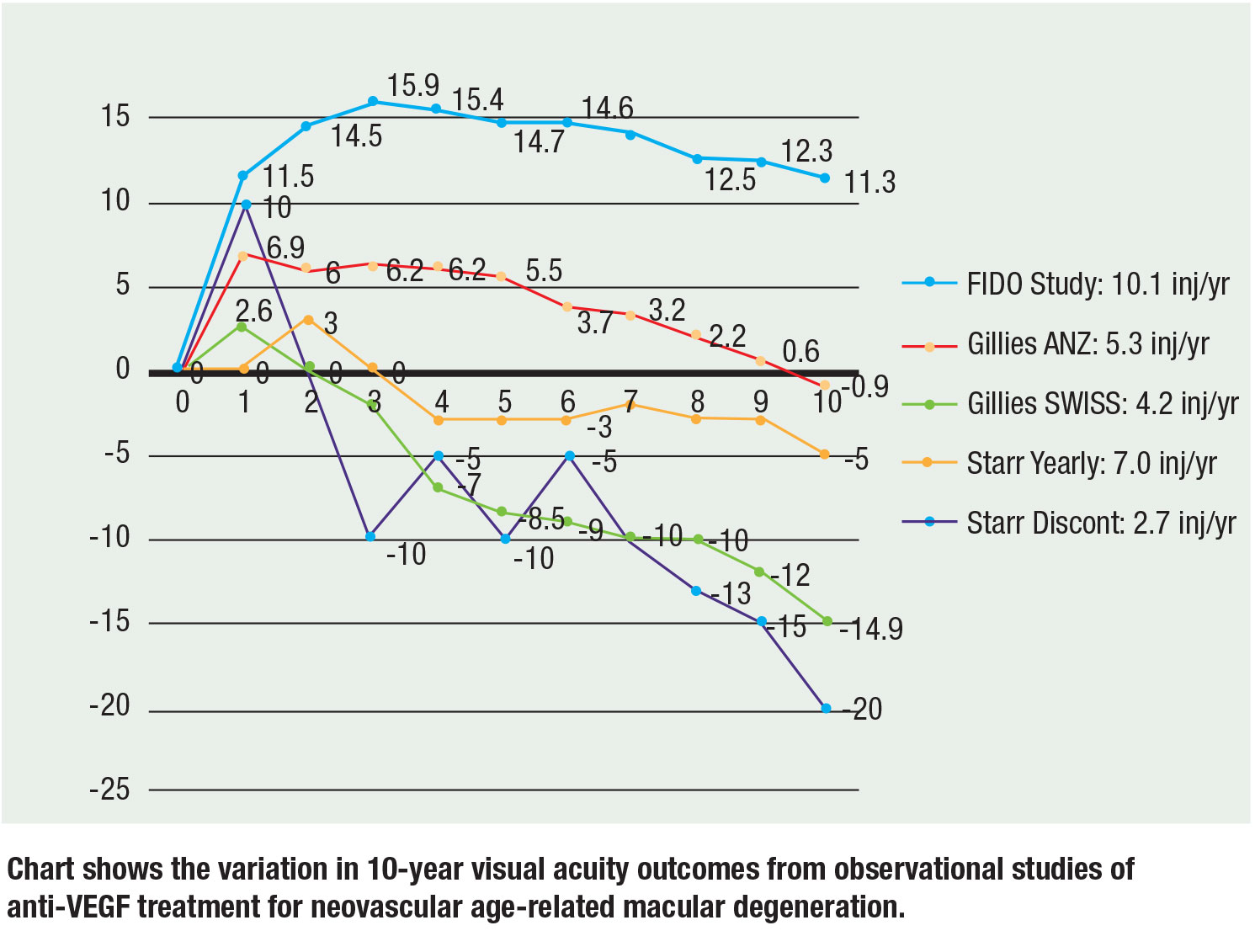
Ostatnio w trzech dużych badaniach obserwacyjnych przedstawiono dane 10-letnie, a wyniki pozostają spójne: Więcej zastrzyków przekłada się na lepszą ostrość widzenia. Mark Gillies, MD, i współpracownicy zrelacjonowali dane obserwacyjne z Australii-Nowej Zelandii i Szwajcarii. U pacjentów z ANZ średnia ostrość wzroku zmniejszyła się o 0,9 litery od linii podstawowej w ciągu 10 lat przy medianie 5,3 wstrzyknięć/rok przy schemacie T&E w porównaniu z pacjentami szwajcarskimi, u których ostrość wzroku zmniejszyła się o średnio 14,9 litery przy medianie 4,2 wstrzyknięć/rok przy schemacie PRN. Ich wniosek był , że ciągłe leczenie i więcej zastrzyków osiągnęło lepszą wizję.17
Matthew Starr, MD, i współpracownicy ocenili kohortę , która zawierała pacjentów , którzy mieli przynajmniej dwa zastrzyki. Pacjenci otrzymywali średnio od pięciu do siedmiu zastrzyków rocznie. Oczy otrzymujące co najmniej jeden zastrzyk rocznie straciły około 7 liter od linii podstawowej, podczas gdy oczy, które nie otrzymywały co najmniej rocznego zastrzyku straciły 15 liter od linii podstawowej.18
Nasza 10-letnia kohorta FIDO osiągnęła średni wzrost widzenia o 11,3 litery ze szczytowej wartości 15,9 przy średniej 10,1 zastrzyków rocznie w okresie badania.19
Ważne jest, aby zauważyć, że istnieje nieodłączne ryzyko z porównaniami między próbami, biorąc pod uwagę różne początkowe ostrości wzroku i populacje pacjentów, ale stoki i trendy trzymają się korelacji większej liczby zastrzyków z lepszą wizją. Na rycinie (strona 29) podsumowano 10-letnie dane z trzech badań.
Czy częste leczenie powoduje progresję do zaniku geograficznego?
Zaniepokojenie progresją zaniku geograficznego przy leczeniu anty-VEGF było przedmiotem troski i często przywoływanym uzasadnieniem dla braku częstego leczenia. Niektóre dowody sugerują, że ryzyko utraty wzroku w wyniku zaniechania leczenia znacznie przewyższa te potencjalne obawy. W badaniu SEVEN-UP wykazano większą częstość występowania GA w oczach współtowarzyszących niż w oczach leczonych anty-VEGF.14
Co więcej, 10-letnie dane z badania FIDO wykazały nieco mniejszą częstość występowania GA z utratą wzroku w ciągu 10 lat w leczonych oczach w porównaniu z nieleczonymi oczami współtowarzyszącymi (15 vs. 19%).19 Prawdopodobnie progresja prawdziwego GA jest niezależna od leczenia anty-VEGF, a to, co jest obserwowane, to wysychanie kompleksu neowaskularnego, które wygląda jak GA, ale ma mniej szkodliwy wpływ na widzenie.
Podsumowanie
Ciągła, regularna terapia lekami anty-VEGF zapewnia doskonałe wyniki w leczeniu mokrej postaci AMD. Długoterminowe dane wskazują, że ryzyko utraty wzroku jest większe w przypadku niedoleczenia niż w przypadku ciągłego leczenia w regularnych odstępach czasu, stosowanego obecnie w schematach z ustalonymi interwałami dawkowania lub konserwatywnych schematach treat-and-extend. Platformy długoterminowego podawania leku, takie jak system port-delivery i terapia genowa, wydają się obiecujące w zmniejszaniu barier związanych z nieprzestrzeganiem zaleceń, obciążeniem związanym z częstymi wizytami i wyzwaniami związanymi ze zmiennymi indywidualnymi wymaganiami dotyczącymi dawkowania. RS
1. Brown DM, Kaiser PK, Michels M, et al. Ranibizumab versus verteporfin for neovascular age-related macular degeneration. N Engl J Med. 2006;355:1432-1444.
2. Rosenfeld PJ, Brown DM, Heier JS, et al. MARINA Study Group, Ranibizumab for neovascular age-related macular degeneration. N Engl J Med. 2006;355:1419-1431.
3. Schmidt-Erfurth U, Kaiser PK, Korobelnik JF, et al. Intravitreal aflibercept injection for neovascular age-related macular degeneration: ninety-six-week results of the VIEW studies. Ophthalmology. 2014;121:193-201.
4. Regillo CD, Brown DM, Abraham P, et al. Randomized, double-masked, sham-controlled trial of ranibizumab for neovascular age-related macular degeneration: PIER Study year 1. Am J Ophthalmol. 2008;145:239-248.
5. Lalwani GA, Rosenfeld PJ, Fung AE, et al. A variable-dosing regimen with intravitreal ranibizumab for neovascular age-related macular degeneration: year 2 of the PrONTO Study. Am J Ophthalmol. 2009;148:43-58.
6. Ho AC, Busbee BG, Regillo CD, et al, for the HARBOR Study Group. Twenty-four-month efficacy and safety of 0.5 or 2.0 mg ranibizumab in patients with subfoveal neovascular age-related macular degeneration. Ophthalmology. 2014;121:2181-2192.
7. Martin DF, Maguire MG, Fine SL, et al, for the Comparison of Age-related Macular Degeneration Treatments Trials (CATT) Research Group. Ranibizumab and bevacizumab for treatment of neovascular age-related macular degeneration: two-year results. Ophthalmology. 2012;119:1388-1398.
8. Chakravarthy U, Harding SP, Rogers CA, et al. Alternative treatments to inhibit VEGF in age-related choroidal neovascularization: 2-year findings of the IVAN randomized control trial. Lancet. 2013;382:1258-1267.
9. Wykoff CC, Ou WC, Brown DM, et al. Randomized trial of treat-and-extend versus monthly dosing for neovascular age-related macular degeneration: 2-year results of the TREX-AMD study. Ophthalmol Retina. 2017;1:314-321.
10. Singer MA, Awh CC, Sadda S, et al. HORIZON: An open-label extension trial of ranibizumab for choroidal neovascularization secondary to age-related macular degeneration. Ophthalmology. 2012;119:1175-1183.
11. Maguire MG, Martin DF, Ying GS, et al. Five-year outcomes with anti-vascular endothelial growth factor treatment of neovascular age-related macular degeneration: The comparison of age-related macular degeneration treatments trials. Ophthalmology. 2016;123:1751-1761.
12. Grunwald JE, Pistilli M, Ying GS, et al. Growth of geographic atrophy in the comparison of age-related macular degeneration treatments trials. Ophthalmology. 2015;122:809-816.
13. Kaiser PK, Singer M, Tolentino M, et al. Long-term safety and visual outcome of intravitreal aflibercept in neovascular age-related macular degeneration. Ophthalmol Retina. 2017;1:304-313.
14. Rofagha S, Bhisitkul RB, Boyer DS, Sadda SR, Zhang K, for the SEVEN-UP Study Group. et al. Seven-year outcomes in ranibizumab-treated patients in ANCHOR, MARINA, and HORIZON: A multicenter cohort study (SEVEN-UP). Ophthalmology. 2013;120:2292-2299.
15. Gillies MC, Campain A, Barthelmes D, et al, for the Fight Retinal Blindness Study Group. Long-term outcomes of treatment of neovascular age-related macular degeneration: Data from an observational study. Ophthalmology. 2015;122:1837-1845.
16. Peden MC, Suñer IJ, Hammer ME, Grizzard WS. Long-term outcomes in eyes receiving fixed-interval dosing of anti-vascular endothelial growth factor agents for wet age-related macular degeneration. Ophthalmology. 2015;122:803-808.
17. Gillies M, Arnold J, Bhandari S, et al. Ten-year outcomes of neovascular age-related macular degeneration from two regions. Am J Ophthalmol. 2020;210:116-124.
18. Starr MR, Kung FF, Bui YT, et al. Ten-year follow-up of patients with exudative age-related macular degeneration treated with intravitreal anti-vascular endothelial growth factor injections. Retina. Published online November 13, 2019.
19. Suñer IJ, Peden MC, Hammer ME, Grizzard WS. Ten-year outcomes in eyes receiving fixed-interval dosing of anti-vascular endothelial growth factor agents for wet age-related macular degeneration. Paper presented at Retina Society 2019; September 12, 2019; London, U.K.
20. Campochiaro PA, Marcus DM, Awh CC, et al. The port delivery system with ranibizumab for neovascular age-related macular degeneration: results from the randomized phase 2 LADDER clinical trial. Ophthalmology. 2019;126:1141-1154.
21. Ho AC; the Janssen/ORBIT Study Group. Programy precyzyjnego dostarczania dla terapii komórkowej i genowej. Referat przedstawiony na: Vail Vitrectomy Meeting; February 10, 2019; Vail, CO.
22. ADVM-022 terapia genowa w mokrej postaci AMD (OPTIC). Sponsor: Adverum Biotechnologies. ClinicalTrials.gov Identyfikator: NCT03748784. Dostępne na: https://clinicaltrials.gov/ct2/show/NCT03748784. Dostęp 18 kwietnia 2020 r.
23. RegenxBio zgłasza wyniki finansowe i operacyjne za pierwszy kwartał 2019 r. oraz dodatkową pozytywną aktualizację śródokresowego badania fazy I/IIa dla RGX-314 w leczeniu mokrej postaci AMD . Rockville, MD; 7 maja 2019 r. https://www.prnewswire.com/news-releases/regenxbio-reports-first-quarter-2019-financial-and-operating-results-and-additional-positive-interim-phase-iiia-trial-update-for-rgx-314-for-the-treatment-of-wet-amd-300845423.html Dostęp 9 lipca 2020 r.
.
