Zespół majaczenia podnieconego jest częstym, aczkolwiek słabo scharakteryzowanym objawem występującym w ED, z szeroką diagnostyką różnicową. Pacjenci są często początkowo identyfikowani przez organy ścigania, ale próby kontrolowania osób doświadczających zespołu majaczeniowego za pomocą fizycznych, chemicznych lub elektrycznych środków obezwładniających wiążą się z bardzo wysokim wskaźnikiem zachorowalności i śmiertelności.
Przypadek
25-letni mężczyzna zgłasza się do izby przyjęć przywieziony przez EMS z powodu zmienionego stanu psychicznego (AMS). Przed przybyciem ratownicy medyczni przekazali przez radio raport, w którym stwierdzili, że pacjent był pobudzony, zachowywał się agresywnie, a następnie wspiął się na maskę karetki. Zauważono, że był bardzo silny i trudny do powstrzymania. Sanitariusze podali domięśniowo 5 mg midazolamu i byli w stanie fizycznie go unieruchomić, ale po przybyciu na miejsce pacjent pozostaje skrajnie pobudzony, krzyczy i uderza o listwy boczne noszy. Nie odpowiada na żadne pytania, a jego mowa jest bezsensowna. W badaniu przedmiotowym pacjent jest wyraźnie drżący, gorący w dotyku, z drgawkami mioklonicznymi i bruksizmem. Na brzuchu, klatce piersiowej i kończynach widoczne są rozległe powierzchowne otarcia. Jest zbyt pobudzony, aby uzyskać wstępne dane życiowe. Jakie są Twoje następne kroki?
Tło
Zespół majaczenia podnieconego (ExDS) jest częstą, ale słabo scharakteryzowaną postacią w ED z szeroką diagnostyką różnicową. Opisywany w literaturze od ponad 100 lat,1 hipotezuje się, że wiąże się on z nadmiarem katecholaminergicznym obejmującym endogenne katecholaminy związane ze stresem, egzogenne leki katecholaminergiczne,2 i/lub nadmierną stymulację receptorów dopaminowych i glutaminianowych NMDA w otoczeniu chorób psychiatrycznych lub organicznych. Przyczyny można podzielić na metaboliczne/endokrynologiczne, neurologiczne, infekcyjne, toksykologiczne i psychiatryczne (tab. 1).
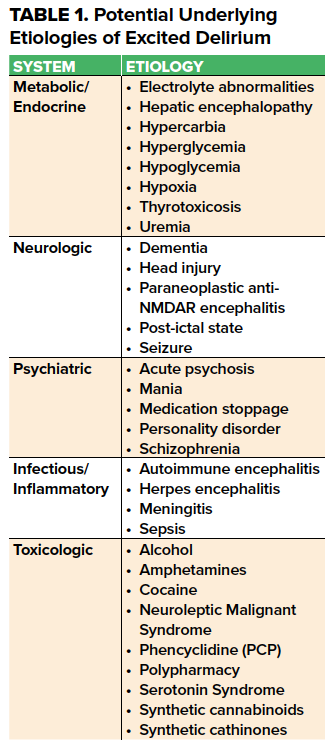
Najczęstsze wśród nich jest jednoczesne występowanie ostrego zatrucia lekami, zwłaszcza sympatykomimetykami, i choroby psychicznej z cechami psychotycznymi w wywiadzie. Częstość występowania ExDS jest bardzo zróżnicowana, przy czym wzrost częstości występowania w latach 80. ubiegłego wieku3 był związany z częstszym używaniem kokainy,4 amfetamin i fencyklidyny. Ostatnio w grę wchodzą także syntetyczne katynony i kannabinoidy.5,6
Pacjenci są często początkowo identyfikowani przez organy ścigania. Interwencje organów ścigania mające na celu kontrolowanie osób doświadczających ExDS za pomocą fizycznych, chemicznych lub elektrycznych środków obezwładniających wiążą się z niezwykle wysokim wskaźnikiem zachorowalności i śmiertelności; ExDS jest przyczyną ponad 3% interwencji policyjnych obejmujących użycie siły, wiąże się z ponad 10% zgonów w areszcie policyjnym, a 38%-86% zgonów związanych z ExDS miało miejsce w areszcie policyjnym, w szczególności w związku z policyjnymi metodami przymusu i/lub asfiksją pozycyjną.2
Samo w sobie, ExDS niesie ze sobą bardzo wysokie ryzyko śmiertelności, z około 2/3 pacjentów z ExDS umierających w warunkach przedszpitalnych7 przy braku poważnych urazów, przymusu fizycznego lub interwencji policji. Śmiertelność jest najsilniej związana z depresją oddechową, ciężką hipertermią, kwasicą lub ich kombinacją.8 Spośród tych czynników głęboka hipertermia ma najsilniejszy związek ze śmiertelnością:9 ekstremalna temperatura rdzenia może zmienić przepuszczalność bariery krew-mózg, przyczynić się do nieprawidłowego funkcjonowania lub degradacji białek i nasilić neurotoksyczność wywołaną glutaminianem.10
Diagnoza różnicowa
Do tej pory nie ma powszechnie uznanej definicji ExDS. Pierwotny opis powstał na podstawie pośmiertnej identyfikacji opartej na historii i był terminem obejmującym, używanym w wielu medycznych i prawnych środowiskach. W Białej Księdze z 2009 roku, American College of Emergency Physicians opisał ExDS jako podzbiór AMS i zalecił, aby pomimo niejasności jednostki klinicznej, istotne cechy wywiadu były połączone z diagnostyką różnicową dla wspólnych przyczyn AMS w celu opisania prezentacji. ExDS został opisany jako „zespół o niepewnej etiologii charakteryzujący się delirium, pobudzeniem i hiperadrenergiczną dysfunkcją autonomiczną”, z „charakterystycznymi objawami dziwacznego i agresywnego zachowania, krzyku, paranoi, paniki, przemocy wobec innych, nieoczekiwanej siły fizycznej i hipertermii „1. Pacjenci z ExDS zwykle prezentują dowolną kombinację pobudzenia, zwiększonej tolerancji bólu, tachypatii i diaforezy; pacjenci ci mają skłonność do rozwoju ciężkiej kwasicy z progresją do nagłego zatrzymania krążenia.11 Wspólne cechy zespołu i częste pokrywanie się z innymi schorzeniami wymagają zbadania innych przyczyn, jak podano w tabeli 1.
Zarządzanie
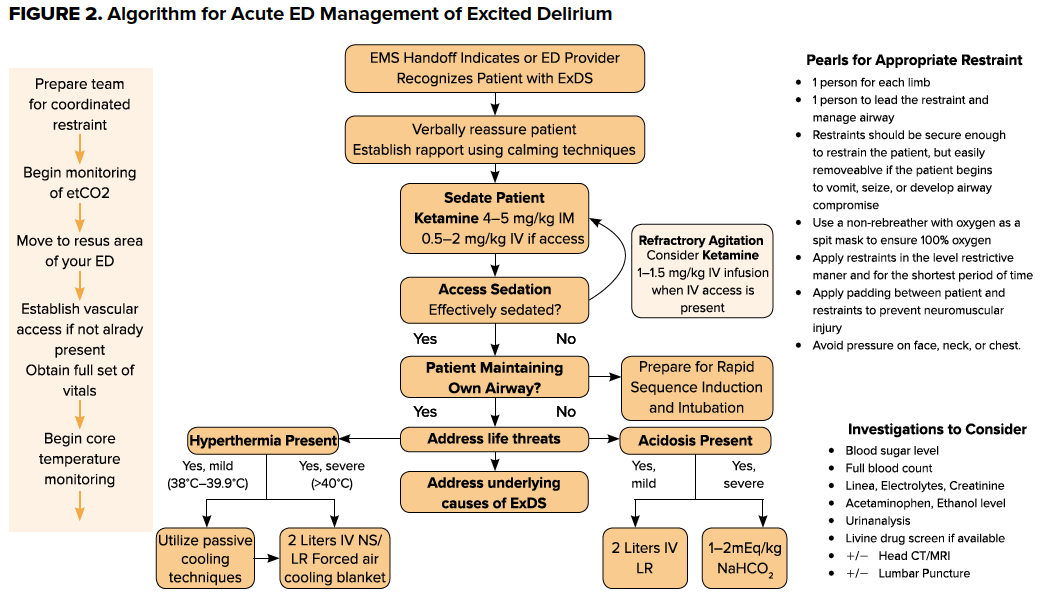
Zarządzanie jest dostosowane do prezentacji pacjenta i powinno być skoncentrowane na 4 filarach opieki opartej na dowodach naukowych: kontroli pobudzenia, korekcji hipertermii, unikaniu kwasicy i badaniu podstawowej etiologii (tabela 1).
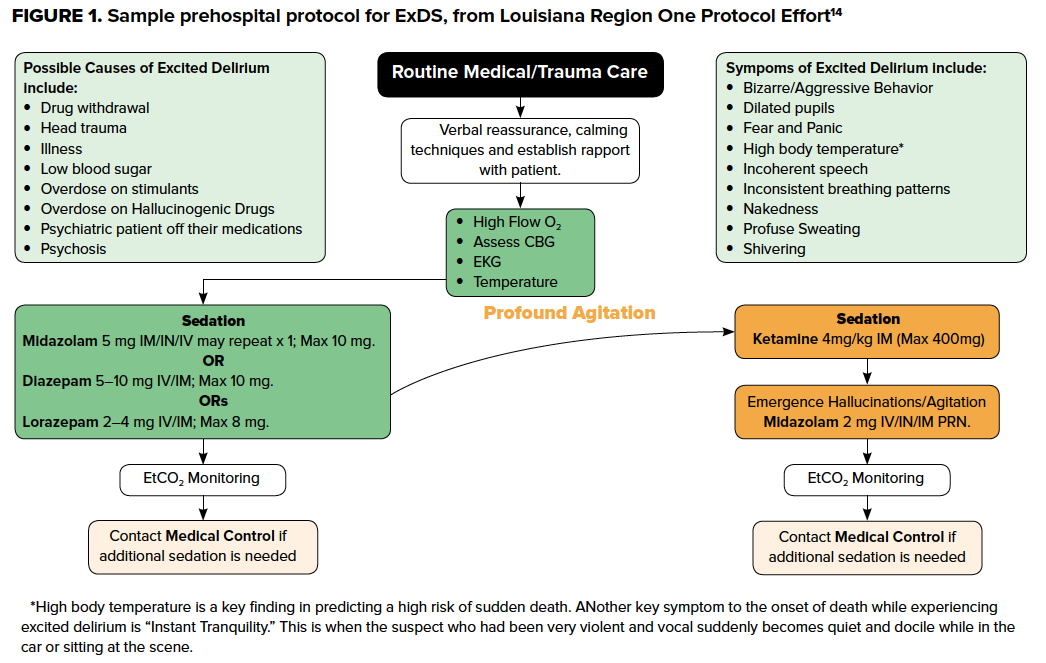
Ponieważ asfiksja pozycyjna, depresja oddechowa, ciężka hipertermia, kwasica i/lub śmiertelne zaburzenia rytmu serca wywołane przez katecholaminy12 mogą poprzedzić zapaść sercowo-naczyniową, należy im zapobiegać i agresywnie nimi zarządzać. Filary te są prawdziwe zarówno w warunkach przedszpitalnych, jak i w ED, ponieważ szybkie rozpoznanie i celowe, odpowiednie leczenie przez ratowników przedszpitalnych może zmniejszyć szkody i zapobiec złym wynikom. Wiele agencji EMS posiada specjalne protokoły postępowania w przypadku ExDS, często podkreślające prymat bezpiecznego ułożenia i szybkiej sedacji benzodiazepinami i/lub ketaminą. Jeśli nie jest to wyraźnie określone w protokole, ratownicy przedszpitalni powinni nadać priorytet tym metodom w praktyce, uznając, że pacjenci z ExDS są lub mogą stać się bardzo szybko krytycznie chorzy. Wczesna identyfikacja przez personel EMS może zmniejszyć ryzyko nagłej śmierci, zaalarmować przyjmujący personel ED i pomóc ekspertom medycznym w lepszym zrozumieniu prezentacji i określeniu prawdopodobieństwa, że pacjent doświadczał ExDS.13
Kontrola pobudzenia
Konsensusowe zalecenia dotyczące farmakologicznego postępowania w AMS to leczenie najpierw podstawowej etiologii, a następnie zajęcie się objawami behawioralnymi. Jednak charakterystyczną cechą ExDS jest niebezpiecznie pobudzony stan, który prawie zawsze wymaga sedacji.2 Silne pobudzenie może uniemożliwić dostęp do kroplówki lub wykonanie badań laboratoryjnych na wczesnym etapie spotkania z pacjentem. W związku z tym, początkowym celem u niezróżnicowanego pacjenta z ExDS powinno być szybkie i skuteczne zastosowanie sedacji przy jednoczesnym unieruchomieniu pacjenta w bezpiecznej pozycji. W następstwie wielu zgonów wewnątrzszpitalnych pacjentów umieszczonych w urządzeniach przytrzymujących, Joint Commission i wiele polityk szpitalnych opracowało szczegółowe wymagania dotyczące bezpiecznego stosowania urządzeń do krępowania fizycznego. Obejmują one częstą, bezpośrednią ocenę konieczności krępowania przez świadczeniodawcę w celu zminimalizowania czasu krępowania mechanicznego. Ważne zasady przy krępowaniu pacjenta obejmują unikanie ucisku na twarz, szyję i klatkę piersiową, co może prowadzić do uduszenia, kwasicy oddechowej lub metabolicznej i śmierci. Podobnie, ExDS może być wtórne do niedotlenienia, dlatego preferowane jest założenie aparatu oddechowego ze 100% tlenem, który pełni funkcję maski przeciwoddechowej. Dodatkowo, często konieczne jest zastosowanie 4- lub 5-punktowego unieruchomienia, układając pacjenta w pozycji leżącej na plecach z wezgłowiem łóżka uniesionym pod kątem 30° i unieruchamiając jedno ramię pacjenta powyżej głowy, a drugie poniżej talii.
Podczas gdy tradycyjne metody farmakologicznego leczenia pobudzenia obejmują benzodiazepiny (szczególnie lorazepam i midazolam), leki przeciwhistaminowe, takie jak difenhydramina, i leki przeciwpsychotyczne, istnieje wiele wad tych leków u pacjentów z ExDS (Tabela 2). Ponieważ progresja do zapaści sercowo-naczyniowej jest w największym stopniu związana z hipertermią, depresją oddechową i kwasicą, farmakologiczne wybory w sedacji pacjentów z ExDS powinny uzupełniać wysiłki mające na celu przeciwdziałanie tym zmianom fizjologii, a nie pogarszać je. W ostatnich latach krajowe niedobory dożylnego diazepamu i lorazepamu15 oraz przewaga dowodów i preferencji świadczeniodawców zachęciły do stosowania ketaminy w sedacji pacjentów z ExDS, a typowe zakresy dawkowania przedstawiono w tabeli 2. Względna swoboda zarówno w obliczaniu, jak i sposobie dawkowania, szybki początek działania i łatwość przejścia od sedacji do indukcji i intubacji w sekwencji opóźnionej lub szybkiej sprawiają, że ketamina jest dobrym wyborem u pacjentów z ExDS z dostępem do kroplówki lub bez.16 Inną zaletą ketaminy jest fakt, że zachowuje ona odruchy oddechowe pacjenta, umożliwiając mu kontynuację spontanicznego oddychania. Chociaż większość pacjentów poddanych sedacji ketaminą nie wymaga agresywnego leczenia dróg oddechowych, u wszystkich pacjentów z ExDS leczonych ketaminą należy zwracać uwagę na drogi oddechowe pacjenta, a także monitorować sedację proceduralną.
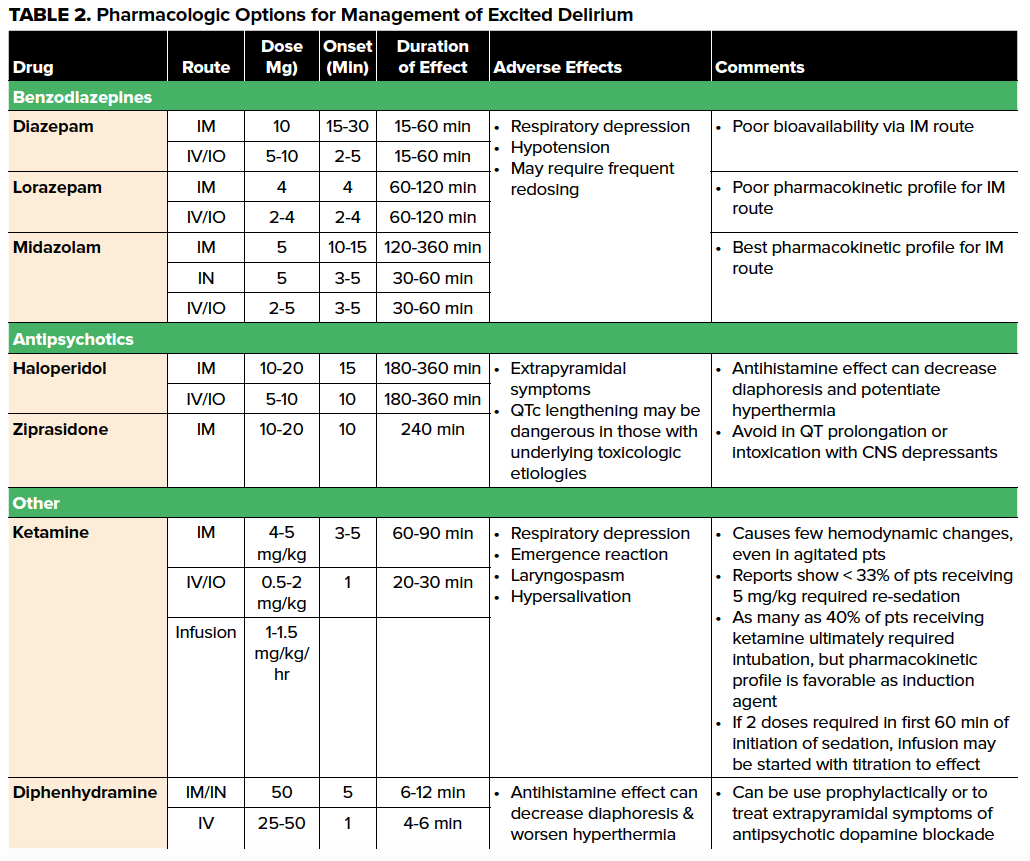
Korekcja hipertermii
Zarządzanie hipertermią jest ważnym elementem postępowania w ExDS i powinno być rozpoczęte natychmiast po opanowaniu pobudzenia. Zarządzanie temperaturą w ExDS jest podobne do tego w warunkach hipertermii środowiskowej i może obejmować zdjęcie odzieży, pasywne chłodzenie zewnętrzne, systemy koców chłodzących z wymuszonym obiegiem powietrza i zimne płyny infuzyjne.
Unikanie kwasicy
Unikanie kwasicy jest ważne i może być wtórne do różnych czynników etiologicznych, w tym hipoperfuzji, rabdomiolizy i depresji oddechowej. W ramach wstępnych badań należy wykonać oznaczenie gazów w krwi żylnej lub tętniczej w celu oceny podstawowych zaburzeń kwasowo-zasadowych. Postępowanie powinno być ukierunkowane na podstawową patologię i może obejmować dożylną resuscytację płynami lub wspomaganie oddychania. W przypadku pacjenta z ExDS, u którego zastosowano sedację, w tym ketaminę, konieczne jest monitorowanie end-tidal CO2 (etCO2) w celu monitorowania częstości, głębokości i adekwatności oddychania.
Dochodzenie do etiologii leżącej u podstaw choroby
Po ustabilizowaniu stanu pacjenta i podaniu leków uspokajających, badania powinny być prowadzone na podstawie badania fizykalnego i wywiadu. Pełne badanie fizykalne jest krytyczne – pacjenci z ExDS mogą mieć znaczące obrażenia, a próby powstrzymania mogą pogorszyć istniejące wcześniej urazy. Wstępne badania powinny obejmować oznaczenie stężenia glukozy we krwi, morfologię krwi, BMP i badania toksykologiczne dla wszystkich osób współistniejących. Należy rozważyć oznaczenie CPK, jeśli istnieje podejrzenie rabdomiolizy, posiewy krwi i/lub punkcję, jeśli istnieje podejrzenie sepsy i/lub septycznego zapalenia opon mózgowych. Obrazowanie może być wykonane w celu zbadania wszelkich potencjalnych urazów.
Zakończenie sprawy
Po przeniesieniu na nosze ED, pacjent został umieszczony w 4-punktowych miękkich urządzeniach przytrzymujących z urządzeniem nieoddychającym i 100% tlenem z pomocą ochrony szpitala; podano 5 mg/kg ketaminy IM, ze znacznym zmniejszeniem pobudzenia. Pacjentowi założono etCO2 i przewieziono do sali reanimacyjnej w celu dokładnego monitorowania. Stwierdzono tachykardię z tętnem 150, nadciśnienie 150/94, hipertermię 39,6° C. W badaniu end-tidal stwierdzono 38 mmHg CO2 i 20 oddechów/minutę. Badania nie wykazały żadnych nieprawidłowości. Przyłożono zimne okłady na pachy i pachwiny oraz podano dożylnie 2 L schłodzonego laktowanego Ringera, uzyskując poprawę temperatury.
Na podstawie badania fizykalnego i wywiadu stwierdzono delirium podniecenia wtórne do nieznanego środka sympatykomimetycznego o właściwościach halucynogennych, a pacjent został przyjęty na oddział intensywnej terapii z opieką wspomagającą.
Delirium pobudzenia u pacjenta ustąpiło w 2. dobie hospitalizacji i został on przeniesiony do psychiatrii stacjonarnej w celu dalszej obserwacji. Został wypisany w 4. dobie ze skierowaniem do psychiatrii i wsparciem w zakresie przyjmowania leków.
1. Mash D. Excited Delirium and Sudden Death: A Syndromal Disorder at the Extreme End of the Neuropsychiatric Continuum. Front Physiol. 2016;7:435.
2. Gonin P, Beysard N, Yersin B, Carron PN. Ekscytujące delirium: przegląd systematyczny. Acad Emerg Med. 2018;25(5):552-565.
3. Vilke GM, DeBard ML, Chan TC, et al. Excited Delirium Syndrome (ExDS): definiowanie na podstawie przeglądu literatury. J Emerg Med. 2012;43(5):897-905.
4. Wetli CV, Fishbain DA. Cocaine-induced psychosis and sudden death in recreational cocaine users. J Forensic Sci. 1985;30(3):873-880.
5. Atis SE, Yilmaz G, Bozan O, Cekmen B. A Terrifying Drug Threats the Streets: Flakka – A Case Report. J Mol Imag Dynamic. 2018;8(1):142.
6. Prosser JM, Nelson LS. The toxicology of bath salts: a review of synthetic cathinones. J Med Toxicol. 2012;8(1):33-42.
7. Gottlieb M, Long B, Koyfman A. Approach to the Agitated Emergency Department Patient. J Emerg Med. 2018;54(4):447-457.
8. Otahbachi M, Cevik C, Bagdure S, Nugent K. Excited delirium, restraints, and unexpected death: a review of pathogenesis. Am J Forensic Med Pathol. 2010;31(2):107-112.
9. Mash DC. Excited Delirium and Sudden Death: A Syndromal Disorder at the Extreme End of the Neuropsychiatric Continuum. Front Physiol. 2016;7:435.
10. Plush T, Shakespeare W, Jacobs D, Ladi L, Sethi S, Gasperino J. Cocaine-induced agitated delirium: a case report and review. J Intensive Care Med. 2015;30(1):49-57.
11. DeBard ML, Adler J, Bozeman W, Chan T, et al: ACEP Excited Delirium Task Force. White Paper Report on Excited Delirium Syndrome. 2009.
12. Śmierć S. BET 1: Zespół delirium podnieconego i nagła śmierć. Emerg Med J. 2013;30(11):958-960.
13. Vilke GM, Bozeman WP, Dawes DM, Demers G, Wilson MP. Zespół majaczenia podnieconego (ExDS): Treatment options and considerations. J Forensic Leg Med. 2012;19(3):117-121.
14. Miasto Nowy Orlean. Region One Protocol Effort. State of Louisiana. 2013.
15. Tassey T. Skończył się ativan? The Drug Shortage Crisis in the U.S. EM Resident. 2016;43(1):28-29.
16. Mankowitz SL, Regenberg P, Kaldan J, Cole JB. Ketamine for Rapid Sedation of Agitated Patients in the Prehospital and Emergency Department Settings: A Systematic Review and Proportional Meta-Analysis. J Emerg Med. 2018;55(5):670-681.
