Abstract
Jak działa mózg? Tym pytaniem naukowcy interesują się od setek lat. Aby dowiedzieć się, jak działa mózg, naukowcy musieli przeprowadzać wiele eksperymentów i wymyślać sposoby badania i testowania mózgu. W 2005 r. stworzono nową technikę, zwaną optogenetyką. Technika ta wykorzystuje połączenie światła i inżynierii genetycznej (zmiana informacji genetycznej żywej istoty poprzez wstawianie lub usuwanie informacji w kodzie genetycznym) do kontrolowania komórek mózgu. Optogenetyka stała się bardzo popularna i jest obecnie wykorzystywana w laboratoriach badających mózg na całym świecie. Pomaga nam ona odkryć wiele nowych rzeczy na temat mózgu. Tutaj wyjaśniamy, co czyni optogenetykę tak wyjątkową do badania mózgu.
Specjalne komórki w mózgu i układzie nerwowym, zwane neuronami, współpracują ze sobą, aby wytworzyć wszystkie nasze myśli i zachowania. Aby zrozumieć, w jaki sposób mózg kontroluje zachowanie, musimy zrozumieć, w jaki sposób neurony komunikują się ze sobą. Ludzki mózg jest bardzo złożony, ale wiele jego właściwości jest podobnych do tych, które posiadają inne zwierzęta. Oznacza to, że neurobiolodzy (naukowcy zajmujący się badaniem mózgu i układu nerwowego) mogą wykorzystywać proste zwierzęta do odkrywania nowych rzeczy na temat ludzkiego mózgu. W ten sposób odkryto komunikację między neuronami.
How Do Neurons Communicate with Each Other?
Neurons communicate using a combination of electrical and chemical activity. Wcześni naukowcy odkryli to dzięki obserwacjom i sprytnym eksperymentom. Pod koniec 1700 roku, włoski naukowiec Luigi Galvani szedł przez rynek podczas burzy z piorunami. Zobaczył żabie udka na sprzedaż i zauważył, że drgają. Wysunął hipotezę, że elektryczność burzy aktywuje nerwy w żabich udkach. Postanowił sprawdzić tę hipotezę w swoim laboratorium. Galvani użył przedmiotu, który pozwala na przepływ prądu elektrycznego, zwanego elektrodą, aby przepuścić prąd elektryczny do żabiego nerwu. Spowodowało to drganie żabiej nogi. Było to pierwsze badanie stymulacji elektrycznej w neurobiologii. Z tego odkrycia Galvani wywnioskował, że neurony mogą wykorzystywać sygnały elektryczne do przekazywania informacji. To ważne, aby o tym wiedzieć! Teraz, gdy wiemy, jak neurony rozmawiają ze sobą, możemy zacząć mówić ich językiem. Możemy użyć sygnałów elektrycznych, aby włączyć niektóre neurony i zobaczyć, co się stanie dalej. Właśnie to zaczęli robić naukowcy.
Nie było aż do lat trzydziestych XX wieku, że stymulacja elektryczna została użyta do mapowania ludzkiego mózgu. Dr Wilder Penfield, chirurg mózgu, pracował z pacjentami, którzy mieli epilepsję. Epilepsja powoduje nieprawidłowe sygnały elektryczne w mózgu i może być bardzo niebezpieczna. W skrajnych przypadkach, aby powstrzymać padaczkę, konieczna jest operacja mózgu. Dr Penfield chciał zmapować mózgi swoich pacjentów, aby dowiedzieć się, które części mózgu są najważniejsze. Dzięki temu wiedziałby, których obszarów mózgu nie powinien operować. Aby stworzyć mapę mózgu, użył stymulacji elektrycznej, podobnie jak Galvani. Opuścił małą elektrodę do motorycznych (ruchowych) obszarów mózgu. Następnie wysyłał niewielki sygnał elektryczny i obserwował ruchy pacjenta. Stymulacja w jednym obszarze mózgu powodowała drganie palców, podczas gdy stymulacja w nieco innym obszarze mózgu powodowała drganie stóp. To doprowadziło dr Penfielda do uświadomienia sobie, że pewne obszary mózgu kontrolują bardzo specyficzne obszary ciała. Dr Penfield zauważył, że lokalizacja obszarów motorycznych mózgu była podobna u wszystkich jego pacjentów. Stworzył diagramy swoich wyników, które dały nam pierwszą funkcjonalną mapę obszarów motorycznych w ludzkim mózgu. Funkcjonalne mapy dr Penfielda, znane jako homunculus, są nadal używane dzisiaj.
Od lat trzydziestych XX wieku eksperymenty stymulacji mózgu uległy zmianie. Badania stymulacji elektrycznej mają pewne wady. Jednym z problemów jest to, że mózg może zostać uszkodzony, gdy elektroda jest włożona. Innym problemem jest to, że stymulacja elektryczna aktywuje tkanki w bardzo ogólny, nieselektywny sposób (Rysunek 1A). To tak, jakby używać buldożera, gdy wystarczy łopata – buldożer jest skuteczny, ale nie jest zbyt precyzyjny ani ostrożny. W 2005 roku stworzono nową technikę, która pozwala na bardziej precyzyjną stymulację mózgu. Technika ta nazywa się optogenetyką.
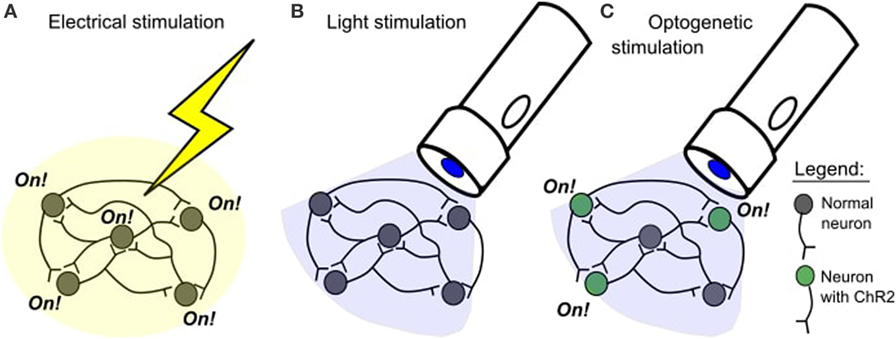
- Rysunek 1
- A. W badaniu stymulacji elektrycznej wszystkie komórki w pobliżu miejsca stymulacji zostaną aktywowane. B. Światło niebieskie nie wpływa normalnie na neurony. C. Światło niebieskie będzie selektywnie aktywować neurony z channelrhodopsin-2 (ChR2).
Co to jest Optogenetyka?
Optogenetyka to metoda kontrolowania aktywności neuronu za pomocą światła i inżynierii genetycznej. Inżynieria genetyczna to proces, w którym naukowcy zmieniają informacje w kodzie genetycznym (blueprints) żywej istoty. W badaniach optogenetycznych naukowcy pobierają kod genetyczny neuronów, które chcą badać, i dodają do niego nowy fragment kodu. Nowy kod umożliwia tym neuronom wytwarzanie specjalnych białek, zwanych opsynami, które reagują na światło. Opsyny występują naturalnie i zostały po raz pierwszy odkryte w algach, które używają tych białek, aby pomóc im poruszać się w kierunku światła. Ale jak opsyna dostaje się do neuronu? Wymaga to pewnych specjalistycznych technik laboratoryjnych. Przyjrzyjmy się myszy jako naszemu przykładowi. Aby wprowadzić opsynę do neuronów myszy, kod genetyczny opsyny musi być starannie wstawiony do kodu genetycznego neuronów myszy. Jeśli zostanie to zrobione prawidłowo, każdy neuron myszy powinien mieć opsynę. Ponieważ dużo wiemy o kodzie genetycznym myszy, możemy wybrać miejsce, w którym umieścimy opsynę. Możemy wprowadzić kod do określonego typu neuronu lub do określonego miejsca w mózgu. Możemy wybrać dokładnie, które neurony chcemy kontrolować.
W neuronauce, najbardziej popularna opsyna nazywa się channelrhodopsin-2 (ChR2). Opsyna ta pochodzi z zielonej algi Chlamydomonas reinhardtii . ChR2 jest aktywowana przez światło niebieskie, co oznacza, że działa tylko wtedy, gdy świeci na nią światło niebieskie i nie reaguje na inne rodzaje światła. Kiedy ChR2 jest wprowadzany do neuronów, oznacza to, że neurony mogą być włączane za pomocą niebieskiego światła. Neurony z ChR2 będą włączone tylko tak długo, jak długo świeci na nie niebieskie światło. Daje nam to precyzyjną kontrolę nad czasem aktywności neuronu. Normalnie neurony nie są dotknięte przez niebieskie światło (Rysunek 1B), więc tylko neurony posiadające ChR2 będą dotknięte przez niebieskie światło (Rysunek 1C).
Optogenetic Stimulation is More Specific Than Electrical Stimulation
Tak jak istnieje wiele dróg w mieście, istnieje wiele ścieżek w mózgu. Jeśli chcemy wiedzieć, jak punkt A łączy się z punktem B w mieście, możemy po prostu spojrzeć na wszystkie drogi i narysować mapę drogową. Jest to rodzaj mapy strukturalnej: pomaga nam zrozumieć, jak drogi są rozmieszczone. Ale zazwyczaj istnieje wiele sposobów, aby dostać się z punktu A do punktu B, więc skąd mamy wiedzieć, która droga jest najbardziej popularna? Aby się tego dowiedzieć, musimy przyjrzeć się samochodom poruszającym się po drogach, które jadą z punktu A do punktu B. To jest mapa funkcjonalna: pomaga nam zrozumieć, jak drogi są wykorzystywane. W mózgu neurony są jak drogi, a sygnały, które podróżują od neuronu do neuronu są jak samochody. Normalnie mózg jest bardzo aktywny, a na drogach jest mnóstwo samochodów przez cały czas. Na całej mapie mózgu samochody rozpoczynają i kończą swoje podróże w różnym czasie. Ponieważ, jest tak dużo aktywności, nie możemy zobaczyć żadnych wzorów lub zrozumieć, jak rzeczy są związane. Aby dowiedzieć się wzorców, byłoby przydatne, aby być w stanie kontrolować, kiedy i gdzie samochody zaczynają swoją podróż.
Wyobraź sobie, że są samochody w każdym podjeździe w naszym mieście. Samochody te czekają na sygnał, aby wyjechać na drogi (rysunek 2A). W badaniu z użyciem stymulacji elektrycznej możemy kontrolować, kiedy samochody zaczną podróżować, ale nie mamy zbyt dużej kontroli nad tym, które samochody wyjadą na drogi. W przypadku stymulacji elektrycznej, pobudzenie jest ogólne. Wszystkie samochody znajdujące się w pobliżu miejsca stymulacji zostaną wysłane na drogę. Oznacza to, że można śledzić wiele aktywności (Rysunek 2B). W badaniu stymulacji optogenetycznej możemy dokładnie wybrać, które samochody mają wyjechać na drogę i kiedy. Możemy wybrać grupę samochodów według lokalizacji (na przykład, możemy wybrać, aby wszystkie samochody w jednej dzielnicy wyjechały na drogi), lub możemy wybrać według typu samochodu (na przykład, możemy wybrać, aby tylko ciężarówki wyjechały na drogi) (Rysunek 2C). Jest to stymulacja selektywna. Ruch samochodów jest w tym przypadku o wiele łatwiejszy do śledzenia. Mówi nam to więcej o tym, jak konkretne samochody działają na drogach.
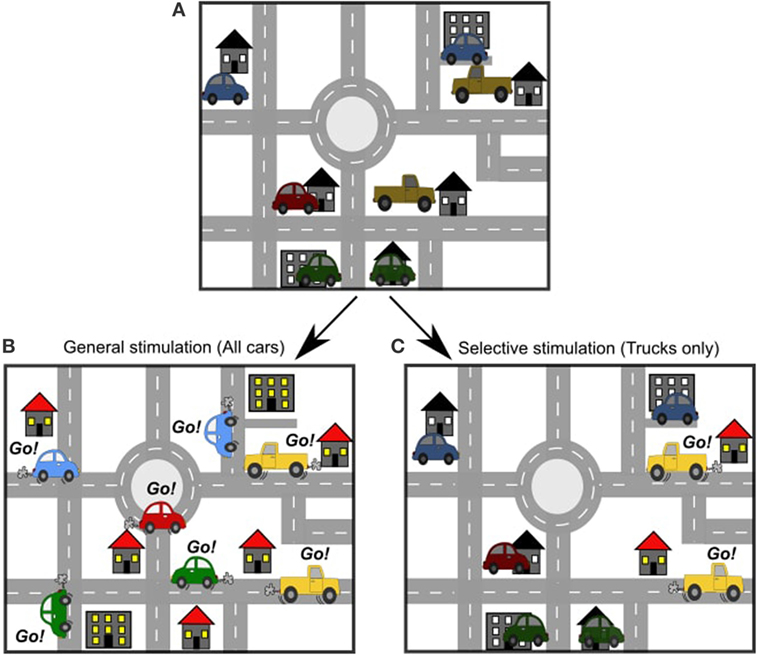
- Rysunek 2
- A. Tak jak w mieście jest wiele dróg, tak w mózgu jest wiele ścieżek. B. Badanie stymulacji elektrycznej jest jak wysłanie wszystkich samochodów na drogi naraz. C. Badanie stymulacji optogenetycznej jest jak wysłanie tylko jednego typu samochodu na drogi.
Jak Optogenetyka jest używana do mapowania mózgu?
Optogenetyka może być używana na kilka różnych sposobów do mapowania mózgu myszy (przegląd w Ref. ).
Tak jak możemy powiększyć mapę drogową miasta, aby zobaczyć główne autostrady (Rysunek 3A), lub powiększyć mapę, aby zobaczyć pojedynczy blok miasta (Rysunek 3B), możemy również powiększyć lub pomniejszyć mózg. Możemy oddalić się od mózgu, aby zobaczyć, jak duże obszary mózgu łączą się i współpracują ze sobą (Rycina 3C). Taki widok jest dobry, jeśli interesuje nas sposób, w jaki informacje przemieszczają się na duże odległości w mózgu, lub które obszary mózgu są ze sobą połączone. Na przykład, duże miasta mają zazwyczaj więcej dróg i autostrad przechodzących przez nie, ponieważ wiele osób podróżuje do i z tych miast. Wykorzystując optogenetykę do stymulowania jednego obszaru mózgu i rejestrowania odpowiedzi w innych obszarach mózgu, możemy dowiedzieć się, w których obszarach mózgu panuje największy ruch. Jest to ważne dla zrozumienia, jak powstają pewne zachowania, ale także może być ważne dla zrozumienia, co się stanie, jeśli mózg zostanie uszkodzony w danym obszarze (na przykład, jeśli zdarzy się wypadek na czwartej ulicy, jak zmieni się trasa ruchu?).
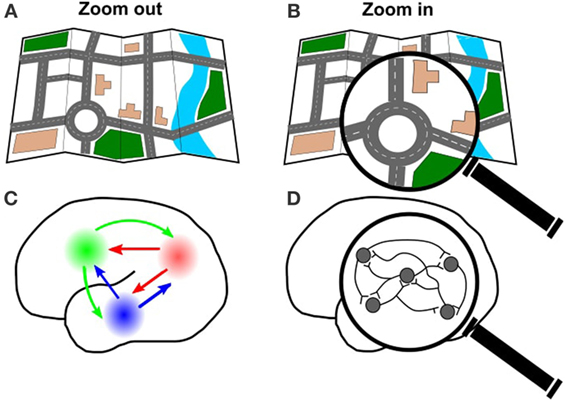
- Rysunek 3
- A. Tak jak można spojrzeć na całą mapę miasta, B. lub powiększyć na pojedynczą drogę, można również spojrzeć na połączenia w całym mózgu C., lub powiększyć na konkretną grupę komórek D.
Możemy również powiększyć mózg, aby zobaczyć, jak łączą się poszczególne neurony (Rysunek 3D). Używając optogenetyki, możemy zbadać, jak neurony współpracują ze sobą, poprzez użycie światła do włączenia niektórych neuronów i zarejestrowania odpowiedzi innych neuronów. Ten szczegółowy widok jest przydatny do zrozumienia, jak i kiedy neurony komunikują się ze sobą. Może to być bardzo przydatne do badania chorób, które zakłócają komunikację między neuronami w danym obszarze, co dzieje się, gdy ktoś ma udar (więcej na ten temat w następnej sekcji).
Mapowanie optogenetyczne stwarza wiele możliwości badania, jak działa mózg. W miarę doskonalenia technik optogenetycznych i tworzenia lub odkrywania kolejnych opsyn, istnieje możliwość jeszcze większej kontroli w badaniach nad stymulacją mózgu. Być może będziemy mogli używać wielu opsyn do kontrolowania kilku różnych typów neuronów w tym samym czasie. Ponieważ każda opsyna reaguje na określony rodzaj światła, moglibyśmy użyć innego światła do kontrolowania różnych rodzajów neuronów. W rzeczywistości, niektóre opsyny działają, aby wyłączyć neurony, gdy odpowiedni typ światła jest obecny.
W naszym przykładzie mapowania samochodów w mieście, moglibyśmy użyć wielu sygnałów do kontroli ruchu samochodów. Moglibyśmy mieć jeden zestaw samochodów wyjeżdżających na drogę, gdy dajemy jeden sygnał (powiedzmy, niebieskie światło) i inny zestaw samochodów wyjeżdżających na drogę, gdy dajemy inny sygnał (powiedzmy, czerwone światło). Używając tej konfiguracji, możemy zacząć eksperymentować z tymi dwoma zestawami samochodów: co się stanie, jeśli samochody na czerwonym świetle pojadą pierwsze? Co się stanie, jeśli samochody na niebieskim świetle pojadą pierwsze? Co się stanie, jeśli pojadą w tym samym czasie? To pomogłoby nam zrozumieć, jak te różne zestawy samochodów interakcji z siebie.
Więc jak naukowiec wybrać, która technika lub które opsin do wykorzystania? Odpowiedź będzie zależeć od pytania, które naukowiec chce zbadać. W następnej sekcji podkreślimy niektóre z pytań, które zostały zbadane przy użyciu optogenetyki.
Ostatnie odkrycia przy użyciu optogenetyki
Naukowcy zajmujący się mózgiem zaczęli używać optogenetyki w 2005 roku. Od tego czasu metody optogenetyczne zostały wykorzystane do badania mózgu z wielu różnych punktów widzenia – od komunikacji skupiska pojedynczych neuronów, do interakcji pomiędzy dużymi regionami mózgu (przegląd w Ref. ). W wielu innych badaniach wykorzystano metody optogenetyczne do badania różnych zagadnień i pytań. Niektóre z ostatnich pytań to: gdzie w mózgu znajduje się strach? W jaki sposób kalkulowane jest ryzyko i nagroda? Jak przechowywane są wspomnienia? (przegląd w Ref. ). Zastosowaliśmy optogenetykę u myszy, aby zbadać, jak zmienia się mózg po udarze. Udar mózgu zdarza się, gdy dopływ krwi do jakiegoś obszaru mózgu zostaje przerwany lub zmniejszony. Jest to niebezpieczne, ponieważ dopływ krwi przenosi tlen i inne ważne składniki odżywcze, których mózg potrzebuje do przeżycia. Jeśli jakikolwiek obszar mózgu pozostaje zbyt długo bez tlenu, neurony w tym obszarze w końcu obumierają. Powoduje to problemy dla tego konkretnego obszaru mózgu oraz dla wszystkich innych obszarów mózgu, które są z nim połączone. W naszym badaniu chcieliśmy sprawdzić, w jaki sposób niewielki udar jednego obszaru mózgu wpływa na wiele innych obszarów mózgu. Aby rozpocząć, użyliśmy ChR2, aby pomóc nam narysować funkcjonalną mapę mózgu myszy. Porównaliśmy mapy pomiędzy zwierzętami z udarem i bez udaru. Stwierdziliśmy, że mapy zmieniają się w czasie. W 1 tydzień po udarze, ogólna aktywność mózgu była bardzo niska. Zaskakująco, aktywność była niska nawet w obszarze odległym od udaru. Po 8 tygodniach od udaru ogólna aktywność mózgu była wyższa, ale nie wróciła do normy. Z tych danych wywnioskowaliśmy, że nawet niewielki udar może mieć duży wpływ na funkcjonowanie mózgu jako całości. Zrozumienie, co dzieje się z mózgiem po udarze, może pomóc naukowcom w stworzeniu lepszych metod leczenia pacjentów po udarze. To tylko jeden z przykładów na to, jak przydatna może być optogenetyka do badania zagadnień związanych z mózgiem. Jest prawdopodobne, że naukowcy zajmujący się badaniem mózgu będą nadal korzystać z optogenetyki przez wiele lat.
Glosariusz
Neurony: Specjalne komórki w mózgu komunikują się ze sobą poprzez wysyłanie i odbieranie sygnałów elektrycznych i chemicznych. W mózgu znajdują się miliardy neuronów, a sygnały wysyłane między tymi komórkami stanowią podstawę wszystkich naszych myśli i zachowań. Neurony są czasami nazywane komórkami nerwowymi.
Badanie stymulacji elektrycznej: Technika aktywacji neuronów lub ścieżek neuronowych poprzez włożenie małej elektrody i wysłanie prądu elektrycznego do tkanki. Powoduje to zmiany w aktywności elektrycznej tkanki.
Neuroscience: Gałąź nauki, która bada mózg i układ nerwowy.
Optogenetyka: Technika, która wykorzystuje połączenie światła i inżynierii genetycznej do kontroli aktywności komórki.
Inżynieria genetyczna: Proces zmiany informacji w kodzie genetycznym (blueprints) żywej istoty przez dodawanie lub usuwanie informacji. Inżynieria genetyczna jest czasami nazywana modyfikacją genetyczną.
Opsyny: Białka, które reagują na określony rodzaj światła (na przykład, ChR2 reaguje tylko na światło niebieskie). W neurobiologii, białka te są wykorzystywane do kontroli aktywności neuronów.
Channelrhod-Opsin-2 (ChR2): Opsyna, która reaguje specyficznie na światło niebieskie. Kiedy ChR2 jest wprowadzany do neuronów, niebieskie światło może być używane do włączania tych neuronów. ChR2 jest obecnie najbardziej popularną opsyną do badań optogenetycznych.
Uderzenie: Normalnie, krew przenosi tlen i inne ważne składniki odżywcze do mózgu. Kiedy dopływ krwi jest zakłócony lub zmniejszony, mózg nie otrzymuje rzeczy, których potrzebuje do prawidłowego funkcjonowania. Nazywa się to udarem, a to może powodować trwałe problemy i dysfunkcje.
Oświadczenie o konflikcie interesów
Autorzy oświadczają, że badania zostały przeprowadzone przy braku jakichkolwiek komercyjnych lub finansowych relacji, które mogłyby być interpretowane jako potencjalny konflikt interesów.
Original Source Article
Lim, D. H., LeDue, J., Mohajerani, M. H., Vanni, M. P., and Murphy, T. H. 2013. Optogenetic approaches for functional mouse brain mapping. Front. Neurosci. 7:54. doi:10.3389/fnins.2013.00054
Kolb, B., Whishaw, I. Q., and Teskey, G. C. 2016. An Introduction to Brain and Behavior. 5th ed. New York, NY: Worth.
Penfield, W., and Edwin, B. 1937. Somatic motor and sensory representation in the cerebral cortex of man as studied by electrical stimulation. Brain 60(4):389-443. doi:10.1093/brain/60.4.389
Nagel, G., Szellas, T., Huhn, W., Kateriya, S., Adeishvili, N., Berthold, P., et al. 2003. Channelrhodopsin-2, a directly light-gated cation-selective membrane channel. Proc. Natl. Acad. Sci. U.S.A. 100:13940-5. doi:10.1073/pnas.1936192100
Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., and Deisseroth, K. 2005. Genetycznie ukierunkowana optyczna kontrola aktywności neuronów w skali milisekundowej. Nat. Neurosci. 8:1263-8. doi:10.1038/nn1525
Lim, D. H., LeDue, J., Mohajerani, M. H., Vanni, M. P., and Murphy, T. H. 2013. Optogenetic approaches for functional mouse brain mapping. Front. Neurosci. 7:54. doi:10.3389/fnins.2013.00054
Deisseroth, K. 2015. Optogenetyka: 10 lat mikrobowych opsin w neuronauce. Nat. Neurosci. 18(9):1213-25. doi:10.1038/nn.4091
Lim, D. H., LeDue, J., Mohajerani, M. H., and Murphy, T. H. 2014. Optogenetic mapping after stroke reveals network-wide scaling of functional connections and heterogeneous recovery of the peri-infarct. J. Neurosci. 34(49):16455–66. doi:10.1523/JNEUROSCI.3384-14.2014
