Momente de dipol
Distribuția asimetrică a sarcinilor într-o substanță polară, cum ar fi HCl, produce un moment de dipol unde \( Qr \) în metri (m). este abreviat cu litera greacă mu (µ). Momentul dipolar este definit ca fiind produsul dintre sarcina parțială Q de pe atomii legați și distanța r dintre sarcinile parțiale.
Când o moleculă cu un moment dipolar este plasată într-un câmp electric, aceasta tinde să se orienteze cu câmpul electric datorită distribuției asimetrice a sarcinilor sale (Figura \(\PageIndex{4}\)).
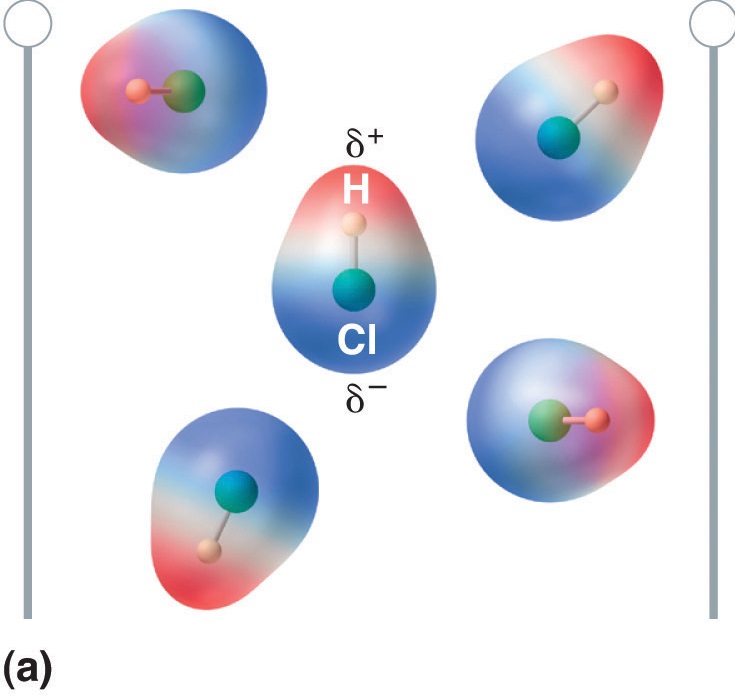
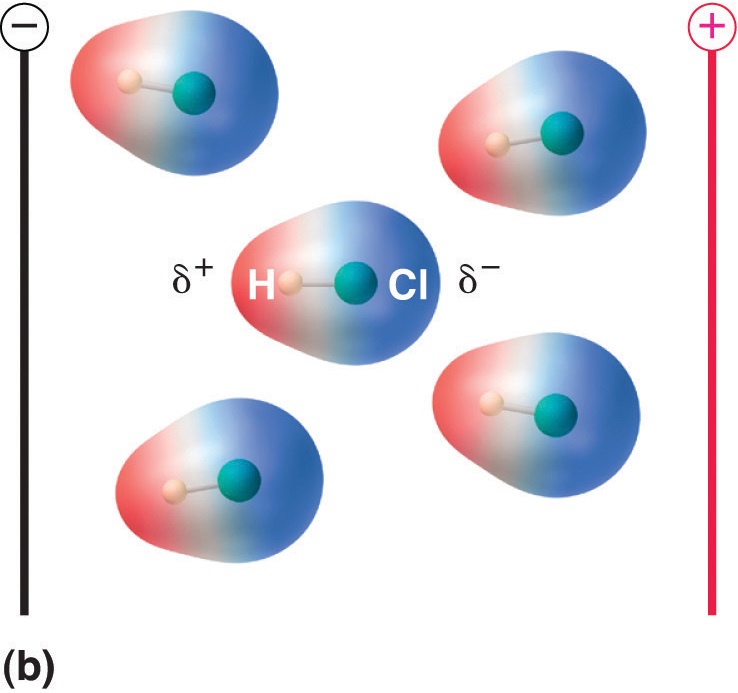
Figura \(\PageIndex{5}\): Moleculele care posedă un moment de dipol se aliniază parțial cu un câmp electric aplicat. În absența unui câmp (a), moleculele de HCl sunt orientate aleatoriu. Atunci când se aplică un câmp electric (b), moleculele tind să se alinieze cu câmpul, astfel încât capătul pozitiv al dipolului molecular să se îndrepte spre terminalul negativ și invers.
Momentul de dipol măsurat al HCl indică faptul că legătura H-Cl are aproximativ 18% caracter ionic (0,1811 × 100), sau 82% caracter covalent. În loc să scriem HCl ca
\
poate, prin urmare, să indicăm cantitativ separarea sarcinilor ca
\
Rezultatele noastre calculate sunt în concordanță cu diferența de electronegativitate dintre hidrogen și clor χH = 2,20; χCl = 3,16, χCl – χH = 0,96), o valoare care se încadrează bine în intervalul pentru legăturile covalente polare. Indicăm momentul dipolar prin scrierea unei săgeți deasupra moleculei. Din punct de vedere matematic, momentele dipolare sunt vectori și posedă atât o mărime, cât și o direcție. Momentul dipolar al unei molecule este suma vectorială a dipolilor legăturilor individuale. În HCl, de exemplu, momentul de dipol este indicat după cum urmează:
![]()
Săgeata arată direcția fluxului de electroni arătând spre atomul mai electronegativ.
Carga pe atomii multor substanțe din faza gazoasă poate fi calculată folosind momentele de dipol măsurate și distanțele legăturilor. Figura \(\PageIndex{6}\) prezintă o diagramă a procentului de caracter ionic în funcție de diferența de electronegativitate a atomilor legați pentru mai multe substanțe. Conform graficului, legăturile din specii precum NaCl(g) și CsF(g) au un caracter ionic substanțial mai mic de 100%. Cu toate acestea, pe măsură ce gazul se condensează într-un solid, interacțiunile dipol-dipolare între speciile polarizate cresc separările de sarcină. În cristal, prin urmare, un electron este transferat de la metal la nemetal, iar aceste substanțe se comportă ca niște compuși ionici clasici. Datele din figura \(\PageIndex{6}\) arată că speciile diatomice cu o diferență de electronegativitate mai mică de 1,5 au un caracter ionic mai mic de 50%, ceea ce este în concordanță cu descrierea noastră anterioară a acestor specii ca conținând legături covalente polare. Utilizarea momentelor dipolare pentru a determina caracterul ionic al unei legături polare este ilustrată în Exemplul \(\(\PageIndex{2}\).
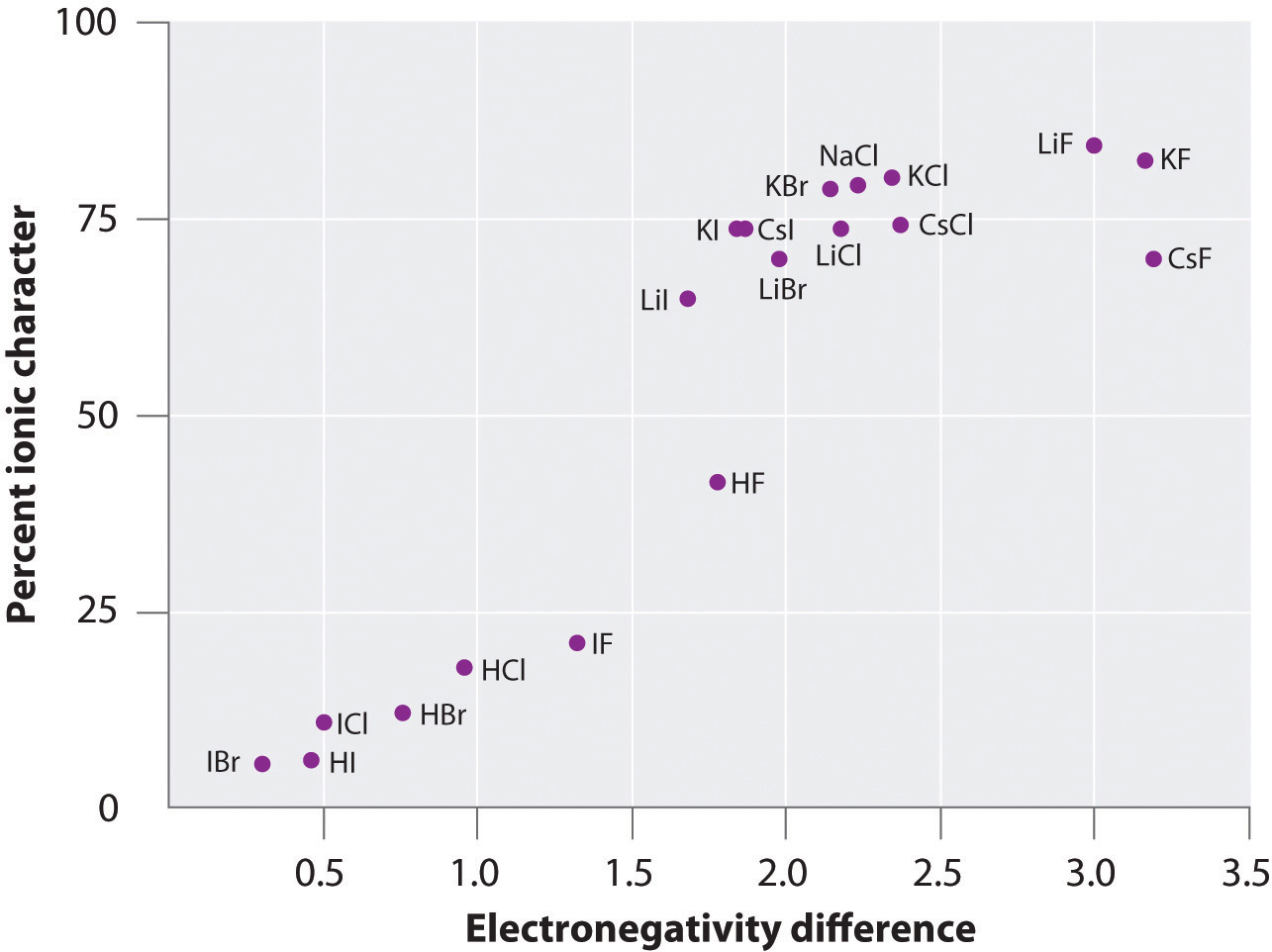
Figura \(\PageIndex{6}\): O diagramă a caracterului ionic procentual al unei legături, determinat pe baza momentelor de dipol măsurate, în funcție de diferența de electronegativitate a atomilor legați. în faza gazoasă, chiar și CsF, care are cea mai mare diferență posibilă de electronegativitate între atomi, nu este 100% ionic. Cu toate acestea, CsF în stare solidă este cel mai bine privit ca fiind 100% ionic din cauza interacțiunilor electrostatice suplimentare din rețea.
.
