Entalpie
Termodinamica este studiul relației dintre căldură (sau energie) și lucru. Entalpia este un factor central în termodinamică. Ea reprezintă conținutul de căldură al unui sistem. Căldura care intră sau iese din sistem în timpul unei reacții este variația de entalpie. Faptul că entalpia sistemului crește (adică atunci când se adaugă energie) sau scade (pentru că se cedează energie) este un factor crucial care determină dacă o reacție poate avea loc.
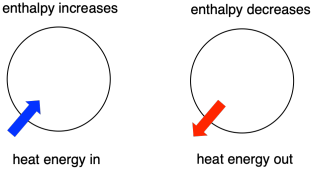
Câteodată, numim „entalpie internă” energia moleculelor care suferă o schimbare. Uneori, o numim „entalpia sistemului”. Aceste două expresii se referă la același lucru. În mod similar, energia moleculelor care nu iau parte la reacție se numește „entalpie externă” sau „entalpie a mediului înconjurător”.
În linii mari, schimbările de energie pe care le-am analizat în introducerea la termodinamică au fost schimbări de entalpie. Vom vedea în secțiunea următoare că există un alt factor energetic, entropia, pe care trebuie, de asemenea, să-l luăm în considerare în reacții. Deocamdată, ne vom uita doar la entalpie.
- Entalpia este conținutul de căldură al unui sistem.
- Variația de entalpie a unei reacții este aproximativ echivalentă cu cantitatea de energie pierdută sau câștigată în timpul reacției.
- O reacție este favorizată dacă entalpia sistemului scade în timpul reacției.
Această ultimă afirmație seamănă foarte mult cu descrierea energeticii de pe pagina anterioară. Dacă un sistem suferă o reacție și cedează energie, propriul său conținut energetic scade. Îi rămâne mai puțină energie dacă a cedat ceva. De ce se modifică energia unui set de molecule atunci când are loc o reacție? Pentru a răspunde la această întrebare, trebuie să ne gândim la ceea ce se întâmplă într-o reacție chimică.
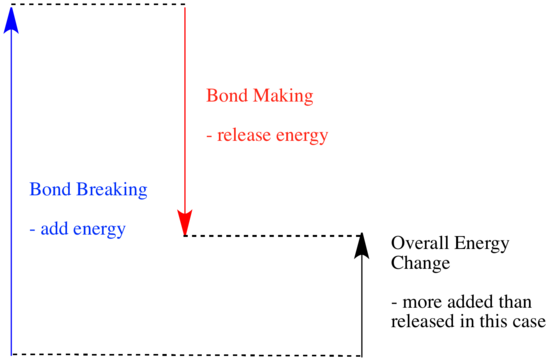
Într-o reacție, are loc o modificare a legăturii chimice. Unele dintre legăturile din reactanți sunt rupte și se realizează legături noi pentru a forma produsele. Ruperea legăturilor costă energie, dar energia este eliberată atunci când se realizează noi legături.
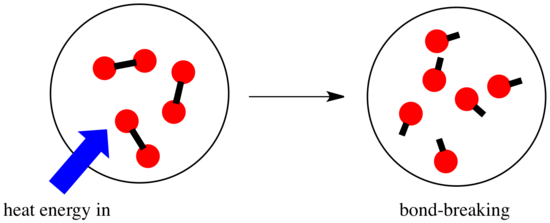
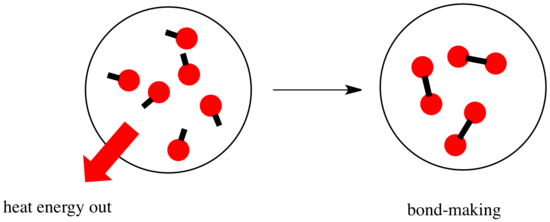
Puterea unei reacții de a merge mai departe poate depinde de echilibrul dintre aceste etape de formare și rupere a legăturilor.
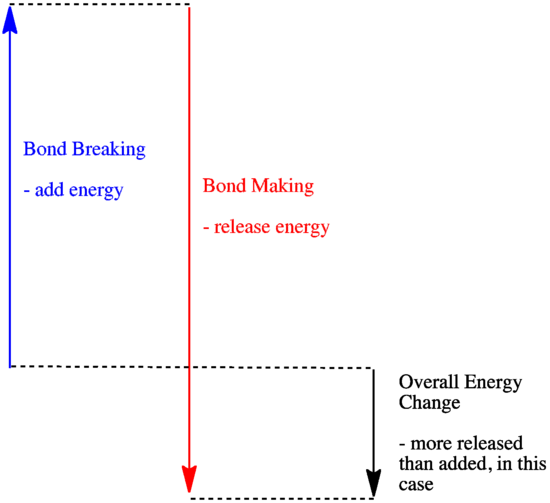
- O reacție este exotermă dacă prin formarea de noi legături se eliberează mai multă energie decât se consumă prin ruperea legăturilor vechi.
- O reacție este exotermă dacă legăturile mai slabe sunt schimbate cu legături mai puternice.
- O reacție este endotermă dacă ruperea legăturii costă mai multă energie decât cea furnizată la formarea legăturii.
Energiile de legătură (cantitatea de energie care trebuie adăugată pentru a rupe o legătură) sunt un factor important pentru a determina dacă o reacție va avea loc. Energiile de legătură nu sunt întotdeauna ușor de prezis, deoarece puterea unei legături depinde de o serie de factori. Cu toate acestea, o mulțime de oameni au făcut o mulțime de cercetări pentru a măsura rezistența legăturilor și au adunat informațiile în tabele, astfel încât, dacă aveți nevoie să știți cât de puternică este o legătură, puteți căuta informațiile de care aveți nevoie.
| Legătură | Energie de legătură (kcal/mol) | Legătură | Energie de legătură (kcal/mol) |
| H-H | 104 | O-H | 111 |
| C-C | 83 | C-H | 99 |
| O=O | 119 | N-H | 93 |
| N=N | 226 | C=O | 180 |
De exemplu, să presupunem că doriți să știți dacă arderea metanului este o reacție exotermă sau endotermă. O să presupun că este exotermă, deoarece această reacție (și altele asemănătoare) este folosită pentru a furniza căldură pentru o mulțime de case prin arderea gazului natural în cuptoare.
„Arderea” metanului înseamnă că acesta este ars în aer, astfel încât să reacționeze cu oxigenul. Produsele arderii hidrocarburilor sunt în principal dioxid de carbon și apă. Atomul de carbon din metan (CH4) se încorporează într-o moleculă de dioxid de carbon. Atomii de hidrogen sunt încorporați în moleculele de apă. Există patru atomi de hidrogen în metan, așa că sunt suficienți pentru a face două molecule de H2O.
- În arderea metanului trebuie rupte patru legături C-H.
- Cele patru noi legături O-H sunt create atunci când hidrogenii din metan sunt adăugați în noi molecule de apă.
- Două noi legături C=O sunt create atunci când carbonul din metan este adăugat într-o moleculă de CO2.
Cea de-a doua piesă a puzzle-ului este sursa de oxigen pentru reacție. Oxigenul este prezent în atmosferă mai ales sub formă de O2. Deoarece avem nevoie de doi atomi de oxigen în molecula de CO2 și încă doi atomi de oxigen pentru cele două molecule de apă, avem nevoie de un total de patru atomi de oxigen pentru reacție, care ar putea fi furnizați de două molecule de O2.
-
Două legături O=O trebuie rupte pentru a furniza atomii de oxigen pentru produși.
În total, sunt patru legături C-H și două legături O=O rupte, plus două legături C=O și patru legături O-H realizate. Asta înseamnă 4 x 99 kcal/mol pentru legăturile C-H și 2 x 119 kcal/mol pentru legăturile O=O, adică un total de 634 kJ/mol adăugați. Reacția eliberează 2 x 180 kcal/mol pentru legăturile C=O și 4 x 111 kcla/mol pentru legăturile OH, cu un total de 804 kcal/mol. În total, se eliberează cu 170 kcal/mol mai mult decât se consumă.
Aceasta înseamnă că reacția este exotermă, deci produce căldură. Probabil că este o modalitate bună de a vă încălzi casa.
