Introduktion
Kronisk obstruktiv lungsjukdom (KOL) är en betydande orsak till dödlighet och sjuklighet i hela den moderna världen. Dödligheten i denna sjukdom ökar och det förutspås att den kommer att bli den tredje vanligaste dödsorsaken i världen år 2020.1 Det är inte möjligt att definiera KOL enbart utifrån forcerad expiratorisk volym i 1s (FEV1), så det globala initiativet för kronisk obstruktiv lungsjukdom (GOLD) har utarbetat en multidimensionell definition för att bedöma KOL.2 Den nya definitionen innefattar prevalens av symtom och tidigare historia av exacerbationer utöver FEV1-värdet, och betonar också bedömningen av komorbiditeter. För att bedöma symtom rekommenderas antingen det modifierade Medical Research Council (mMRC) eller COPD Assessment Test (CAT). Dessutom användes en sjukdomsspecifik skala för livskvalitet (SGRQ, SF-36, CCQ) för att utvärdera sjukdomens inverkan på det dagliga livet. Vissa studier har visat ett starkt samband mellan CAT och St George’s Respiratory Questionnaire (SGRQ).3,4 Ladeira et al.5 visade att CAT var korrelerat med BODE-index.
KOL är en komplex sjukdom och omfattar genetiska, cellulära och molekylära komponenter. Det finns många olika celler och molekyler som är involverade i de inflammatoriska vägarna. Flera indikatorer har använts för att påvisa en potentiell sjukdomsrelaterad systemisk inflammation.6-9 Inflammation i luftvägar och lungparenkym är en viktig patogen mekanism för KOL. Dessutom kan en ihållande systemisk inflammation vara förknippad med olika extrapulmonala komorbiditeter och pulmonella effekter.10 Nyligen genomförd forskning har bevisat att det finns en distinkt ”ny systemisk inflammatorisk KOL-fenotyp”. 7 I en nyligen genomförd studie har det visats att kardiovaskulär komorbiditet och diabetes var förknippade med högre nivåer för vissa markörer för systemisk inflammation.11 Därför är genetisk belastning, systemisk inflammation och komorbiditetssjukdomar förknippade med olika fenotyper vid KOL. Det är viktigt att nya perspektiv utvecklas i hanteringen av denna sjukdom.
För närvarande har CAT använts i allt större utsträckning för att bedöma och övervaka KOL. Även om flera serumbiomarkörer har definierats vid KOL finns det inte en enda tillräcklig och effektiv enskild biomarkör som kan användas för att bedöma statusen hos KOL-patienter. Det har visats att biomarkörer är associerade med flera parametrar såsom inflammation, sjukhusvistelse och dödlighet.7-13 Sambandet mellan CAT och biomarkörer har dock inte tydligt visats. Därför syftar denna studie till att undersöka nivåerna av systemisk inflammation vid KOL och fastställa sambandet mellan CAT och inflammationsmarkörer och livskvalitet.
Material och metoderStudieutformning
Detta var en tvärsnittsobservationsstudie med ett enda besök. Ett hundra tio patienter med KOL diagnostiserad enligt GOLD-kriterierna14 och sextiofem kontrollpersoner rekryterades mellan februari 2013 och augusti 2013. Kontrollpersonerna valdes bland dem som hänvisades till en lung- och internmedicinsk klinik vid Balikesirs universitetssjukhus och som genomgick rutinundersökningar. Skriftligt informerat samtycke inhämtades från alla deltagare och studien godkändes av den institutionella etikkommittén vid medicinska fakulteten vid Balikesir universitet.
Alla patienter genomgick en fysisk undersökning, röntgen av bröstkorgen, test av andningsfunktionen och rutinprov för blodanalys. Antalet exacerbationer under det föregående året och rökningshistorik registrerades. CAT, mMRC dyspnépoäng genomfördes via personliga intervjuer av lungspecialister. SGRQ-poängen rapporterades av patienterna. För den friska kontrollgruppen gjordes endast ett andningsfunktionstest och rutinmässiga blodanalyser.
Studiepopulationen
Inklusionskriterier: Patienterna inkluderades om de; (1) var äldre än 40 år; (2) var nuvarande eller före detta rökare med en rökhistoria ≥10 paketår; (3) uppvisade ett FEV1
80 % efter bronkdilatation och ett FEV1/FVC0,7. Kontrollpersoner ingick om de: (1) var äldre än 40 år, (2) var fria från lungsjukdom enligt läkares bedömning, (3) hade normal spirometri (FEV1>85 % och FEV1/FVC>0,7) och (4) hade en rökningshistoria på
Exklusionskriterier: Patienter som (1) hade en exacerbation av KOL under de senaste 6 veckorna, (2) hade en annan andningssjukdom än KOL eller malignitet, (3) hade en kronisk inflammatorisk sjukdom (vaskulit, inflammatorisk tarmsjukdom, reumatoid artrit etc.) exkluderades.) (4) hade okontrollerad eller allvarlig samsjuklighet (MI, arytmi etc.).
Mätningar
Demografiska egenskaper, ålder, kön, rökvanor, intagning på akutmottagning eller sjukhusvistelse under det senaste året, ledsagande sjukdomar och befintliga behandlingar registrerades alla på lämpligt sätt. Vi definierade en exacerbation som en försämring av symtomen som krävde orala kortikosteroider och/eller antibiotika och/eller sjukhusvistelse. Komorbiditetssjukdomar fastställdes med hjälp av den kliniska anamnesen och fynden vid fysisk undersökning under besöket och stöddes av en genomgång av tillgängliga medicinska journaler. Aktuella mediciner, inklusive inhalatorer, antihypertensiva eller andra mediciner, dokumenterades. Längd, vikt och BMI-index mättes, och en spirometri utfördes också i enlighet med de internationella riktlinjerna (ATS/ERS).15 Sjukdomen klassificerades enligt den gamla och nya versionen av GOLD-stadieindelningen.14 För det första GOLD-spirometrisk stadieindelning (FEV1-baserad (1-4) stadieindelning) och för det andra GOLD-stadieindelning (A-D-klass). Dyspné bedömdes med hjälp av mMRC dyspnéskalan.16 Patienterna med KOL kategoriserades i A, B, C och D genom att kombinera symtombedömning med hjälp av mMRC dyspnépoäng och exacerbationsrisk.
CAT: Validiteten och tillförlitligheten hos den turkiska versionen av denna skala har tidigare verifierats.17 CAT omfattar 8 punkter och ger totalpoäng som sträcker sig från 0 till 40. Högre poäng indikerar en allvarligare försämring av hälsotillståndet eller mindre framgångsrik kontroll av KOL.3
Quality of life Questionnaire: George’s Respiratory Diseases Questionnaire (SGRQ).18
Biomarkörer
Vi valde biomarkörer utifrån tidigare studier.7,9-13 Blodproverna som togs från alla försökspersoner centrifugerades och förvarades vid -80°C. Alla prover analyserades när studien avslutades. Serumet undersöktes i en diagnostisk anordning (BioTek, ELx 800, USA) med användning av kommersiella kit (eBioscience, Human TNF-α och Human IL-6 Platinum ELISA, Österrike) och med metoderna för tumörnekros alfa (TNF-α) och en interleukin-6 (IL-6)-nivå enzyme linked immunosorbent assay (ELISA). Nivåerna av C-reaktivt protein (CRP) utvärderades med en klinisk kemisk analysator (Cobes Integra 800, Roche diagnostics) med hjälp av ett kommersiellt kit. Referensvärdet för CRP är 0-0,5 mg/L, medan det analyserade lägsta värdet för IL-6 är 0,92pg/ml. Det analyserade lägsta värdet för TNFα är 2,3pg/ml. TNF-α- och IL-6-koncentrationerna i vissa prover låg under den nedre kvantifieringsgränsen (LLQ). I analysen av individer med värden under LLQ användes en nominell nivå på halva LLQ-värdet för att undvika en snedvridning nedåt av populationsdata.19
Statistisk analys
De genomsnittliga CRP-värdena för KOL- och kontrollgrupperna (3,2 (1,5,7,1), 1,3 (0,6,2,7)) identifierades från liknande studier.7 Därefter beräknades urvalsstorleken i varje grupp med hjälp av en genomsnittlig kalkyleringsformel med 80 % noggrannhet och 5 % fel. Följaktligen befanns urvalsstorleken vara minst 55 försökspersoner i varje grupp. Resultaten presenteras som medelvärde ± SD, median eller procent, beroende på vad som är lämpligt. Studentens t-test och ANOVA användes för parametriska tester; Mann-Whitney U-test, Kruskal-Wallis och chi-square-statistik användes för icke-parametriska tester för gruppjämförelser. Fishers exakta test utvärderade skillnaderna mellan procentandelarna av komorbiditeter och skillnaderna mellan könen. Chi-square-testet utvärderade skillnaderna mellan procentandelarna av komorbiditeter. Parvis korrelation av kontinuerliga variabler hos patienter med KOL undersöktes med Pearsonkorrelation. Ett värde på p
0,05 ansågs vara statistiskt signifikant. Alla statistiska analyser utfördes med programvaran SPSS (version 20.0).ResultatKlinisk karakterisering av försökspersoner
Studien omfattade 110 patienter (medelålder 64±8,9 år; 100 män (90,9 %)) och 65 kontrollpersoner (medelålder 61,5±9,2 år, 55 män (84,6 %)). De demografiska och kliniska egenskaperna hos patient- och kontrollgrupperna anges i tabell 1. Fyrtiofem (40,9 %) patienter med KOL hade en ledsjukdom (ischemisk hjärtsjukdom (n=21), högt blodtryck (n=13), diabetes mellitus (n=8), annat (n=3)). Medelvärdet för FEV1 var 48,8 % av det förutspådda värdet och medelvärdet för FEV1/FVC: 55,4 % i KOL-gruppen. Den genomsnittliga CAT-poängen var 22,6 (±9,2), mMRC: 1,9 (±0,9) och total SGRQ: 58,4 (±22,2). Av de 110 patienterna var 9,1 % i stadium 1, 37,3 % i stadium 2, 42,7 % i stadium 3 och 10,9 % i stadium 4 enligt GOLD:s spirometriska stadieindelning. När patienterna klassificerades med avseende på GOLD-stadieindelning tillhörde 27,3 % grupp A, 30,9 % grupp B, 7,3 % grupp C och 34,5 % grupp D.
Demografiska, funktionella, kliniska särdrag hos patient- och kontrollgrupperna.
| Patient (n=110) | Kontroll (n=65) | p-värde | ||
|---|---|---|---|---|
| Age | 64.0±8.9 | 61.5±9.2 | 0,080 | |
| Manlig n, (%) | 100 (90,9) | 55 (84.6) | 0,224 | |
| BMI, kg/m2 | 26,5±5,6 | 25±2,6 | 0.064 | |
| Packår | 38,9±23 | 0,1±1,2 | ||
| Ko-morbiditeter, n (%) | ||||
| Någon | 65 (59.1) | 42 (64,6) | 0,95 | |
| Ischemisk hjärtsjukdom | 21(19,1) | 11 (16,9) | ||
| HT | 13 (11.8) | 6 (9.2) | ||
| DM | 8 (7.3) | 4 (6.2) | ||
| Annat | 3 (2.7) | 2 (3.1) | ||
| mMRC | 1,94±0,9 | 0,04±0,2 | ||
| FEV1, % förutspådd | 48,8±17.8 | 89,4±5,6 | ||
| FVC, % förutspådd | 68,7±17,8 | 92,1±5,8 | ||
| FEV1/FVC, % | 55.4±12,9 | 89,6±4,7 | ||
| GOLD spirometrisk nivå, n (%) | ||||
| 1 | 10 (9.1) | |||
| 2 | 41 (37.3) | |||
| 3 | 47 (42.7) | |||
| 4 | 12 (10.9) | |||
| GOLD stadium, n (%) | ||||
| A | 30 (27.3) | |||
| B | 34 (30.9) | |||
| C | 8 (7.3) | |||
| D | 38 (34.5) | |||
| SGRQ-totalpoäng | 58,4±22,2 | |||
| CAT-poäng | 22.6±9,2 | |||
| TNFα (pg/ml) | 109,5±58 | 14,6±18 | ||
| IL-6 (pg/ml) | 10.3±18 | 2,14±1,9 | ||
| CRP (mg/L) | 1,6±1,7 | 0,4±0,3 | ||
Abkortningar: BMI: Body Mass Index, HT: Hypertoni, DM: Diabetes, FEV1: forcerad expiratorisk volym på en sekund, FVC: forcerad vitalkapacitet, CAT: COPD assessment test.
COPD/kontrolljämförelser
Det fanns ingen signifikant skillnad mellan åldrarna (p=0,080, Student’s t-test) och könen i de två grupperna (p=0,453, fisher’s exact test) (tabell 1). Grupperna uppvisade liknande förekomst av komorbiditeter (p=0,095, χ2-test). Som förväntat hade KOL-patienterna betydligt lägre lungfunktionsparametrar (FEV1, FVC, FEV1/FVC) jämfört med kontrollerna (p
0,001, Students t-test). Generellt uppvisade KOL-patienter högre serumnivåer av CRP (1,6±1,7mg/L) och TNF-α (109,5±58pg/ml) och IL-6 (10,3±18pg/ml) än friska kontroller (CRP: 0,4±0,3mg/L, p0,001; TNF-α: 14,6±18pg/ml, p0.001; IL-6: 2,14±1,9pg/ml, p0.001, Student’s t-test) (tabell 1).Samband mellan CAT-frågeformulär och patientegenskaper
Det fanns ett samband mellan CAT-poängen och det spirometriska GOLD-stadiet (Pearsons r=0,43; p
0,001). CAT-poängen ökade parallellt med sjukdomens svårighetsgrad. Det fanns ett statistiskt signifikant samband mellan CAT-poängen och antalet exacerbationer under det föregående året (Pearsons r=0,35, p0,001), sjukdomens varaktighet (Pearsons r=0,29, p0,001), rökning (paketår) (Pearsons r=0,27, p=0,014) och mMRC (Pearsons r=0,59, p0,001). CAT-poängen visade sig vara signifikant korrelerad med FEV1 (Pearsons r=-0,39, p0,001) och FVC (Pearsons r=-42, p=0,003). Samtidigt observerades en stark korrelation mellan CAT-poängen och SGRQ-symtom-, aktivitets-, effekt- och totalpoängen (Pearsons r=0,72; p0,001).Samband mellan biomarkörer och patientegenskaper
Inflammatoriska markörer och lungfunktionsparametrar jämfördes. När FEV1 minskade ökade nivåerna av biomarkörer signifikant. CRP-nivåerna var korrelerade med FEV1 (Pearsons r=-0,39, p
0,001), FVC (Pearsons r=-0,33, p0,001) och FEV1/FVC (Pearsons r=-0,38, p0,001). TNF-α-nivåerna var också korrelerade med FEV1 (Pearsons r=-0,57, p0,001), FVC (Pearsons r=-0,37, p0,001) och FEV1/FVC (Pearsons r=-0,66, p0,001). IL-6-nivåerna var också korrelerade med FEV1 (Pearsons r=-0,31, p0,001), FVC (Pearsons r=-0,32, p0,001) och FEV1/FVC (Pearsons r=-0,34, p0,001). En signifikant korrelation observerades mellan CRP, TNF-α, IL-6 och rökning (pack-år) (Pearsons r=0,35, r=0,44, r=0,27, p0,001, respektive). KOL-patienter med kardiovaskulär sjukdom hade en ökad nivå av CRP (2,98±2.4 mg/L) jämfört med patienter utan komorbiditeter (1,56±1,5 mg/L, p=0,008 ANOVA-test följt av LSD post hoc-test). Det fanns inget signifikant samband med andra biomarkörer och komorbiditeter. När IL-6 ökade ökade mMRC-poängen, men detta samband var inte statistiskt signifikant (p=0,06). När inflammatoriska markörer jämfördes med CAT-poängen visade sig CRP-nivåerna ha ett signifikant samband (r=0,43, p0,001) (fig. 1), medan inget samband observerades med TNF-α och IL-6. Det fanns en korrelation mellan CRP-nivåer och TNFα (r=0,48, p0,001). Inget direkt samband observerades mellan biomarkörer och A-D-klass eller spirometriska stadier.
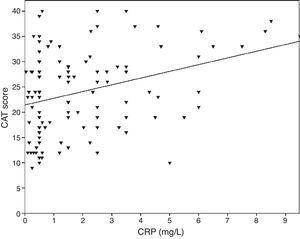
Sambandet mellan CAT-poäng och CRP (r=0,43, p0,001).
Diskussion
Vissa bedömningsverktyg används, såsom kliniska tester (CAT, BODE), inflammationsmarkörer och frågeformulär om livskvalitet för att bedöma KOL. Det är allmänt accepterat att det krävs en multidimensionell bedömning för att förstå och hantera sjukdomen. KOL är en komplex sjukdom med en systemisk komponent och vissa patienter verkar ha en inflammatorisk fenotyp. I den här studien utfördes CAT som ett nytt kliniskt test, och sambandet mellan CAT och andra KOL-komponenter undersöktes.
En av dessa komponenter är systemisk inflammation. De biomarkörer som oftast studeras vid KOL för att indikera systemisk inflammation och som vanligen används är CRP, IL-6, TNF-α, IL-8 och fibrinogen. Flera studier har tidigare rapporterat förhöjda cirkulerande nivåer av dessa markörer hos patienter med stabil KOL.6-9,20-23 I en nyligen genomförd studie visade Agustí et al. att 30 % av KOL-patienterna inte uppvisade några tecken på systemisk inflammation och att 16 % av patienterna uppvisade persisterande systemisk inflammation.7 Intressant nog visade sig i den här studien serumnivåerna av TNF-α och IL-8 vara högre hos rökare med normal spirometri jämfört med KOL-patienter. Andra markörer som vita blodkroppar, IL-6, CRP och fibrinogen visade sig vara högre hos KOL-patienter än hos rökare med normal spirometri och icke-rökare. I vår studie var nivåerna av CRP, TNF-α och IL-6 signifikant högre hos alla KOL-patienter jämfört med kontrollgruppen. Alla biomarkörer visade sig vara korrelerade med kumulativ rökningsexponering och minskning av parametrar för lungfunktionstest (FEV1, FVC och FEV1/FVC). Biomarkörernas nivå relaterar till graden av luftflödesobstruktion. Dessa resultat stämmer överens med dem som rapporterats i tidigare tvärsnittsstudier.13 I en annan studie som undersökte resultaten av ECLIPSE korrelerade kardiovaskulära komorbiditeter och diabetes med vissa systemiska inflammationsmarkörer.9 I vår studie hade KOL-patienter med kardiovaskulära sjukdomar en förhöjd nivå av CRP jämfört med patienter utan komorbiditeter. Ökad systemisk inflammation hos KOL med kardiovaskulära sjukdomar stöder en patofysiologisk mekanism mellan KOL och dessa komorbiditeter.
Sambandet mellan KOL och systemisk inflammation har inte klarlagts av de studier som hittills genomförts. I en studie visades ett signifikant samband mellan LCN1, LCN2 och CAT.8 I vår studie har ett signifikant samband visats mellan CAT och CRP. Ett liknande samband kunde dock inte visas med TNF-α och IL-6.
I den aktuella studien kategoriserades KOL-patienterna i fyra grupper (A-D) och stadier (1-4) enligt den gamla och nya versionen av GOLD-klassificeringen. Det kan konstateras att stadium 1 och stadium 4 utgör den minsta andelen av befolkningen med 10 % vardera enligt den gamla klassificeringen. I den nya versionen fördelades populationen nästan jämnt mellan grupperna A, B och D. Den minsta fördelningen var grupp C. I andra studier har det också visats att grupp C utgör den minsta andelen av fördelningen.24,25 Den nya klassificeringen visar att det kan finnas en del patienter med flera symtom men med lindrig luftvägsobstruktion samt en del patienter med få symtom men med allvarliga luftvägsobstruktioner. Komorbiditeter och systemisk inflammation kan leda till ökad exacerbation och ökade symtom hos patienter med mild/måttlig obstruktion, och på så sätt gör det att dessa patienter placeras i högriskgrupperna (C- eller D-klass). I en studie visades att subtyp C innefattar patienter med högre komorbiditetsstatus och subtyp D innefattar patienter med de allvarligaste exacerbationerna, en hög andel exacerbationer relaterade till sjukhusvistelse och de sämsta resultaten26 . I en nyligen genomförd studie jämförde Agustí et al. två grupper med och utan persisterande systemisk inflammation och visade att patienter som uppvisar persisterande inflammation under uppföljningen hade en ökad exacerbationsfrekvens per år jämfört med den andra gruppen, även om de pulmonella avvikelserna var likartade i de två grupperna.7
GOLD rekommenderar att man använder CAT- eller mMRC-skalan för att bedöma symtomen. Vi använde mMRC-skalan för gruppindelning, eftersom när vi bedömde symtomen utifrån CAT var antalet patienter med färre än 10 brytpunkter mycket litet (8 patienter). De högre CAT-poängen kan vara förknippade med högre uppfattningar om patienternas symtom. Det visades också att CAT och mMRC inte är likvärdiga, vilket kan orsaka vissa skillnader i klassificeringen.24,25,27 I den nya klassificeringen består de andra brytpunkterna av antal exacerbationer per år. Sambandet mellan basal CAT-poäng och frekvensen exacerbationer har visats hos KOL-patienter.28 Pothirat et al. har visat att förändringen i CAT-poäng under övervakningsbesök är ett användbart verktyg för att upptäcka akut försämring av hälsostatusen hos KOL-patienter.29 I vår studie observerades ett starkt samband mellan CAT, mMRC och exacerbationsfrekvensen. CAT visade sig också vara korrelerat med sjukdomens längd och rökning (pack-år). Patienternas genomsnittliga FEV1-värde visade sig vara 48,8 % av det förutspådda värdet och den genomsnittliga CAT-poängen var 22,6. Ett starkt samband visades mellan CAT och FEV1, FVC och GOLD-spirometriska stadier. När FEV1 och FVC minskade, ökade CAT-poängen. CAT-poängen korrelerade också positivt med ett tyngre GOLD-stadium. Dessa resultat visar att CAT återspeglar sjukdomens svårighetsgrad mycket väl.
En annan viktig komponent i behandlingen av KOL är livskvaliteten. En mängd olika frågeformulär om livet har använts för att utvärdera sjukdomens effekter på det dagliga livet. Tillförlitligheten och validiteten hos den turkiska versionen av SGRQ har bevisats.30 Några studier har visat att ett signifikant samband observerades mellan CAT och SGRQ.3,4 I en studie har det rapporterats att CAT är känslig för förändringen av hälsotillståndet i samband med KOL-exacerbationer.31 I vår studie visades ett starkt samband mellan CAT och SGRQ. Eftersom CAT, jämfört med SGRQ, är ett kortare och lättare test att förstå, är användningen av CAT mer praktisk.
Denna studie har flera begränsningar, till exempel tvärsnittsdesign, en studie på ett enda center och en liten urvalsstorlek. Dessutom kunde inflammationsmarkörerna inte jämföras hos rökare som har normal lungfunktion eftersom de inte ingick i den aktuella studien. Patienternas mediciner kan utöva en påverkan på det systemiska inflammatoriska svaret och hälsostatusen och de kan också påverka resultaten.
Sammanfattningsvis är CAT ett test som kan användas vid bedömningen av KOL, eftersom dess tillförlitlighet och validitet tydligt har visats. Resultaten av vår studie visar på sambandet mellan CAT och CRP samt andra KOL-komponenter (kliniska, funktionella parametrar). Det krävs dock longitudinella multicenterstudier för att utvärdera sambandet mellan CAT och biomarkörer.
Etiska upplysningarSkydd av människor och djur
Författarna förklarar att inga experiment har utförts på människor eller djur för denna studie.
Dataintegritet
Författarna förklarar att de har följt sitt arbetscentrums protokoll om publicering av patientuppgifter och att alla patienter som ingick i studien fick tillräcklig information och gav sitt skriftliga informerade samtycke till att delta i studien.
Rätt till personlig integritet och informerat samtycke
Författarna har inhämtat skriftligt informerat samtycke från de patienter eller försökspersoner som omnämns i artikeln. Motsvarande författare är i besittning av detta dokument.
Författarskap
Studieutformning: NS, FE och AAH; Datainsamling: NS, FE och AAH; Datainsamling: NS, FE och AAH; Datainsamling: Datainsamling: NS, CB; Dataanalys och tolkning: NS, CB; Dataanalys och tolkning: NS, AAH: NS, AAH och CB; Kritisk granskning av manuskriptet: NS, AAH och CB; Kritisk granskning av manuskriptet: NS, AAH och CB: NS, FE, CB och AAH.
Intressekonflikter
Författarna förklarar att de inte har några intressekonflikter i samband med utarbetandet av detta manuskript.
