Entalpi
Thermodynamik är studiet av förhållandet mellan värme (eller energi) och arbete. Entalpi är en central faktor inom termodynamiken. Det är värmeinnehållet i ett system. Den värme som går in i eller ut ur systemet under en reaktion är entalpiförändringen. Huruvida systemets entalpi ökar (dvs. när energi tillförs) eller minskar (eftersom energi avges) är en avgörande faktor som avgör om en reaktion kan äga rum.
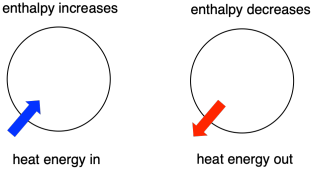
Och ibland kallar vi energin hos de molekyler som genomgår en förändring för ”inre entalpi”. Ibland kallar vi den för ”systemets entalpi”. Dessa två fraser hänvisar till samma sak. På samma sätt kallas energin hos de molekyler som inte deltar i reaktionen för ”extern entalpi” eller ”omgivningens entalpi”.
Grovt sett var de energiförändringar som vi tittade på i introduktionen till termodynamiken förändringar i entalpi. Vi kommer i nästa avsnitt att se att det finns en annan energifaktor, entropi, som vi också måste ta hänsyn till vid reaktioner. För tillfället ska vi bara titta på entalpi.
- Enthalpi är värmeinnehållet i ett system.
- Enthalpieförändringen i en reaktion motsvarar ungefär den mängd energi som förloras eller vinns under reaktionen.
- En reaktion gynnas om systemets entalpi minskar under reaktionen.
Detta sista påstående påminner mycket om beskrivningen av energetik på föregående sida. Om ett system genomgår en reaktion och avger energi minskar dess eget energiinnehåll. Det har mindre energi kvar om det gav bort lite. Varför förändras energin i en uppsättning molekyler när en reaktion inträffar? För att svara på det måste vi tänka på vad som händer i en kemisk reaktion.
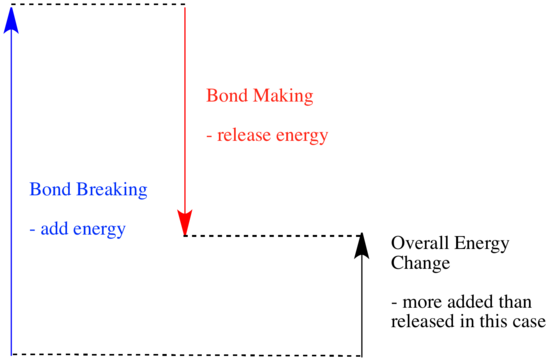
I en reaktion sker en förändring av den kemiska bindningen. En del av bindningarna i reaktanterna bryts, och nya bindningar skapas för att bilda produkterna. Det kostar energi att bryta bindningar, men energi frigörs när nya bindningar skapas.
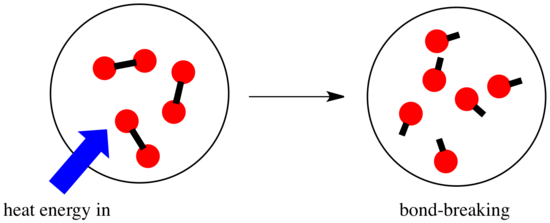
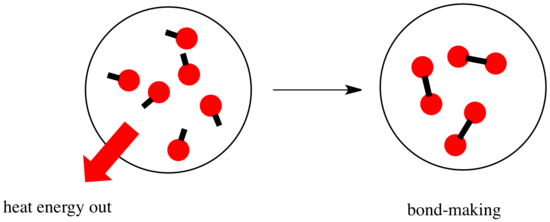
Om en reaktion kan gå vidare kan bero på balansen mellan dessa steg för att skapa och bryta bindningar.
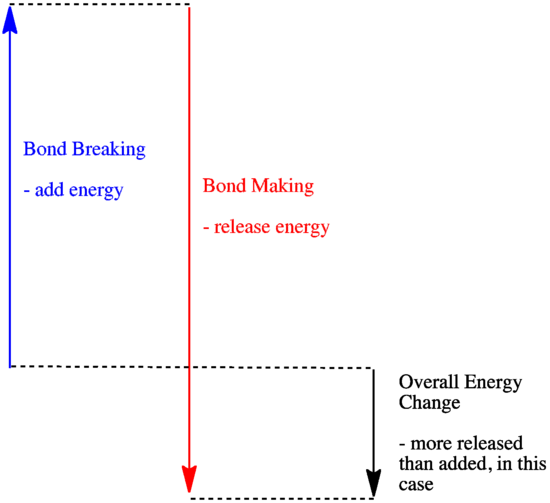
- En reaktion är exoterm om mer energi frigörs genom att nya bindningar bildas än vad som förbrukas när gamla bindningar bryts.
- En reaktion är exoterm om svagare bindningar byts ut mot starkare.
- En reaktion är endoterm om det kostar mer energi att bryta bindningar än vad som tillförs vid bindningsbildningen.
Bindningsenergier (mängden energi som måste tillföras för att bryta en bindning) är en viktig faktor när det gäller att avgöra om en reaktion kommer att ske. Bindningsstyrkor är inte alltid lätta att förutsäga, eftersom styrkan hos en bindning beror på ett antal faktorer. Många människor har dock gjort mycket arbete för att mäta bindningsstyrkor och de har samlat informationen i tabeller, så om du behöver veta hur stark en bindning är kan du bara slå upp den information du behöver.
| Bindning | Bindningsenergi (kcal/mol) | Bindning | Bindningsenergi (kcal/mol) |
| H-H | 104 | O-H | 111 |
| C-C | 83 | C-H | 99 |
| O=O | 119 | N-H | 93 |
| N=N | 226 | C=O | 180 |
Till exempel, Anta att du vill veta om förbränningen av metan är en exotermisk eller endotermisk reaktion. Jag gissar att den är exoterm, eftersom denna reaktion (och andra liknande) används för att ge värme till många hem genom förbränning av naturgas i ugnar.
Med ”förbränning” av metan menas att det förbränns i luft, så att det reagerar med syre. Produkterna vid förbränning av kolväten är främst koldioxid och vatten. Kolatomen i metan (CH4) införlivas i en koldioxidmolekyl. Väteatomerna införlivas i vattenmolekyler. Det finns fyra väteatomer i metan, så det räcker för att göra två H2O-molekyler.
- Fyra C-H-bindningar måste brytas vid förbränningen av metan.
- Fyra nya O-H-bindningar skapas när väteatomerna från metan läggs in i nya vattenmolekyler.
- Två nya C=O-bindningar bildas när kolet från metan läggs till i en CO2-molekyl.
Den andra pusselbiten är syrekällan för reaktionen. Syre finns i atmosfären främst som O2. Eftersom vi behöver två syreatomer i CO2-molekylen och ytterligare två syreatomer för de två vattenmolekylerna behöver vi totalt fyra syreatomer för reaktionen, vilket skulle kunna tillhandahållas av två O2-molekyler.
-
Två O=O-bindningar måste brytas för att tillhandahålla syreatomer till produkterna.
Totalt är det fyra C-H- och två O=O-bindningar som bryts, plus två C=O- och fyra O-H-bindningar som görs. Det är 4 x 99 kcal/mol för C-H-bindningarna och 2 x 119 kcal/mol för O=O-bindningarna, totalt 634 kJ/mol som tillförs. Reaktionen frigör 2 x 180 kcal/mol för C=O-bindningarna och 4 x 111 kcla/mol för OH-bindningarna, totalt 804 kcal/mol. Totalt sett frigörs 170 kcal/mol mer än vad som förbrukas.
Detta innebär att reaktionen är exotermisk, så den producerar värme. Det är förmodligen ett bra sätt att värma upp ditt hem.
