Dipolmomenter
Den asymmetriske ladningsfordeling i et polært stof som f.eks. HCl giver et dipolmoment, hvor \( Qr \) i meter (m). forkortes med det græske bogstav mu (µ). Dipolmomentet er defineret som produktet af den partielle ladning Q på de bundne atomer og afstanden r mellem de partielle ladninger.
Når et molekyle med et dipolmoment placeres i et elektrisk felt, har det tendens til at orientere sig med det elektriske felt på grund af sin asymmetriske ladningsfordeling (Figur \(\PageIndex{4}\)).
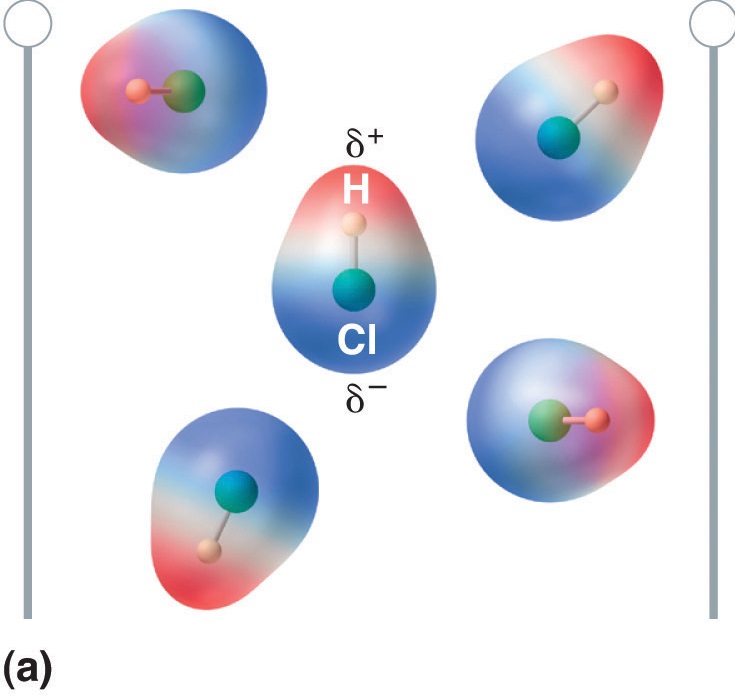
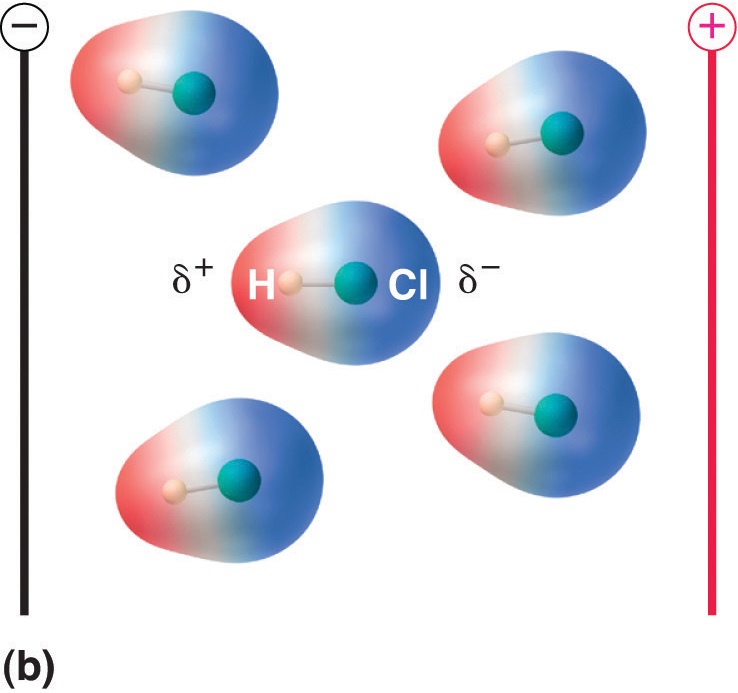
Figur \(\PageIndex{5}\): Molekyler, der besidder et dipolmoment, retter sig delvist ud med et påført elektrisk felt. I fravær af et felt (a) er HCl-molekylerne tilfældigt orienteret. Når der påføres et elektrisk felt (b), har molekylerne en tendens til at rette sig efter feltet, således at den positive ende af den molekylære dipol peger mod den negative terminal og omvendt.
Det målte dipolmoment for HCl viser, at H-Cl-bindingen har ca. 18 % ionisk karakter (0,1811 × 100) eller 82 % kovalent karakter. I stedet for at skrive HCl som
\
kan vi derfor angive ladningsadskillelsen kvantitativt som
\
Vores beregnede resultater er i overensstemmelse med elektronegativitetsforskellen mellem brint og klor χH = 2,20; χCl = 3,16, χCl – χH = 0,96), en værdi, der ligger godt inden for området for polære kovalente bindinger. Vi angiver dipolmomentet ved at skrive en pil over molekylet. Matematisk set er dipolmomenter vektorer, og de har både en størrelse og en retning. Et molekyls dipolmoment er vektorsummen af dipolerne for de enkelte bindinger. I HCl er dipolmomentet f.eks. angivet på følgende måde:
![]()
Pilen viser elektronstrømmenes retning ved at pege mod det mere elektronegative atom.
Ladningen på atomerne i mange stoffer i gasfasen kan beregnes ved hjælp af målte dipolmomenter og bindingsafstande. Figur \(\PageIndex{6}\) viser et plot af den procentvise ioniske karakter i forhold til forskellen i elektronegativitet for de bundne atomer for flere stoffer. Ifølge grafen er bindingen i arter som NaCl(g) og CsF(g) væsentligt mindre end 100 % ionisk af karakter. Når gassen kondenserer til et fast stof, øger dipol-dipol-interaktioner mellem polariserede arter imidlertid ladningsadskillelserne. I krystallen overføres der derfor en elektron fra metallet til ikke-metallet, og disse stoffer opfører sig som klassiske ionforbindelser. Dataene i figur \(\PageIndex{6}\) viser, at diatomare arter med en elektronegativitetsforskel på mindre end 1,5 har mindre end 50% ionisk karakter, hvilket er i overensstemmelse med vores tidligere beskrivelse af disse arter som indeholdende polære kovalente bindinger. Brugen af dipolmomenter til at bestemme den ioniske karakter af en polær binding er illustreret i eksempel \(\PageIndex{2}\).
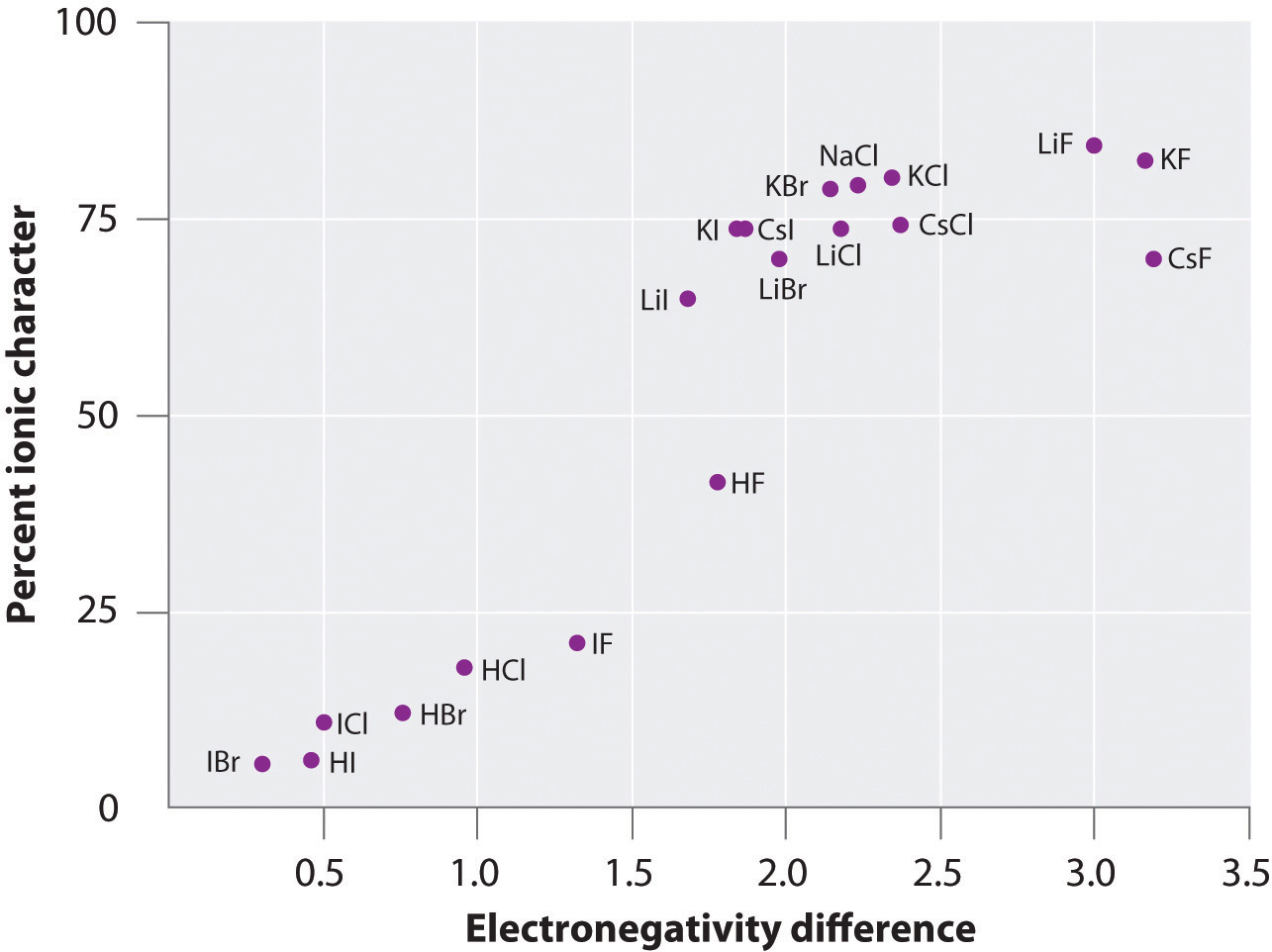
Figur \(\PageIndex{6}\): I gasfasen er selv CsF, som har den størst mulige forskel i elektronegativitet mellem atomerne, ikke 100 % ionisk, selv i gasfasen er selv CsF, som har den størst mulige forskel i elektronegativitet mellem atomerne, ikke 100 % ionisk. Fast CsF kan imidlertid bedst betragtes som 100 % ionisk på grund af de ekstra elektrostatiske vekselvirkninger i gitteret.
