Enthalpy
Thermodynamik er studiet af forholdet mellem varme (eller energi) og arbejde. Enthalpy er en central faktor i termodynamikken. Det er varmeindholdet i et system. Den varme, der passerer ind i eller ud af systemet under en reaktion, er entalpiændringen. Om systemets entalpi stiger (dvs. når der tilføres energi) eller falder (fordi der afgives energi) er en afgørende faktor, der bestemmer, om en reaktion kan finde sted.
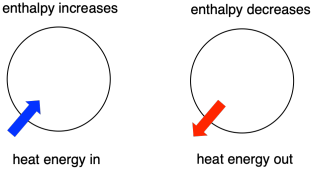
Sommetider kalder vi energien i de molekyler, der undergår en ændring, for “intern entalpi”. Nogle gange kalder vi den “systemets enthalpi”. Disse to udtryk henviser til den samme ting. På samme måde kaldes energien i de molekyler, der ikke deltager i reaktionen, for “ekstern enthalpi” eller “omgivelsernes enthalpi”.
Grovt sagt var de energiforandringer, som vi så på i introduktionen til termodynamikken, ændringer i entalpi. Vi vil i næste afsnit se, at der er en anden energimæssig faktor, entropi, som vi også skal tage hensyn til i reaktioner. Indtil videre vil vi blot se på enthalpien.
- Enthalpien er varmeindholdet i et system.
- Enthalpivandringen i en reaktion svarer nogenlunde til den mængde energi, der går tabt eller tilgår under reaktionen.
- En reaktion er begunstiget, hvis systemets enthalpi falder i løbet af reaktionen.
Dette sidste udsagn ligner meget beskrivelsen af energetik på den foregående side. Hvis et system gennemgår en reaktion og afgiver energi, så falder dets eget energiindhold. Det har mindre energi tilbage, hvis det afgav noget. Hvorfor ændres energien i et sæt molekyler, når der sker en reaktion? For at svare på det skal vi tænke på, hvad der sker i en kemisk reaktion.
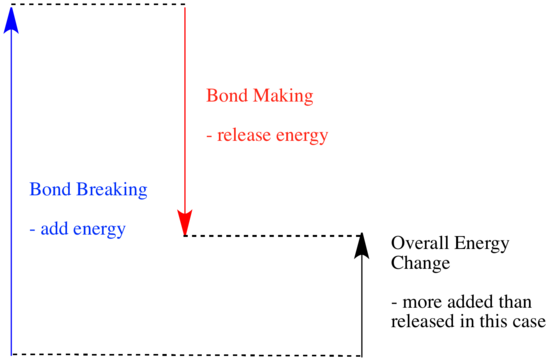
I en reaktion sker der en ændring i de kemiske bindinger. Nogle af bindingerne i reaktanterne brydes, og der dannes nye bindinger for at danne produkterne. Det koster energi at bryde bindinger, men der frigives energi, når der dannes nye bindinger.
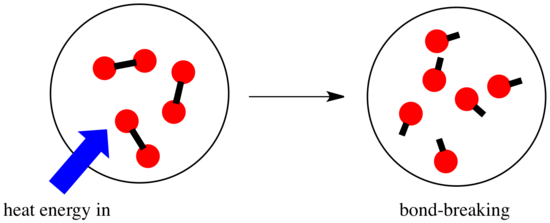
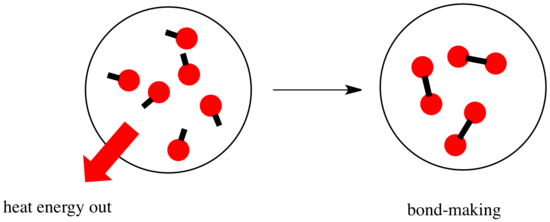
Hvorvidt en reaktion kan fortsætte, kan afhænge af balancen mellem disse bindingsdannende og bindingsbrydende trin.
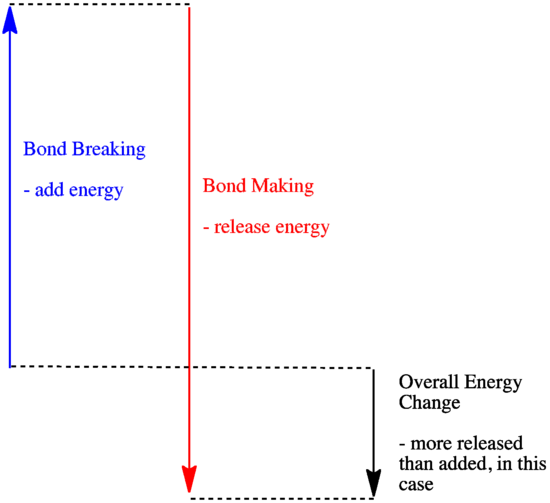
- En reaktion er eksoterm, hvis der frigives mere energi ved dannelse af nye bindinger, end der forbruges ved at bryde gamle bindinger.
- En reaktion er eksoterm, hvis svagere bindinger byttes til stærkere bindinger.
- En reaktion er endoterm, hvis bindingsbrydning koster mere energi, end der tilføres ved bindingsdannelse.
Bindingsenergier (den mængde energi, der skal tilføres for at bryde en binding) er en vigtig faktor for, om en reaktion vil finde sted. Bindingsstyrker er ikke altid lette at forudsige, fordi styrken af en binding afhænger af en række faktorer. Der er imidlertid mange mennesker, der har gjort et stort stykke arbejde med at måle bindingsstyrker, og de har samlet oplysningerne i tabeller, så hvis du har brug for at vide, hvor stærk en binding er, kan du bare slå de nødvendige oplysninger op.
| Binding | Bindelingsenergi (kcal/mol) | Binding | Bindelingsenergi (kcal/mol) |
| H-H | 104 | O-H | 111 |
| C-C | 83 | C-H | 99 |
| O=O | 119 | N-H | 93 |
| N=N | 226 | C=O | 180 |
Til eksempel, Lad os antage, at du ville vide, om forbrændingen af metan var en exotermisk eller endotermisk reaktion. Jeg vil gætte på, at det er eksotermisk, fordi denne reaktion (og andre lignende) bruges til at skaffe varme til masser af hjem ved at brænde naturgas i ovne.
Med “forbrænding” af metan menes der, at det forbrændes i luft, så det reagerer med ilt. Produkterne fra forbrænding af kulbrinter er for det meste kuldioxid og vand. Kulstofatomet i metan (CH4) bliver indlemmet i et kuldioxidmolekyle. Brintatomerne bliver indlemmet i vandmolekyler. Der er fire hydrogenatomer i metan, så det er nok til at lave to H2O-molekyler.
- Fire C-H-bindinger skal brydes ved forbrændingen af metan.
- Fire nye O-H-bindinger bliver dannet, når hydrogenerne fra metan bliver indlemmet i nye vandmolekyler.
- To nye C=O-bindinger dannes, når kulstoffet fra metan tilføjes i et CO2-molekyle.
Den anden brik i puslespillet er iltkilden til reaktionen. Oxygen findes i atmosfæren for det meste som O2. Da vi har brug for to oxygenatomer i CO2-molekylet og yderligere to oxygenatomer til de to vandmolekyler, har vi brug for i alt fire oxygenatomer til reaktionen, som kunne leveres af to O2-molekyler.
-
To O=O-bindinger skal brydes for at skaffe oxygenatomer til produkterne.
I alt er det fire C-H- og to O=O-bindinger, der er brudt, plus to C=O- og fire O-H-bindinger, der er lavet. Det er 4 x 99 kcal/mol for C-H-bindingerne og 2 x 119 kcal/mol for O=O-bindingerne, altså i alt 634 kJ/mol tilføjet. Reaktionen frigiver 2 x 180 kcal/mol for C=O-bindingerne og 4 x 111 kcla/mol for OH-bindingerne, i alt 804 kcal/mol. Samlet set er der 170 kcal/mol mere frigivet, end der forbruges.
Det betyder, at reaktionen er exotermisk, så den producerer varme. Det er sikkert en god måde at opvarme dit hjem på.
