Indledning
Kronisk obstruktiv lungesygdom (KOL) er en væsentlig årsag til dødelighed og sygelighed i hele den moderne verden. Dødeligheden af denne sygdom er stigende, og det forudsiges, at den vil blive den tredje største dødsårsag på verdensplan i 2020.1 Det er ikke muligt at definere KOL udelukkende på grundlag af det forcerede ekspiratoriske volumen i 1s (FEV1), så Global Initiative for Chronic Obstructive lung Disease (GOLD) har udarbejdet en multidimensionel definition til vurdering af KOL.2 Den nye definition omfatter ud over FEV1-værdien også prævalens af symptomer og den tidligere historie med eksacerbationer og lægger også vægt på vurdering af komorbiditeter. Til vurdering af symptomer anbefales enten den modificerede mMRC-test (modified Medical Research Council) eller CAT-testen (COPD Assessment Test). Derudover blev der anvendt en sygdomsspecifik skala for livskvalitet (SGRQ, SF-36, CCQ) til at vurdere sygdommens indvirkning på det daglige liv. Nogle undersøgelser har vist en stærk sammenhæng mellem CAT og St. George’s Respiratory Questionnaire (SGRQ).3,4 Ladeira et al.5 viste, at CAT var korreleret med BODE-indekset.
COPD er en kompleks sygdom og omfatter genetiske, cellulære og molekylære komponenter. Der er mange forskellige celler og molekyler involveret i de inflammatoriske veje. Flere indikatorer er blevet anvendt til at påvise en potentiel sygdomsrelateret systemisk inflammation.6-9 Luftvejs- og lungeparenkymbetændelse er en vigtig patogen mekanisme ved KOL. Desuden kan vedvarende systemisk inflammation være forbundet med forskellige ekstrapulmonale komorbiditeter og pulmonale virkninger.10 Nyere forskning har leveret beviser for eksistensen af en særskilt “ny systemisk inflammatorisk KOL-fænotype”. 7 I en nyere undersøgelse er det blevet vist, at kardiovaskulær comorbiditet og diabetes var forbundet med højere niveauer for nogle markører for systemisk inflammation.11 Derfor er genetisk belastning, systemisk inflammation og comorbiditetssygdomme forbundet med forskellige fænotyper i KOL. Det er vigtigt, at der udvikles nye perspektiver i behandlingen af denne sygdom.
For øjeblikket er CAT blevet anvendt i stigende grad til vurdering og overvågning af KOL. Selv om der er blevet defineret flere serumbiomarkører i KOL, findes der ikke én enkelt tilstrækkelig og effektiv enkelt biomarkør, der kan anvendes til at vurdere KOL-patienters status. Det er blevet vist, at biomarkører er forbundet med flere parametre såsom inflammation, hospitalsindlæggelse og dødelighed.7-13 Sammenhængen mellem CAT og biomarkører er imidlertid ikke blevet klart påvist. Derfor har den foreliggende undersøgelse til formål at undersøge niveauerne af systemisk inflammation i KOL og bestemme forholdet mellem CAT og inflammationsmarkører og livskvalitet.
Materiale og metoderStudieopbygning
Dette var en tværsnitsobservationsundersøgelse med et enkelt besøg. Et hundrede og ti patienter med KOL diagnosticeret i henhold til GOLD-kriterierne14 og femogtres kontrolpersoner blev rekrutteret mellem februar 2013 og august 2013. Kontrolpersoner blev udvalgt blandt dem, der blev henvist til en lungemedicinsk og internmedicinsk klinik på Balikesir Universitetshospital, og som gennemgik rutineundersøgelser. Der blev indhentet skriftligt informeret samtykke fra alle deltagere, og undersøgelsen blev godkendt af den institutionelle etiske komité for det medicinske fakultet på Balikesir Universitet.
Alle patienter blev underkastet fysisk undersøgelse, røntgenundersøgelse af brystet, respiratorisk funktionstest og rutinemæssige blodanalyseprøver. Antallet af eksacerbationer i det foregående år og rygehistorikken blev registreret. CAT, mMRC dyspnea score blev udført via personlige interviews af lungespecialister. SGRQ-scorerne blev rapporteret af patienterne. For den raske kontrolgruppe blev der kun foretaget en respiratorisk funktionstest og rutinemæssige blodanalyseprøver.
Undersøgelsens population
Inklusionskriterier: Patienterne blev inkluderet, hvis de; (1) var ældre end 40 år; (2) var nuværende eller tidligere rygere med en rygehistorie ≥10 pakkeår; (3) udviste en FEV1
80 % efter bronkodilator og en FEV1/FVC0,7. Kontrolpersoner blev inkluderet, hvis de: (1) var ældre end 40 år; (2) var fri for lungesygdom som bestemt af en læge; (3) havde en normal spirometri (FEV1>85 % og FEV1/FVC>0,7); og (4) havde en rygehistorie på
Udelukkelseskriterier: Patienter blev udelukket, som: (1) havde haft en eksacerbation af KOL inden for de foregående 6 uger; (2) havde en anden åndedrætsforstyrrelse end KOL eller malignitet; (3) havde en kronisk inflammatorisk sygdom (vaskulitis, inflammatorisk tarmsygdom, reumatoid arthritis osv.) (4) havde ukontrolleret eller alvorlig ledsagesygdom (MI, arytmi osv.).
Målinger
Demografiske træk, alder, køn, rygevaner, indlæggelse på en skadestue eller hospitalsindlæggelse i løbet af det seneste år, ledsagesygdomme og eksisterende behandlinger blev alle registreret på passende vis. Vi definerede en eksacerbation som forværring af symptomer, der krævede orale kortikosteroider og/eller antibiotika og/eller indlæggelse på hospitalet. Komorbide sygdomme blev fastlagt ved hjælp af den kliniske historie og de fysiske undersøgelsesresultater under besøget og blev understøttet af en gennemgang af de tilgængelige lægejournaler. Aktuel medicinering, herunder inhalatorer, antihypertensive midler eller anden medicin, blev dokumenteret. Højde, vægt og BMI-indeks blev målt, og der blev også foretaget spirometri i overensstemmelse med de internationale retningslinjer (ATS/ERS).15 Sygdommen blev klassificeret i henhold til den gamle og den nye version af GOLD-stadieringen.14 For det første GOLD-spirometrisk stadieinddeling (FEV1-baseret (1-4) stadieinddeling) og for det andet GOLD-stadieinddeling (A-D-klasse). Dyspnø blev vurderet ved hjælp af mMRC-dyspnøskalaen.16 Patienterne med KOL blev kategoriseret i A, B, C og D ved at kombinere symptomvurdering ved hjælp af mMRC-dyspnøscorer og exacerbationsrisiko.
CAT: Validiteten og pålideligheden af den tyrkiske version af denne skala er tidligere blevet verificeret.17 CAT omfatter 8 elementer og giver samlede scorer fra 0 til 40; højere scorer indikerer en mere alvorlig forringelse af sundhedstilstanden eller mindre vellykket kontrol af KOL.3
Quality of life Questionnaire (spørgeskema om livskvalitet): George’s Respiratory Diseases Questionnaire (SGRQ).18
Biomarkører
Vi valgte biomarkørerne på baggrund af tidligere undersøgelser.7,9-13 Blodprøverne fra alle forsøgspersoner blev centrifugeret og opbevaret ved -80°C. Alle prøver blev analyseret, når undersøgelsen var afsluttet. Serumet blev undersøgt i et diagnostisk apparat (BioTek, ELx 800, USA) med brug af kommercielle kits (eBioscience, Human TNF-α og Human IL-6 Platinum ELISA, Østrig) og med metoderne til tumornekrose alfa (TNF-α) og et interleukin-6 (IL-6)-niveau enzyme linked immunosorbent assay (ELISA). Niveauerne af C-reaktivt protein (CRP) blev vurderet med en klinisk kemisk analysator (Cobes Integra 800, Roche Diagnostics) ved hjælp af et kommercielt kit. Referenceværdien for CRP er 0-0,5 mg/L, mens den analyserede laveste værdi for IL-6 er 0,92 pg/ml. Den analyserede laveste værdi for TNFα er 2,3 pg/ml. TNF-α- og IL-6-koncentrationerne i nogle prøver var under den nedre grænse for kvantificering (LLQ). I analysen af personer med værdier under LLQ-grænsen blev der anvendt et nominelt niveau på halvdelen af LLQ-værdien for at undgå en skævhed nedad i populationsdataene.19
Statistisk analyse
De gennemsnitlige CRP-værdier for COPD- og kontrolgrupper (3,2 (1,5,7,1), 1,3 (0,6,2,7)) blev identificeret fra lignende undersøgelser.7 Herefter blev stikprøvestørrelsen i hver gruppe beregnet ved hjælp af en gennemsnitlig beregningsformel med 80 % nøjagtighed og 5 % fejl i hver gruppe. I overensstemmelse hermed blev det konstateret, at stikprøvestørrelsen var mindst 55 forsøgspersoner i hver gruppe. Resultaterne er præsenteret som gennemsnit ± SD, median eller procentdel, alt efter hvad der er relevant. Student’s t-test og ANOVA blev anvendt til parametriske test; Mann-Whitney U-test, Kruskal-Wallis- og chi-square-statistik blev anvendt til ikke-parametriske test til gruppesammenligninger. Fisher’s eksakte test evaluerede forskellene mellem procentdelene af komorbiditeter og forskellene mellem kønnene. Chi-kvadrat-testen evaluerede forskellene mellem procentdelene af komorbiditeter. Parvis korrelation af kontinuerte variabler hos patienter med KOL blev undersøgt ved hjælp af Pearson-korrelation. En værdi på p
0,05 blev betragtet som statistisk signifikant. Alle statistiske analyser blev udført med SPSS (version 20.0) software.ResultaterKlinisk karakterisering af forsøgspersoner
Undersøgelsen omfattede 110 patienter (gennemsnitsalder på 64±8,9 år; 100 mænd (90,9 %)) og 65 kontrolpersoner (gennemsnitsalder på 61,5±9,2 år, 55 mænd (84,6 %)). De demografiske og kliniske karakteristika for patient- og kontrolgrupperne er angivet i tabel 1. Femogfyrre (40,9 %) patienter med KOL havde en ledsagende sygdom (iskæmisk hjertesygdom (n=21), hypertension (n=13), diabetes mellitus (n=8), andet (n=3)). Den gennemsnitlige FEV1 var 48,8 % af den forudsagte værdi og den gennemsnitlige FEV1/FVC: 55,4 % i COPD-gruppen. Den gennemsnitlige CAT-score var 22,6 (±9,2), mMRC: 1,9 (±0,9) og den samlede SGRQ-score: 58,4 (±22,2). Af de 110 patienter var 9,1 % i stadie 1, 37,3 % i stadie 2, 42,7 % i stadie 3 og 10,9 % i stadie 4 i henhold til den spirometriske GOLD-stadieinddeling. Når patienterne blev klassificeret med hensyn til GOLD-stadiering, var 27,3 % i gruppe A, 30,9 % i gruppe B, 7,3 % i gruppe C og 34,5 % i gruppe D.
Demografiske, funktionelle, kliniske karakteristika for patient- og kontrolgrupperne.
| Patient (n=110) | Kontrol (n=65) | p-værdi | ||
|---|---|---|---|---|
| Age | 64.0±8.9 | 61.5±9.2 | 0,080 | |
| Han n, (%) | 100 (90,9) | 55 (84.6) | 0,224 | |
| BMI, kg/m2 | 26,5±5,6 | 25±2,6 | 0.064 | |
| Pack-år | 38,9±23 | 0,1±1,2 | ||
| Ko-morbiditeter, n (%) | ||||
| Enhver | 65 (59.1) | 42 (64,6) | 0,95 | |
| Iskæmisk hjertesygdom | 21(19,1) | 11 (16,9) | ||
| HT | 13 (11.8) | 6 (9.2) | ||
| DM | 8 (7.3) | 4 (6.2) | ||
| Andre | 3 (2.7) | 2 (3.1) | ||
| mMRC | 1,94±0,9 | 0,04±0,2 | ||
| FEV1, % forudsagt | 48,8±17.8 | 89,4±5,6 | ||
| FVC, % forudsagt | 68,7±17,8 | 92,1±5,8 | ||
| FEV1/FVC, % | 55.4±12,9 | 89,6±4,7 | ||
| GOLD spirometrisk stadium, n (%) | ||||
| 1 | 10 (9.1) | |||
| 2 | 41 (37.3) | |||
| 3 | 47 (42.7) | |||
| 4 | 12 (10.9) | |||
| GULDstadie, n (%) | ||||
| A | A | 30 (27.3) | ||
| B | 34 (30.9) | |||
| C | 8 (7.3) | |||
| D | 38 (34.5) | |||
| SGRQ-totalscore | 58,4±22,2 | |||
| CAT-score | 22.6±9,2 | |||
| TNFα (pg/ml) | 109,5±58 | 14,6±18 | ||
| IL-6 (pg/ml) | 10.3±18 | 2,14±1,9 | ||
| CRP (mg/L) | 1,6±1,7 | 0,4±0,3 | ||
Afkortninger: BMI, body mass index, HT: hypertension, DM: diabetes, FEV1: forceret ekspiratorisk volumen i 1 sekund, FVC: forceret vital kapacitet, CAT: COPD assessment test.
COPD/kontrol sammenligninger
Der var ingen signifikant forskel mellem alder (p=0,080, Student’s t-test) og køn i de to grupper (p=0,453, fisher’s exact test) (tabel 1). Grupperne udviste lignende forekomst af komorbiditeter (p=0,095, χ2-test). Som forventet havde KOL-patienter signifikant lavere lungefunktionsparametre (FEV1, FVC, FEV1/FVC) sammenlignet med kontroller (p
0,001, Student’s t-test). Generelt udviste KOL-patienter højere serumniveauer af CRP (1,6±1,7mg/L) og TNF-α (109,5±58pg/ml) og IL-6 (10,3±18pg/ml) end raske kontroller (CRP: 0,4±0,3mg/L, p0,001; TNF-α: 14,6±18pg/ml, p0,001; IL-6: 2,14±1,9pg/ml, p0,001, Student’s t-test) (tabel 1).Association af CAT-spørgeskemaer og patientkarakteristika
Der var en korrelation mellem CAT-score og GOLD-spirometrisk stadium (Pearson’s r=0,43; p
0,001). CAT-score steg parallelt med sygdommens sværhedsgrad. Der var en statistisk signifikant sammenhæng mellem CAT-score og antallet af eksacerbationer i det foregående år (Pearsons r=0,35, p0,001), sygdomsvarighed (Pearsons r=0,29, p0,001), rygning (pakke-år) (Pearsons r=0,27, p=0,014) og mMRC (Pearsons r=0,59, p0,001). CAT-score viste sig at være signifikant korreleret med FEV1 (Pearson’s r=-0,39, p0,001) og FVC (Pearson’s r=-42, p=0,003). Samtidig blev der observeret en stærk korrelation mellem CAT-score og SGRQ-symptom-, aktivitets-, effekt- og totalscoren (Pearsons r=0,72; p0,001).Association mellem biomarkører og patientkarakteristika
Inflammatoriske markører og lungefunktionsparametre blev sammenlignet. Efterhånden som FEV1 faldt, steg niveauerne af biomarkørerne signifikant. CRP-niveauerne var korreleret med FEV1 (Pearson’s r=-0,39, p
0,001), FVC (Pearson’s r=-0,33, p0,001) og FEV1/FVC (Pearson’s r=-0,38, p0,001). TNF-α-niveauerne var også korreleret med FEV1 (Pearson’s r=-0,57, p0,001), FVC (Pearson’s r=-0,37, p0,001) og FEV1/FVC (Pearson’s r=-0,66, p0,001). IL-6-niveauerne var også korreleret med FEV1 (Pearson’s r=-0,31, p0,001), FVC (Pearson’s r=-0,32, p0,001) og FEV1/FVC (Pearson’s r=-0,34, p0,001). Der blev observeret en signifikant korrelation mellem CRP, TNF-α, IL-6 og rygning (pakkeår) (Pearson’s r=0,35, r=0,44, r=0,27, p0,001, henholdsvis). KOL-patienter med kardiovaskulær sygdom havde et forhøjet CRP-niveau (2,98±2.4mg/L) sammenlignet med patienter uden komorbiditeter (1,56±1,5mg/L, p=0,008 ANOVA-test efterfulgt af LSD post hoc-test). Der var ingen signifikant sammenhæng med andre biomarkører og komorbiditeter. Efterhånden som IL-6 steg, steg mMRC-score, men denne sammenhæng var ikke statistisk signifikant (p=0,06). Da inflammatoriske markører blev sammenlignet med CAT-score, viste CRP-niveauerne sig at have en signifikant korrelation (r=0,43, p0,001) (Fig. 1), mens der ikke blev observeret nogen korrelation med TNF-α og IL-6. Der var en korrelation mellem CRP-niveauerne og TNFα (r=0,48, p0,001). Der blev ikke observeret nogen direkte sammenhæng mellem biomarkører og A-D klasse eller spirometriske stadier.
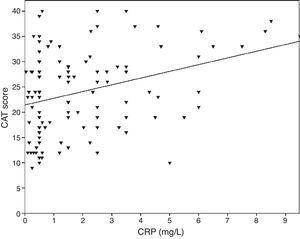
Sammenhængen mellem CAT-score og CRP (r=0,43, p0,001).
Diskussion
Der anvendes nogle vurderingsværktøjer såsom kliniske test (CAT, BODE), inflammationsmarkører og spørgeskemaer om livskvalitet til at vurdere KOL. Det er almindeligt accepteret, at en multidimensionel vurdering er nødvendig for at forstå og håndtere sygdommen. KOL er en kompleks lidelse med en systemisk komponent, og nogle patienter synes at have en inflammatorisk fænotype. I denne undersøgelse blev CAT udført som en ny klinisk test, og forholdet mellem CAT og andre KOL-komponenter blev undersøgt.
En af disse komponenter er systemisk inflammation. De biomarkører, der oftest undersøges i KOL for at indikere systemisk inflammation, og som almindeligvis anvendes, er CRP, IL-6, TNF-α, IL-8 og fibrinogen. Flere undersøgelser har tidligere rapporteret om forhøjede cirkulerende niveauer af disse markører hos patienter med stabil KOL.6-9,20-23 I en nyere undersøgelse viste Agustí et al. at 30 % af KOL-patienterne ikke havde tegn på systemisk inflammation, og at 16 % af patienterne havde vedvarende systemisk inflammation.7 Interessant nok viste det sig i denne undersøgelse, at serumniveauerne af TNF-α og IL-8 var højere hos rygere med normal spirometri sammenlignet med KOL-patienter. De andre markører som hvide blodlegemer, IL-6, CRP og fibrinogen blev fundet højere hos KOL-patienter end hos rygere med normal spirometri og ikke-rygere. I vores undersøgelse var niveauerne af CRP, TNF-α og IL-6 signifikant højere hos alle KOL-patienter sammenlignet med kontrolgruppen. Alle biomarkører viste sig at være korreleret med den kumulative rygningseksponering og reduktion af parametre for lungefunktionstest (FEV1, FVC og FEV1/FVC). Biomarkørernes niveau hænger sammen med graden af luftvejsobstruktion. Disse resultater stemmer overens med dem, der er rapporteret i tidligere tværsnitsundersøgelser.13 I en anden undersøgelse, der undersøgte resultaterne af ECLIPSE, var kardiovaskulære comorbiditeter og diabetes korreleret med nogle systemiske inflammationsmarkører.9 I vores undersøgelse havde KOL-patienter med kardiovaskulære sygdomme et forhøjet CRP-niveau sammenlignet med patienter uden comorbiditeter. Øget systemisk inflammation i KOL med kardiovaskulære sygdomme understøtter en patofysiologisk mekanisme mellem KOL og disse komorbiditeter.
Sammenhængen mellem KAT og systemisk inflammation er ikke blevet afklaret af de undersøgelser, der er gennemført indtil nu. I en undersøgelse blev der vist en signifikant korrelation mellem LCN1, LCN2 og CAT.8 I vores undersøgelse er der vist en signifikant sammenhæng mellem CAT og CRP. Der kunne dog ikke påvises en lignende sammenhæng med TNF-α og IL-6.
I den foreliggende undersøgelse blev KOL-patienterne kategoriseret i fire grupper (A-D) og stadier (1-4) i henhold til den gamle og nye version af GOLD-klassifikationen. Det kan konstateres, at stadie 1 og stadie 4 udgør den mindste andel af populationen med 10 % hver i henhold til den gamle klassifikation. I den nye version var populationen næsten ligeligt fordelt på gruppe A, B og D; den mindste fordeling var gruppe C. I andre undersøgelser er det også blevet vist, at gruppe C udgør den mindste andel af fordelingen.24,25 Den nye klassifikation viser, at der kan være nogle patienter med mange symptomer, men med mild luftvejsobstruktion, samt nogle patienter med få symptomer, men med alvorlige luftvejsobstruktioner. Komorbiditeter og systemisk inflammation kan føre til forøgelse af eksacerbation og symptomer hos patienter med let/moderat obstruktion, og på denne måde medfører det, at disse patienter placeres i højrisikogrupperne (C- eller D-klassen). I en undersøgelse blev det vist, at subtype C omfatter patienter med højere komorbiditetsstatus, og subtype D omfatter patienter med den alvorligste eksacerbation, en høj exacerbationsrate i forbindelse med indlæggelse og de dårligste resultater26 . I en nyere undersøgelse sammenlignede Agustí et al. to grupper med og uden vedvarende systemisk inflammation og viste, at patienter, der præsenterede vedvarende inflammation under opfølgningen, havde en øget exacerbationsrate pr. år sammenlignet med den anden gruppe, selv om de pulmonale abnormiteter var ens i disse to grupper.7
GOLD anbefaler brug af CAT- eller mMRC-skalaen til at vurdere symptomer. Vi brugte mMRC-skalaen til gruppetildeling, fordi når vi betragtede symptomerne på grundlag af CAT, var antallet af patienter med mindre end 10 brudpunkter meget lille (8 patienter). De højere CAT-scoringer kan være forbundet med de højere opfattelser af patienternes symptomer. Det blev også vist, at CAT og mMRC ikke er ækvivalente, og dette kan forårsage nogle forskelle i klassifikationen.24,25,27 I den nye klassifikation er de andre skæringspunkter sammensat af antal eksacerbationer pr. år. Sammenhængen mellem basal CAT-score og hyppigheden af exacerbationer blev vist hos KOL-patienter.28 Pothirat et al. har vist, at ændringen i CAT-score under overvågningsbesøg er et nyttigt redskab til at påvise akut forringelse af KOL-patienters sundhedstilstand.29 I vores undersøgelse blev der observeret en stærk sammenhæng mellem CAT, mMRC og exacerbationshyppigheden. CAT blev også fundet at være korreleret med sygdomsvarigheden og rygning (pakkeår). Patienternes gennemsnitlige FEV1-værdi blev fundet at være 48,8 % af den forudsagte værdi, og den gennemsnitlige CAT-score var 22,6. Der blev påvist en stærk sammenhæng mellem CAT og FEV1, FVC og det spirometriske GOLD-stadie. I takt med at FEV1 og FVC faldt, steg CAT-scoren. CAT-scoren korrelerede også positivt med et tungere GOLD-stadium. Disse resultater viser, at CAT afspejler sygdommens sværhedsgrad meget godt.
En anden vigtig komponent i KOL-behandling er livskvalitet. Der er blevet anvendt en række livsspørgeskemaer til at vurdere sygdommens indvirkning på det daglige liv. Det er blevet bevist, at den tyrkiske version af SGRQ er pålidelig og gyldig.30 Nogle få undersøgelser har vist, at der blev observeret en signifikant korrelation mellem CAT og SGRQ.3,4 I en undersøgelse er det blevet rapporteret, at CAT er følsom over for ændringer i sundhedstilstanden i forbindelse med KOL-eksacerbationer.31 I vores undersøgelse blev der påvist en stærk sammenhæng mellem CAT og SGRQ. Da CAT sammenlignet med SGRQ er en kortere og lettere test at forstå, er brugen af CAT mere praktisk.
Denne undersøgelse har flere begrænsninger, såsom tværsnitsdesign, en enkelt centerundersøgelse og en lille stikprøvestørrelse. Desuden kunne inflammationsmarkørerne ikke sammenlignes hos rygere, der har normal lungefunktion, fordi de ikke blev inkluderet i den foreliggende undersøgelse. Patienternes medicinering kan udøve en indflydelse på det systemiske inflammationsrespons og sundhedstilstanden, og de kan også påvirke resultaterne.
Sammenfattende er CAT en test, der kan anvendes til vurdering af KOL, da dens pålidelighed og gyldighed er blevet klart påvist. Resultaterne af vores undersøgelse viser sammenhængen mellem CAT og CRP samt andre KOL-komponenter (kliniske, funktionelle parametre). Der er dog behov for longitudinale multicenterundersøgelser for at evaluere forholdet mellem CAT og biomarkører.
Etiske oplysningerBeskyttelse af mennesker og dyr
Forfatterne erklærer, at der ikke blev udført forsøg på mennesker eller dyr i forbindelse med denne undersøgelse.
Fortrolighed af data
Forfatterne erklærer, at de har fulgt deres arbejdscenters protokoller om offentliggørelse af patientdata, og at alle de patienter, der indgik i undersøgelsen, modtog tilstrækkelige oplysninger og gav deres skriftlige informerede samtykke til at deltage i undersøgelsen.
Ret til privatlivets fred og informeret samtykke
Forfatterne har indhentet skriftligt informeret samtykke fra de patienter eller forsøgspersoner, der er nævnt i artiklen. Den tilsvarende forfatter er i besiddelse af dette dokument.
Autorskab
Studiedesign: NS, FE og AAH; Dataindsamling: NS, CB; Dataanalyse og fortolkning: NS, AAH og CB; Kritisk revision af manuskriptet: NS, AAH og CB; Kritisk revision af manuskriptet: NS, AAH og CB: NS, FE, CB og AAH.
Interessekonflikter
Forfatterne erklærer, at de ikke har nogen interessekonflikter i forbindelse med udarbejdelsen af dette manuskript.
