US Pharm. 2020;45(5)(Specialty&Oncology suppl):3-8.
ABSTRACT: Under de senaste åren har flera nya riktade behandlingsalternativ utvecklats för att bekämpa resistens mot traditionell endokrin behandling av avancerad bröstcancer. Tre CDK4/6-hämmare (palbociclib, ribociclib och abemaciclib) har godkänts för patienter med hormonreceptorpositiv, human epidermal tillväxtfaktorreceptor 2-negativ avancerad bröstcancer. Varje medel har visat sin effekt, men det finns skillnader mellan de tre läkemedlen, särskilt i deras biverkningsprofiler.
Bröstcancer är den vanligaste typen av cancer hos kvinnor, med mer än 276 000 nya fall beräknade år 2020.1 Hormonreceptorpositiv (HR+) bröstcancer, som står för mer än 70 % av dessa fall, har historiskt sett behandlats med endokrin terapi (ET), såsom selektiva östrogenreceptorhämmare och aromatashämmare (AIs). Även om ET fortfarande är ryggraden i behandlingen av HR+-bröstcancer utvecklas resistens hos upp till 50 % av patienterna med avancerad bröstcancer.2 För att bekämpa resistens har riktade terapier godkänts för HR+-bröstcancer.3,4
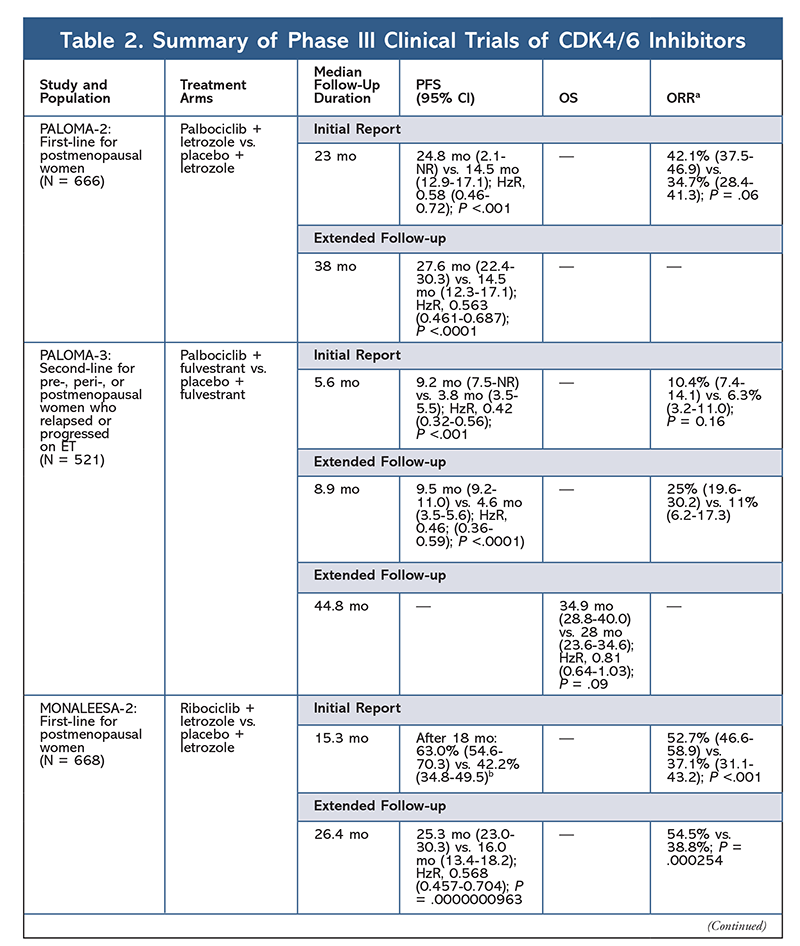
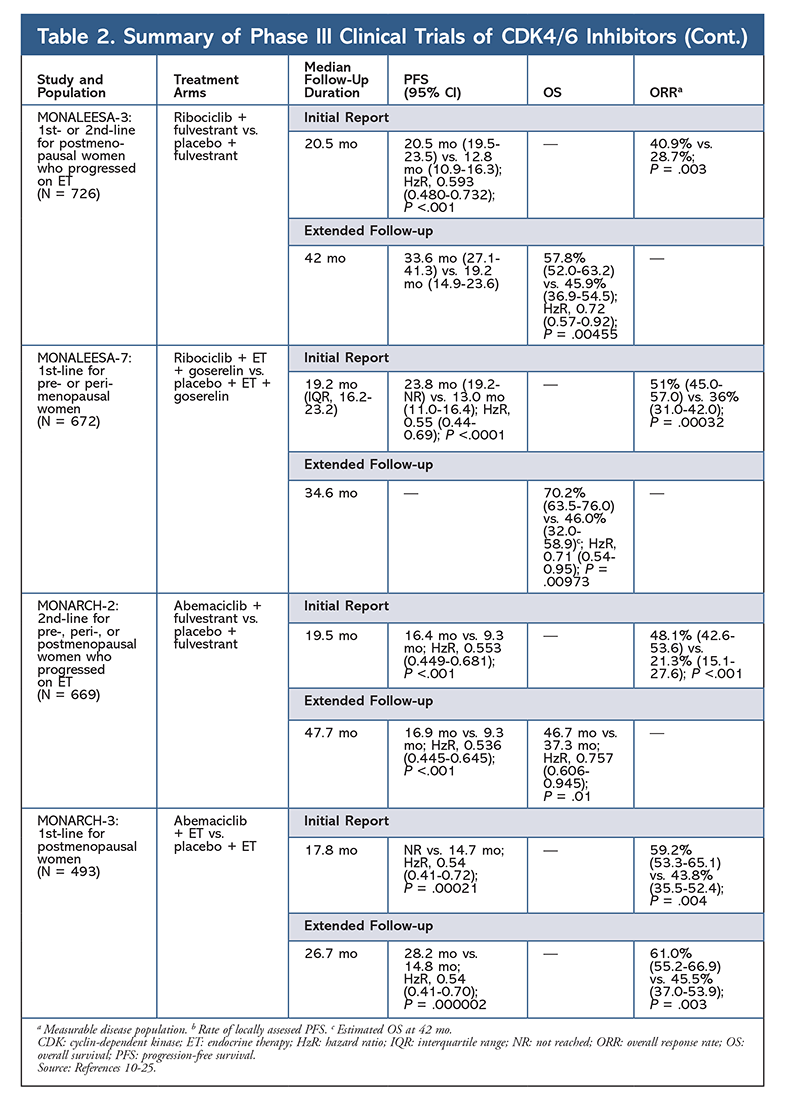
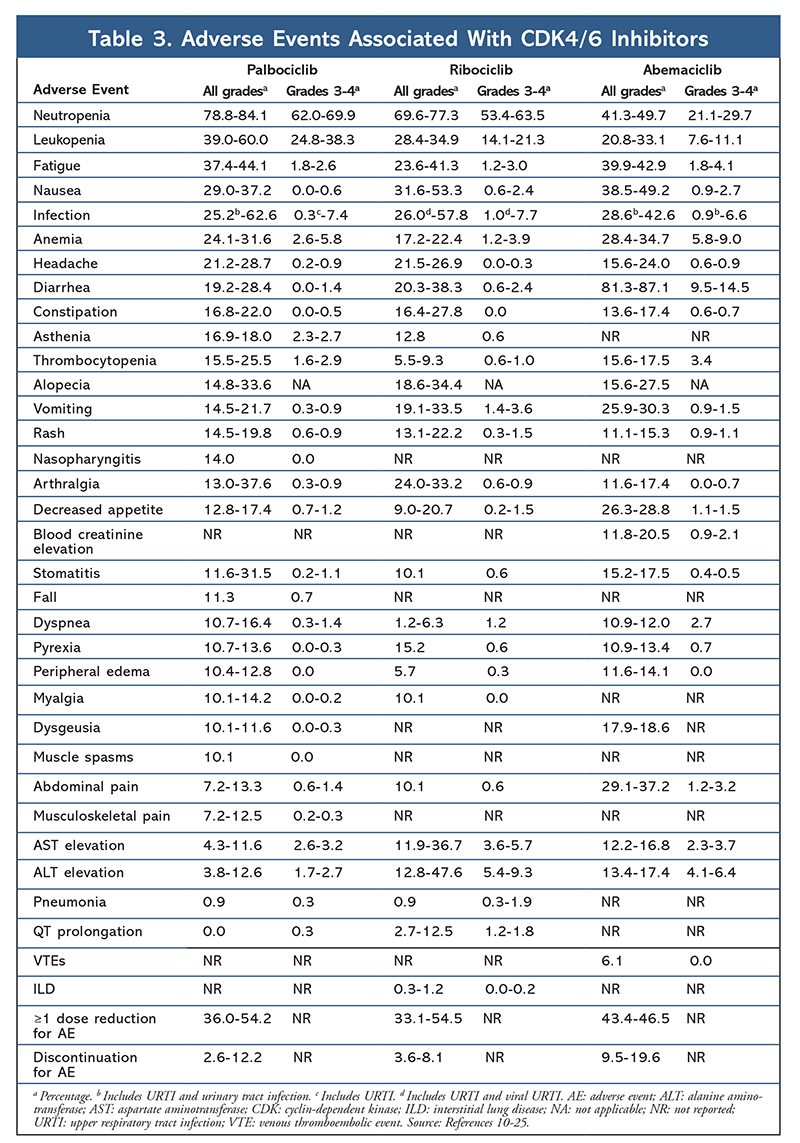
Cyclinberoende kinashämmare (CDK-hämmare), den nyaste klassen av intresse för avancerad bröstcancer, fungerar genom att specifikt hämma CDK4/6-proteiner och blockera övergången från G1- till S-fasen i cellcykeln. Denna läkemedelsklass hämmar kinasaktivitet, som fosforylerar retinoblastoma-proteinvägen. Genom att blockera denna väg kan CDK4/6-hämmare blockera cellcykelutvecklingen i mitten av G1-fasen och förhindra cancercellens utveckling. På senare år har tre CDK4/6-hämmare (palbociclib, ribociclib och abemaciclib) godkänts som kombinationsbehandlingar för HR+, human epidermal tillväxtfaktorreceptor 2-negativ (HER2-), avancerad eller metastaserande bröstcancer5-8. I den här artikeln granskas dessa medels skillnader (TABELL 1), kliniska fas III-studier (TABELL 2) och biverkningsprofiler (AE) (TABELL 3).
Palbociclib
Under 2015 blev palbociclib den första CDK4/6-hämmaren som fick FDA-godkännande för behandling av HR+, HER2-bröstcancer (i kombination med en AI som initial ET hos postmenopausala kvinnor eller hos män eller i kombination med fulvestrant hos patienter med sjukdomsprogress efter ET).6,9-14 Palbociclib fick ursprungligen godkännande efter positiva resultat från fas II-studien PALOMA-1, som jämförde palbociclib plus letrozol med enbart letrozol som initial behandling av ET-naiva avancerade bröstcancerpatienter9.
Dessa resultat ledde till två fas III-studier som ytterligare utvärderade palbociclibs effekt i denna patientpopulation. De första resultaten från PALOMA-2 bekräftade effekterna av palbociklib plus letrozol och visade på förbättrad progressionsfri överlevnad (PFS) jämfört med enbart letrozol (24,8 mån respektive 14,5 mån; hazardkvot för sjukdomsprogression eller död, 0,58; 95 % KI, 0,46-0,72; P <.001). En långtidsuppföljningsstudie vid 38 månader bekräftade ytterligare palbociklibs effekt på PFS, med en ökning till 27,6 månader jämfört med 14,5 månader för enbart letrozol (HzR, 0,563; 95 % KI, 0,461-0,687; P <.0001). Uppföljningsstudien rapporterade också en konsekvent förbättring av PFS med palbociclib plus letrozol i alla studerade undergrupper, samt fördröjd mediantid till initiering av efterföljande behandling. Data om total överlevnad (OS) för de första och uppföljningsrapporterna var dock omogna, och inskrivna patienter följs för överlevnad.10,11
Kort efter starten av PALOMA-2 påbörjades en annan fas III-studie, PALOMA-3, för att utvärdera säkerheten och effekten av palbociclib plus fulvestrant hos premenopausala eller postmenopausala kvinnor med HR+ avancerad bröstcancer som progredierat på tidigare ET. Den första rapporten efter 5,6 månaders uppföljning visade en förbättring av median PFS (9,2 mo vs 3,8 mo), med en 58 % minskning av progression (HzR, 0,42; 95 % KI, 0,32-0,56; P <.001).12 En förspecificerad analys av OS i PALOMA-3-studien, med en medianuppföljning på 44.8 månader, fann att skillnaderna i OS för hela intent-to-treat-gruppen inte nådde statistisk signifikans, men att kombinationen förlängde OS med 10 månader hos patienter som var känsliga för tidigare ET.14
Elderbioprofilen förblev konsekvent i alla prövningsrapporter (TABELL 3), med allgradig neutropeni (78,8 %-84,1 %), leukopeni (39 %-60 %) och trötthet (37,4 %-44,1 %) som de mest frekventa rapporterade biverkningarna. Frekvensen av neutropeni var hög; febril neutropeni var dock sällsynt (upp till 2 %). Den övergripande tolerabiliteten för palbociclib ansågs vara hanterbar, och medlet resulterade i positiva livskvalitetsdata när det användes i kombinationsterapi jämfört med endokrin monoterapi.9,14
Ribociclib
En andra CDK4/6-hämmare, ribociclib, godkändes av FDA 2017 med en bredare indikerad patientpopulation. Ribociclib är godkänt för postmenopausala och pre- eller perimenopausala kvinnor med HR+, HER2- avancerad eller metastaserande bröstcancer (som kombinationsbehandling med en AI som initial ET eller, hos postmenopausala kvinnor, i kombination med fulvestrant som initial ET eller efter sjukdomsprogression på ET).7
Ribociclib fick först ett FDA-godkännande efter att studien MONALEESA-2 visade att PFS förbättrades när läkemedlet gavs i kombination med letrozol jämfört med enbart letrozol. Raterna för lokalt bedömd PFS jämfört med enbart letrozol efter 18 månader var 63,0 % (95 % KI, 54,6-70,3) respektive 42,2 % (95 % KI, 34,8-49,5).15 En utökad uppföljningsrapport efter 26,4 månader visade ytterligare på kombinationens effekt och tolerabilitet.16 Trots förbättringen av PFS är OS-data för MONALEESA-2 fortfarande omogna.
Ribociclib undersöks också (i MONALEESA-3) i kombination med fulvestrant hos behandlingsnaiva patienter och de som fått återfall efter ET. Den första rapporten visade en förbättrad PFS för kombinationen jämfört med enbart fulvestrant (20,5 mån respektive 12,8 mån; HzR, 0,593; 95 % KI, 0,480-0,732; P <.001), vilket resulterade i FDA-godkännande av denna kombination.17 En andra, och den senaste, rapport om CDK4/6-hämmare, med ytterligare 21,6 månaders uppföljning, visade ytterligare på den konsekventa PFS-förbättringen. Denna rapport bevisade också OS-fördelen med ribociclib plus fulvestrant jämfört med enbart fulvestrant, med en uppskattad OS vid 42 månader på 57,8 % respektive 45,9 % och en 28 % minskning av den relativa risken för dödsfall (HzR, 0,72; 95 % KI, 0,57-0.92; P = .00455).18
En tredje klinisk studie, MONALEESA-7, är för närvarande den enda fas III-studien som utvärderar effekt och säkerhet av en CDK4/6-hämmare som första linjebehandling för pre- eller perimenopausala kvinnor som har metastaserad bröstcancer. I denna studie förbättrade ribociclib plus tamoxifen eller en icke-steroidal AI (NSAI) – såsom letrozol eller anastrozol – plus goserelin signifikant PFS med 23,8 månader jämfört med 13 månader för placebogruppen (HzR, 0,55; 95 % KI, 0,44-0,69; P <.0001), och kombinationen ledde till den utökade indikationen som omfattar pre- och perimenopausala kvinnor19. En utökad uppföljningsrapport visade att kombinationen ribociclib plus tamoxifen eller en NSAI plus goserelin gav en OS-fördel jämfört med placebo, med en uppskattad 42-månaders OS på 70,2 % jämfört med 46,0 %.20
Toxicitetsprofilen för ribociclib liknar i hög grad den för palbociclib, med neutropeni och leukopeni som de högst rapporterade allklassiga och allvarliga (grader 3/4) AE:erna, även om det skedde i lägre grad än för palbociclib (TABELL 3).15-20 Febril neutropeni var sällsynt, och inga nya säkerhetsproblem uppstod vid längre exponering för ribociklib i någon av de förlängda uppföljningsrapporterna.
Abemaciclib
Den tredje CDK4/6-hämmaren som godkänts av FDA är abemaciclib. Detta medel är indicerat i kombination med en AI som initial ET hos postmenopausala kvinnor med avancerad bröstcancer, eller i kombination med fulvestrant hos pre-, peri- eller postmenopausala kvinnor med sjukdomsprogression efter ET. Abemaciclib är också godkänt som monoterapi hos män och kvinnor med sjukdomsprogression efter ET och tidigare kemoterapi i metastatisk miljö.6 Medlet fick ursprungligen godkännande baserat på resultat från MONARCH-1 som visade lovande klinisk aktivitet efter 12 månader, med en total svarsfrekvens (ORR) på 19,7 % (95 % KI, 13,3-27,5) och en median PFS på 6 månader.5,21 Under denna tid undersöktes abemaciclib också i MONARCH-2 för pre-, peri- och postmenopausala kvinnor som progredierat efter ET. Denna studie visade en statistiskt signifikant PFS-fördel med en kombination av abemaciclib plus fulvestrant jämfört med enbart fulvestrant (16,4 mån jämfört med 9,3 mån; HzR, 0,553; 95 % KI, 0,449-0,681; P <.001).22 En utökad uppföljningsstudie med en medianlängd på 47.7 månader rapporterade något förbättrade PFS-resultat och OS-fördelar med abemaciclibkombinationen jämfört med placebo och fulvestrant (46,7 mo vs 37,3 mo; 95 % KI, 0,606-0,945; P = 0,01).23
Kort efter att de två abemaciclibstudierna hade inletts påbörjades MONARCH-3. I denna studie fann man en statistiskt signifikant förbättring av PFS och ORR med abemaciclib plus ett NSAI jämfört med placebo-plus-NSAI-armen som förstahandsbehandling för postmenopausala kvinnor. En uppdaterad rapport med 8,9 månaders ytterligare uppföljning bekräftade ytterligare PFS- och ORR-resultaten från den första analysen; OS-data är dock fortfarande omogna och slutlig OS-analys kommer att genomföras efter 315 händelser.24,25
Totalt sett har abemaciclib noterats vara den mest potenta CDK4/6-hämmaren med utmärkt aktivitet i det centrala nervsystemet på grund av sin struktur, vilket gör det möjligt för den att passera blod-hjärnbarriären och förbli på målet längre.5 Detta kan vara fördelaktigt för patienter med hjärnmetastaser. Även om abemaciclib också har höga procentsatser av hematologiska AE, är dessa procentsatser mycket lägre än för andra CDK4/6-hämmare. Abemaciclib är förknippat med fler gastrointestinala toxiciteter, såsom diarré, än andra CDK4/6-hämmare (alla grader: 81,3 %-87,1 %; grader 3-4: 9,5 %-14,5 %).22-25
Apotekens roll
Övergripande är AE-profilerna för de olika CDK 4/6-hämmarna likartade, men varje läkemedel har unika AE:er. De vanligaste AE som rapporterats med CDK4/6-hämmare är neutropeni, leukopeni, trötthet, illamående, infektion, artralgi, anemi, huvudvärk och diarré (TABELL 3). Förutom neutropeni och leukopeni rapporterade majoriteten av patienterna AE av grad 1 eller 2. Neutropeni och leukopeni av grad 3 eller 4, som var mycket vanliga med alla CDK-hämmare, särskilt palbociclib och ribociclib, hanterades mestadels med dosavbrott och/eller minskning. Patientens CBC bör kontrolleras vid baslinjen, varannan vecka under de två första cyklerna, i början av varje efterföljande fyra cykler och vid kliniskt behov för benmärgssuppression.6-8 Fall, muskelspasmer och nasofaryngit är förknippade med palbociklib, men är lindriga i de flesta fall.10,11,14 En låg incidens av QT-förlängning har rapporterats med ribociclib.15-20 Abemaciclib var förknippat med en signifikant högre incidens av diarré jämfört med palbociclib och ribociclib; fallen inträffade oftast under den första cykeln och kunde hanteras med antidiarrébehandling.22-25 Abemaciclib förknippades med serumkreatininförhöjning och venösa tromboemboliska händelser (mestadels milda), som inte rapporterades för palbociclib och ribociclib, och en högre incidens av buksmärta.22-25 Framför allt varnade FDA i september 2019 för att sällsynta men allvarliga, livshotande eller dödliga interstitiella lungsjukdomar (ILD) och pneumonit kan förekomma hos patienter som behandlas med CDK4/6-hämmare.26 Därför bör patienterna övervakas regelbundet med avseende på pulmonella symtom som indikerar ILD och/eller pneumonit.
Slutsats
De senaste årens godkännanden av palbociclib, ribociclib och abemaciclib har utökat behandlingsalternativen för patienter med avancerad bröstcancer. Även om de alla har samma verkningsmekanism har dessa läkemedel små skillnader i effekt och säkerhet. Ett antal pågående studier utöver de som nämns i denna översikt fortsätter att utforska dessa hämmare i olika patientpopulationer och med olika behandlingskombinationer. Potentialen hos dessa medel att utöka användningen av CDK4/6-hämmare till andra miljöer än HR+, HER2- avancerad bröstcancer verkar lovande.27
1. Siegel RL, Miller KD, Jemal A. Cancerstatistik 2020. CA Cancer J Clin. 2020;70(1):7-30.
2. Preusser M, De Mattos-Arruda L, Thill M, et al. CDK4/6-hämmare vid behandling av patienter med bröstcancer: sammanfattning av ett tvärvetenskapligt rundabordssamtal. ESMO Open. 2018;3(5):e000368.
3. Tripathy D, Bardia A, Sellers WR. Ribociclib (LEE011): verkningsmekanism och klinisk inverkan av denna selektiva cyklinberoende kinas 4/6-hämmare i olika solida tumörer. Clin Cancer Res. 2017;23(13):3251-3262.
4. Portman N, Alexandrou S, Carson E, et al. Overcoming CDK4/6 inhibitor resistance in ER-positive breast cancer. Endocr Relat Cancer. 2019;26(1):R15-R30.
5. Sobhani N, D’Angelo A, Pittacolo M, et al. Updates on the CDK4/6 inhibitor strategy and combinations in breast cancer. Cells. 2019;8(4):E321.
6. Ibrance (palbociclib) bipacksedel. New York, NY: Pfizer Inc; september 2019.
7. Kisqali (ribociclib) bipacksedel. East Hanover, NJ: Novartis Pharmaceuticals Corp; september 2019.
8. Verzenio (abemaciclib) bipacksedel. Indianapolis, IN: Eli Lilly and Co; september 2019.
9. Finn RS, Crown JP, Lang I, et al. Cyklinberoende kinas 4/6-hämmaren palbociclib i kombination med letrozol jämfört med enbart letrozol som förstahandsbehandling av östrogenreceptorpositiv, HER2-negativ, avancerad bröstcancer (PALOMA-1/TRIO-18): en randomiserad fas 2-studie. Lancet Oncol. 2015;16(1):25-35.
10. Finn RS, Martin M, Rugo HS, et al. Palbociclib och letrozol i avancerad bröstcancer. N Engl J Med. 2016;375(20):1925-1936.
11. Rugo HS, Finn RS, Diéras V, et al. Palbociclib plus letrozol som första linjens behandling vid östrogenreceptorpositiv/human epidermal tillväxtfaktorreceptor 2-negativ avancerad bröstcancer med utökad uppföljning. Breast Cancer Res Treat. 2019;174(3):719-729.
12. Turner NC, Ro J, André F, et al. Palbociclib i hormonreceptorpositiv avancerad bröstcancer. N Engl J Med. 2015;373(3):209-219.
13. Cristofanilli M, Turner NC, Bondarenko I, et al. Fulvestrant plus palbociclib jämfört med fulvestrant plus placebo för behandling av hormonreceptor-positiv, HER2-negativ metastaserad bröstcancer som progredierat vid tidigare endokrin behandling (PALOMA-3): slutlig analys av den multicenter, dubbelblinda, randomiserade kontrollerade fas 3-studien. Lancet Oncol. 2016;17(4):425-439.
14. Turner NC, Slamon DJ, Ro J, et al. Övergripande överlevnad med palbociclib och fulvestrant vid avancerad bröstcancer. N Engl J Med. 2018;379(20):1926-1936.
15. Hortobagyi GN, Stemmer SM, Burris HA, et al. Ribociclib som första linjens behandling för HR-positiv, avancerad bröstcancer. N Engl J Med. 2016;375(18):1738-1748.
16. Hortobagyi GN, Stemmer SM, Burris HA, et al. Uppdaterade resultat från MONALEESA-2, en fas III-studie av första linjens ribociclib plus letrozol jämfört med placebo plus letrozol vid hormonreceptorpositiv, HER2-negativ avancerad bröstcancer. Ann Oncol. 2018;29(7):1541-1547.
17. Slamon DJ, Neven P, Chia S, et al. Randomiserad fas III-studie av ribociclib och fulvestrant i hormonreceptorpositiv, human epidermal tillväxtfaktorreceptor 2-negativ avancerad bröstcancer: MONALEESA-3. J Clin Oncol. 2018;36(24):2465-2472.
18. Slamon DJ, Neven P, Chia S, et al. Total överlevnad med ribociclib plus fulvestrant vid avancerad bröstcancer. N Engl J Med. 2020;382(6):514-524.
19. Tripathy D, Im SA, Colleoni M, et al. Ribociclib plus endokrin behandling för premenopausala kvinnor med hormonreceptorpositiv, avancerad bröstcancer (MONALEESA-7): en randomiserad fas 3-studie. Lancet Oncol. 2018;19(7):904-915.
20. Im SA, Lu YS, Bardia A, et al. Total överlevnad med ribociclib plus endokrin behandling vid bröstcancer. N Engl J Med. 2019;381(4):307-316.
21. Dickler MN, Tolaney SM, Rugo HS, et al. MONARCH 1, en fas II-studie av abemaciclib, en CDK4- och CDK6-hämmare, som en enda agent, hos patienter med refraktär HR+/HER2-metastaserad bröstcancer. Clin Cancer Res. 2017;23(17):5218-5224.
22. Sledge GW Jr, Toi M, Neven P, et al. MONARCH 2: abemaciclib i kombination med fulvestrant hos kvinnor med HR+/HER2- avancerad bröstcancer som hade progredierat under endokrin behandling. J Clin Oncol. 2017;35(25):2875-2884.
23. Sledge GW Jr, Toi M, Neven P, et al. Effekten av abemaciclib plus fulvestrant på den totala överlevnaden vid hormonreceptorpositiv, ERBB2-negativ bröstcancer som progredierat under endokrin terapi-MONARCH 2: en randomiserad klinisk studie. JAMA Oncol. 2020;6(1):116-124.
24. Goetz MP, Toi M, Campone M, et al. MONARCH 3: abemaciclib som initial behandling av avancerad bröstcancer. J Clin Oncol. 2017;35(32):3638-3646.
25. Johnston S, Martin M, Di Leo A, et al. MONARCH 3 final PFS: a randomized study of abemaciclib as initial therapy for advanced breast cancer. NPJ Breast Cancer. 2019;17(5):5.
26. FDA. FDA varnar för sällsynta men allvarliga lunginflammationer med Ibrance, Kisqali och Verzenio för bröstcancer. www.fda.gov/drugs/drug-safety-and-availability/fda-warns-about-rare-severe-lung-inflammation-ibrance-kisqali-and-verzenio-breast-cancer. Tillgänglig 15 januari 2020.
27. Shah M, Nunes MR, Stearns V. CDK4/6-hämmare: game changers i hanteringen av hormonreceptorpositiv avancerad bröstcancer? Onkologi (Williston Park). 2018;32(5):216-222.
Innehållet i denna artikel är endast avsett för informationsändamål. Innehållet är inte avsett att ersätta professionell rådgivning. Att förlita sig på information som tillhandahålls i denna artikel sker uteslutande på egen risk.
