Dipolimomentit
Polaarisen aineen, kuten HCl:n, epäsymmetrinen varausjakauma synnyttää dipolimomentin, jossa \( Qr \) metreinä (m). lyhennetään kreikkalaisella kirjaimella mu (µ). Dipolimomentti määritellään sidoksissa olevien atomien osittaisvarauksen Q ja osittaisvarausten välisen etäisyyden r tulona.
Kun dipolimomentin omaava molekyyli asetetaan sähkökenttään, se pyrkii suuntautumaan sähkökentän mukaan, koska sen varausjakauma on epäsymmetrinen (kuva \(\PageIndex{4}\)).
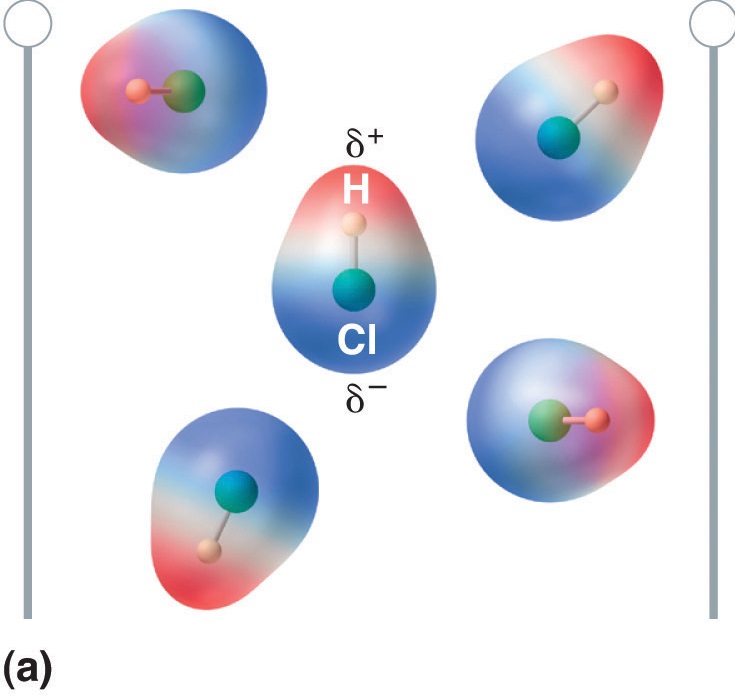
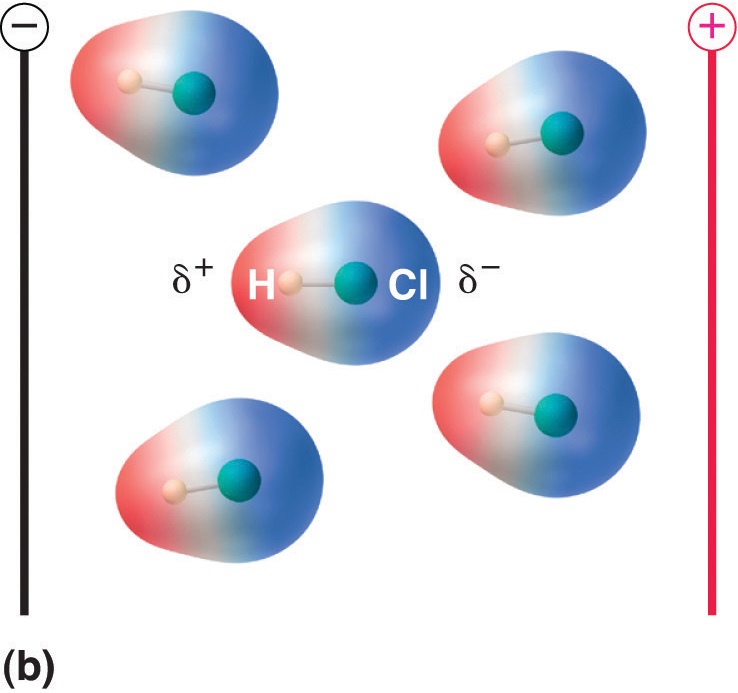
Kuva \(\PageIndex{5}\): Dipolimomentin omaavat molekyylit kohdistuvat osittain sovellettuun sähkökenttään. Ilman kenttää (a) HCl-molekyylit ovat satunnaisesti suuntautuneita. Kun siihen kohdistetaan sähkökenttä (b), molekyylit pyrkivät suuntautumaan kentän mukaan siten, että molekyylin dipolin positiivinen pää osoittaa kohti negatiivista päätepistettä ja päinvastoin.
HCl:n mitattu dipolimomentti osoittaa, että H-Cl-sidoksella on noin 18 % ionista luonnetta (0,1811 × 100) eli 82 % kovalenttista luonnetta. Sen sijaan, että kirjoittaisimme HCl:n muotoon
\
voimme siis ilmoittaa varaukseneron kvantitatiivisesti muotoon
\
Laskennalliset tuloksemme ovat sopusoinnussa vedyn ja kloorin elektronegatiivisuuseron χH = 2,20; χCl = 3,16, χCl – χH = 0,96) kanssa, mikä on arvo, joka on hyvinkin polaaristen kovalenttisten sidoksien alueella. Osoitamme dipolimomentin kirjoittamalla nuolen molekyylin yläpuolelle. Matemaattisesti dipolimomentit ovat vektoreita, ja niillä on sekä suuruus että suunta. Molekyylin dipolimomentti on yksittäisten sidosten dipolien vektorisumma. Esimerkiksi HCl:ssä dipolimomentti ilmoitetaan seuraavasti:
![]()
Nuoli osoittaa elektronivirran suunnan osoittamalla kohti elektronegatiivisempaa atomia.
Monien kaasufaasissa olevien aineiden atomien varaukset voidaan laskea mitattujen dipolimomenttien ja sidosetäisyyksien avulla. Kuvassa \(\PageIndex{6}\) on esitetty useiden aineiden prosentuaalisen ionisen luonteen kuvaaja sidoksissa olevien atomien elektronegatiivisuuseron suhteen. Kuvaajan mukaan NaCl(g):n ja CsF(g):n kaltaisten lajien sidokset ovat luonteeltaan huomattavasti alle 100-prosenttisesti ionisia. Kun kaasu tiivistyy kiinteäksi aineeksi, polarisoituneiden lajien väliset dipoli-dipoli-vuorovaikutukset kuitenkin lisäävät varauseroja. Kiteessä elektroni siis siirtyy metallista epämetalliin, ja nämä aineet käyttäytyvät kuin klassiset ioniset yhdisteet. Kuvan \(\PageIndex{6}\) tiedot osoittavat, että kaksiatomiset lajit, joiden elektronegatiivisuusero on alle 1,5, ovat luonteeltaan alle 50-prosenttisesti ionisia, mikä vastaa aiempaa kuvaustamme, jonka mukaan nämä lajit sisältävät poolisia kovalenttisia sidoksia. Dipolimomenttien käyttöä polaarisen sidoksen ionisen luonteen määrittämiseksi havainnollistetaan esimerkissä \(\PageIndex{2}\).
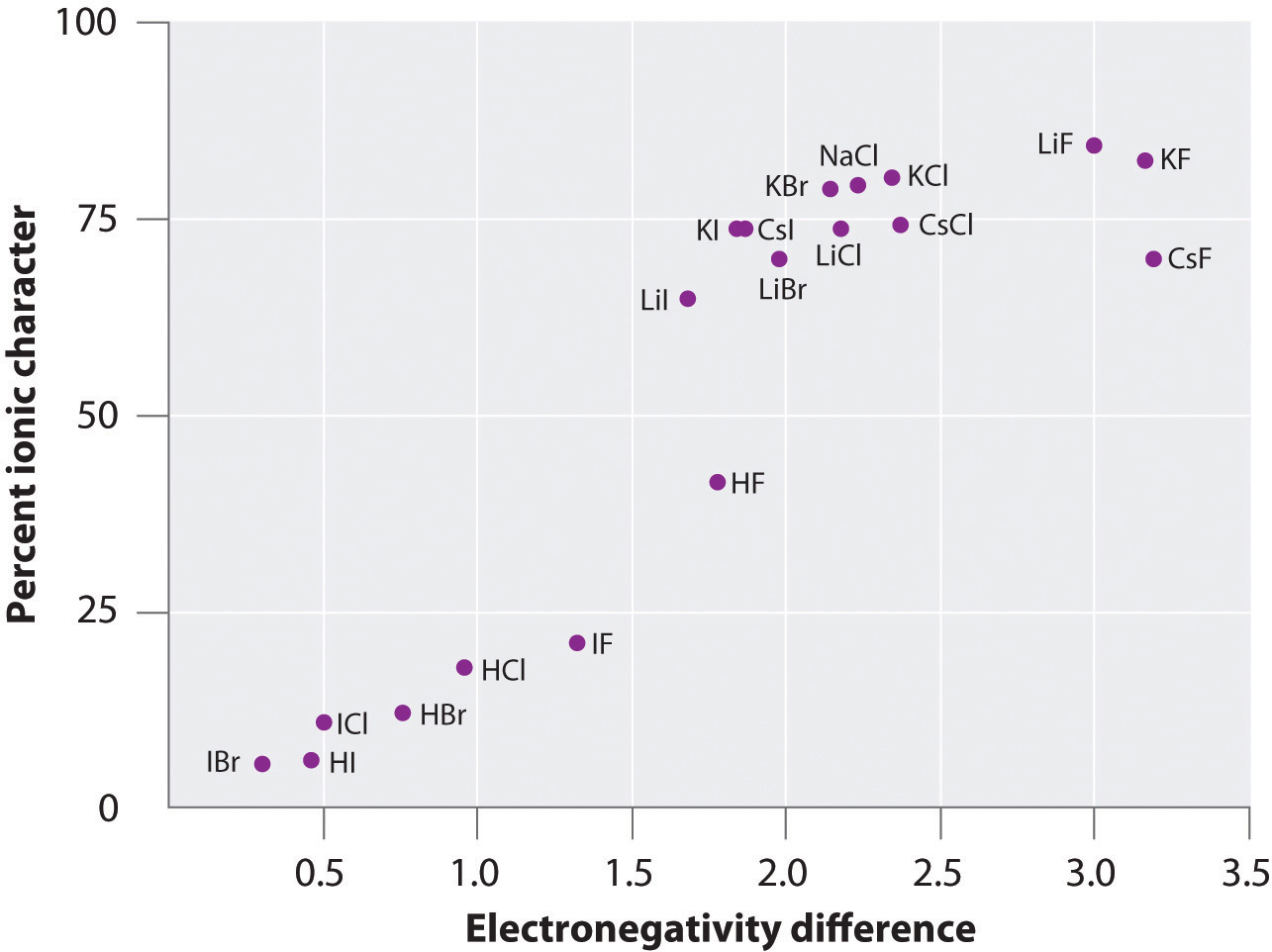
Kuva \(\PageIndex{6}\): Kaavio sidoksen ionisen luonteen prosentuaalisesta osuudesta mitattujen dipolimomenttien perusteella määritettynä suhteessa sidoksissa olevien atomien elektronegatiivisuuseroon.Kaasufaasissa edes CsF, jonka atomien elektronegatiivisuusero on suurin mahdollinen, ei ole 100-prosenttisesti ioninen. Kiinteää CsF:ää voidaan kuitenkin pitää parhaiten 100-prosenttisesti ionisena, koska ristikossa on ylimääräisiä sähköstaattisia vuorovaikutuksia.
