Entalpia
Thermodynamiikka on lämpöenergian (tai energian) ja työn välisen suhteen tutkimus. Entalpia on keskeinen tekijä termodynamiikassa. Se on systeemin lämpösisältö. Lämpö, joka siirtyy systeemiin tai poistuu systeemistä reaktion aikana, on entalpian muutos. Se, kasvaako systeemin entalpia (eli kun energiaa lisätään) vai pieneneekö se (koska energiaa luovutetaan), on ratkaiseva tekijä, joka määrittää, voiko reaktio tapahtua.
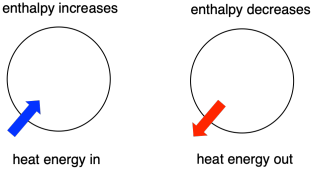
Joskus kutsumme muutoksessa olevien molekyylien energiaa ”sisäiseksi entalpiaksi”. Joskus kutsumme sitä ”systeemin entalpiaksi”. Nämä kaksi lausetta viittaavat samaan asiaan. Vastaavasti niiden molekyylien energiaa, jotka eivät osallistu reaktioon, kutsutaan ”ulkoiseksi entalpialle” tai ”ympäristön entalpialle”.
Karkeasti ottaen energiamuutokset, joita tarkastelimme termodynamiikan johdannossa, olivat entalpian muutoksia. Seuraavassa jaksossa näemme, että on olemassa toinenkin energiatekijä, entropia, joka meidän on myös otettava huomioon reaktioissa. Toistaiseksi tarkastelemme vain entalpiaa.
- Entalpia on systeemin lämpösisältö.
- Reaktion entalpian muutos vastaa suunnilleen reaktion aikana menetetyn tai saadun energian määrää.
- Reaktio on suotuisa, jos systeemin entalpia pienenee reaktion aikana.
Tämä viimeinen toteamus muistuttaa paljon edellisen sivun energetiikan kuvausta. Jos systeemi käy läpi reaktion ja luovuttaa energiaa, sen oma energiasisältö pienenee. Sillä on vähemmän energiaa jäljellä, jos se antoi sitä pois. Miksi molekyylijoukon energia muuttuu, kun tapahtuu reaktio? Vastataksemme tähän kysymykseen meidän on mietittävä, mitä kemiallisessa reaktiossa tapahtuu.
Reaktiossa kemialliset sidokset muuttuvat. Osa reagoivien aineiden sidoksista katkeaa, ja uusia sidoksia syntyy tuotteiden muodostamiseksi. Sidosten katkaiseminen maksaa energiaa, mutta energiaa vapautuu, kun uusia sidoksia syntyy.
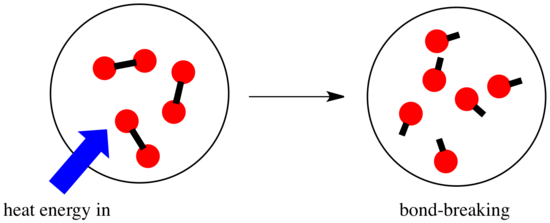
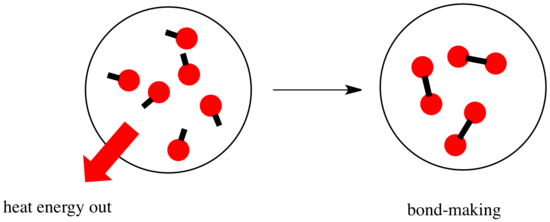
Se, voiko reaktio edetä, voi riippua näiden sidoksia muodostavien ja rikkovien vaiheiden välisestä tasapainosta.
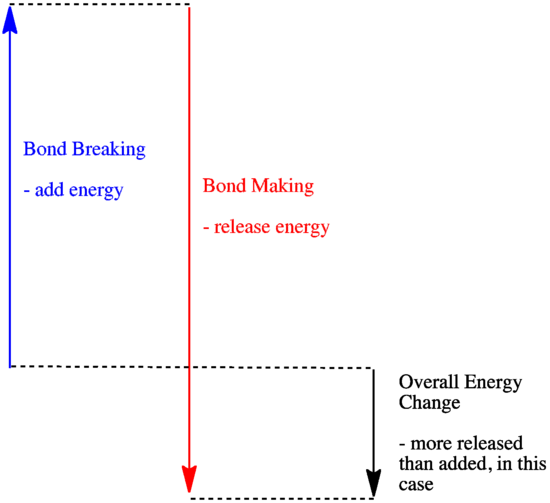
- Reaktio on eksoterminen, jos uusien sidosten muodostuessa vapautuu enemmän energiaa kuin vanhoja sidoksia rikkoessa kuluu.
- Reaktio on eksoterminen, jos heikompia sidoksia vaihdetaan vahvempiin.
- Reaktio on endoterminen, jos sidosten rikkoutuminen kuluttaa enemmän energiaa kuin mitä sidosten muodostuminen tuottaa.
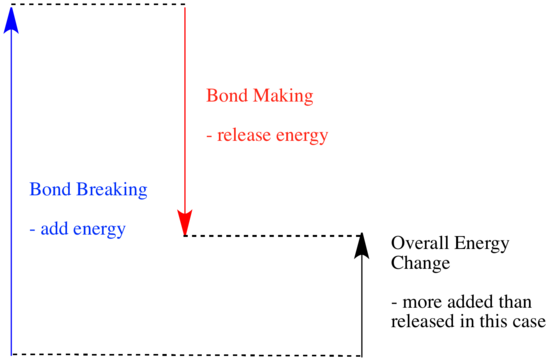
Sidosenergiat (energiamäärä, joka on lisättävä sidoksen rikkoutumiseen) ovat tärkeä tekijä määriteltäessä reaktion tapahtumista. Sidosten voimakkuuksia ei ole aina helppo ennustaa, koska sidoksen voimakkuus riippuu useista tekijöistä. Monet ihmiset ovat kuitenkin tehneet paljon työtä sidoslujuuksien mittaamiseksi ja keränneet tiedot taulukoihin, joten jos haluat tietää, kuinka vahva sidos on, voit vain etsiä tarvitsemasi tiedot.
| Sidos | Sidosenergia (kcal/mol) | Sidos | Sidosenergia (kcal/mol) |
| H-H | 104 | O-H | 111 |
| C-C | 83 | C-H | 99 |
| O=O | 119 | N-H | 93 |
| N=N | 226 | C=O | 180 |
Esim, oletetaan, että halutaan tietää, onko metaanin palaminen eksoterminen vai endoterminen reaktio. Veikkaan, että se on eksoterminen, koska tätä reaktiota (ja muita vastaavia) käytetään lämmön tuottamiseen moniin koteihin polttamalla maakaasua uuneissa.
Metaanin ”palaminen” tarkoittaa, että sitä poltetaan ilmassa, jolloin se reagoi hapen kanssa. Hiilivetyjen palamisen tuotteet ovat enimmäkseen hiilidioksidia ja vettä. Metaanin (CH4) hiiliatomi liitetään hiilidioksidimolekyyliin. Vetyatomit liittyvät vesimolekyyleihin. Metaanissa on neljä vetyatomia, joten se riittää tekemään kaksi molekyyliä H2O:ta.
- Metaanin palamisessa on katkaistava neljä C-H-sidosta.
- Neljä uutta O-H-sidosta syntyy, kun metaanin vetyatomit liitetään uusiin vesimolekyyleihin.
- Kaksi uutta C=O-sidosta syntyy, kun metaanin hiiltä lisätään CO2-molekyyliin.
Palapelin toinen palanen on reaktion hapenlähde. Happea on ilmakehässä lähinnä O2:na. Koska tarvitsemme kaksi happiatomia CO2-molekyyliin ja vielä kaksi happiatomia kahta vesimolekyyliä varten, tarvitsemme reaktioon yhteensä neljä happiatomia, jotka voitaisiin saada kahdesta O2-molekyylistä.
-
Kaksi O=O-sidosta on katkaistava, jotta saamme happiatomeja tuotteisiin.
Kokonaisuudessaan se tarkoittaa, että on katkaistavissa neljä C-H- ja kaksi O=O-sidosta ja lisäksi on muodostettu kaksi C=O-sidosta sekä kaksi C=O-sidosta. Se on 4 x 99 kcal/mol C-H-sidoksille ja 2 x 119 kcal/mol O=O-sidoksille, yhteensä 634 kJ/mol lisää. Reaktiossa vapautuu 2 x 180 kcal/mol C=O-sidoksille ja 4 x 111 kcla/mol OH-sidoksille, yhteensä 804 kcal/mol. Kaiken kaikkiaan vapautuu 170 kcal/mol enemmän kuin kuluu.
Tämä tarkoittaa, että reaktio on eksoterminen, eli se tuottaa lämpöä. Se on luultavasti hyvä tapa lämmittää kotiasi.
