US Pharm. 2020;45(5)(Specialty&Oncology suppl):3-8.
ABSTRACT: Viime vuosina on kehitetty useita uusia kohdennettuja hoitovaihtoehtoja pitkälle edenneen rintasyövän perinteisen hormonihoidon resistenssin torjumiseksi. Kolme CDK4/6:n estäjää (palbosiklibi, ribosiklibi ja abemasiklibi) on hyväksytty potilaille, joilla on hormonireseptoripositiivinen, ihmisen epidermaalisen kasvutekijän reseptorin 2-negatiivinen edennyt rintasyöpä. Kukin aine on osoittanut tehonsa, mutta näiden kolmen lääkkeen välillä on eroja erityisesti niiden haittavaikutusprofiileissa.
Rintasyöpä on naisten yleisin syöpätyyppi, ja vuonna 2020 arvioidaan esiintyvän yli 276 000 uutta tapausta.1 Hormonireseptoripositiivista (HR+) rintasyöpää, joka muodostaa yli 70 % näistä tapauksista, on perinteisesti hoidettu hormonihoidolla, kuten selektiivisillä estrogeenireseptorin estäjillä (estereseptorin inhibiittoreilla, selektiivisillä estrogeenireseptorin estäjillä, ja aromataasin estäjillä (AI). Vaikka ET on edelleen HR+-rintasyövän hoidon selkäranka, jopa 50 prosentille pitkälle edennyttä rintasyöpää sairastavista potilaista kehittyy resistenssi.2 Resistenssin torjumiseksi HR+-rintasyövän hoitoon on hyväksytty kohdennettuja hoitoja.3,4
Sykliiniriippuvaisen kinaasin (CDK) estäjät, jotka ovat etenevän rintasyövän hoidossa kiinnostava uusin hoitoryhmä, toimivat inhiboimalla spesifisesti CDK4/6 -proteiineja ja estämällä siirtymistä solusyklin G1- ja S-vaiheesta. Tämä lääkeryhmä estää kinaasiaktiivisuutta, joka fosforyloi retinoblastoomaproteiinireittiä. Estämällä tämän polun CDK4/6-inhibiittorit pystyvät estämään solusyklin etenemisen G1-vaiheen puolivälissä ja estämään syöpäsolujen etenemisen. Viime vuosina kolme CDK4/6-inhibiittoria (palbosiklibi, ribosiklibi ja abemasiklibi) on hyväksytty yhdistelmähoidoksi HR+, ihmisen epidermaalisen kasvutekijän reseptorin 2-negatiivisen (HER2-), pitkälle edenneen tai metastasoituneen rintasyövän hoidossa5-8. Tässä artikkelissa tarkastellaan näiden aineiden eroja (TAULUKKO 1), vaiheen III kliinisiä tutkimuksia (TAULUKKO 2) ja haittavaikutusprofiileja (TAULUKKO 3).
Palbosiklibi
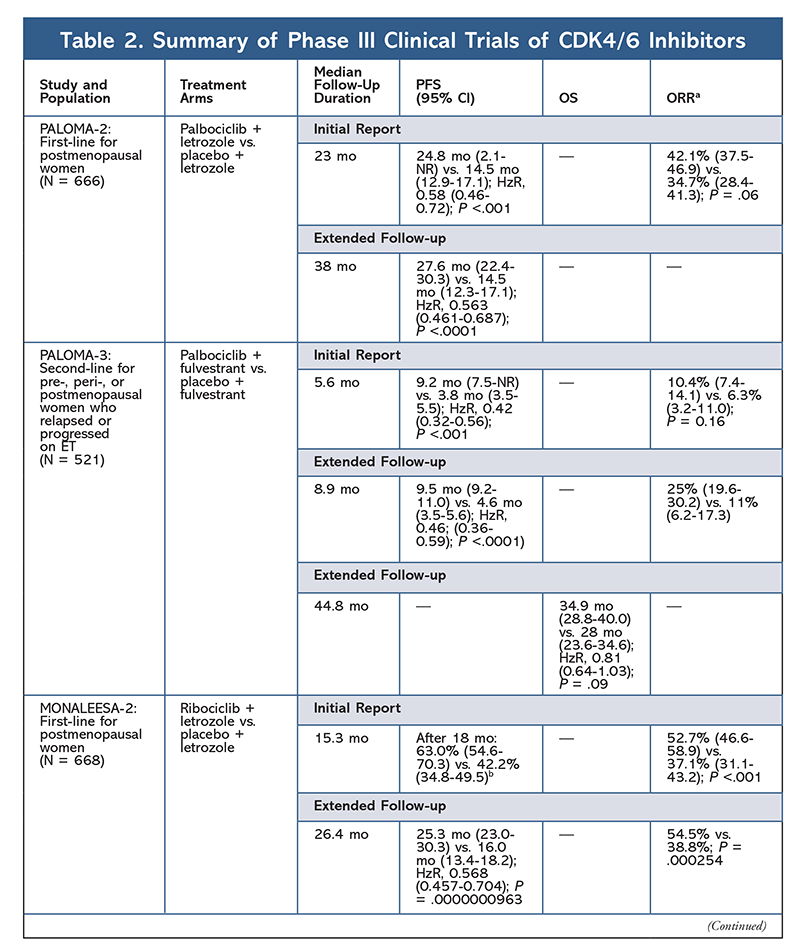
Palbosiklibista tuli vuonna 2015 ensimmäinen CDK4/6-estäjä, joka sai FDA:n hyväksynnän HR+-, HER2- rintasyövän hoitoon (yhdistelmänä tekoälyn kanssa alkuvaiheen ET:ksi postmenopausaalisilla naisilla tai miehillä tai yhdistelmänä fulvestrantin kanssa potilailla, joilla tauti on edennyt ET:n jälkeen).6,9-14 Palbosiklibi sai alun perin hyväksynnän sen jälkeen, kun vaiheen II tutkimuksesta PALOMA-1, jossa palbosiklibiä ja letrotsolia verrattiin pelkkään letrotsoliin ET-naivisten pitkälle edennyttä rintasyöpää sairastavien potilaiden aloitushoitona, saatiin myönteisiä tuloksia.9
Nämä tulokset johtivat kahteen vaiheen III tutkimukseen, joissa palbosiklibin vaikutusta tässä potilasryhmässä arvioitiin edelleen. PALOMA-2:n alustavat tulokset vahvistivat palbosiklibin ja letrotsolin vaikutukset ja osoittivat, että etenemisvapaa elossaoloaika (PFS) parani pelkkään letrotsoliin verrattuna (24,8 kuukautta vs. 14,5 kuukautta; taudin etenemisen tai kuoleman vaarasuhde 0,58; 95 %:n CI 0,46-0,72; P <.001). Pitkäaikainen seurantatutkimus 38 kuukauden kohdalla vahvisti entisestään palbosiklibin vaikutuksen PFS:ään, joka kasvoi 27,6 kuukauteen verrattuna 14,5 kuukauteen pelkällä letrotsolilla (HzR, 0,563; 95 % CI, 0,461-0,687; P <.0001). Seurantatutkimuksessa raportoitiin myös johdonmukainen PFS:n paraneminen palbosiklibilla ja letrotsolilla kaikissa tutkituissa alaryhmissä sekä viivästynyt mediaaniaika myöhemmän hoidon aloittamiseen. Alku- ja seurantaraporttien kokonaiselossaoloaikojen (OS) tiedot olivat kuitenkin epätäydellisiä, ja tutkimukseen ilmoittautuneita potilaita seurataan elossaoloaikojen osalta.10,11
Lyhyt aika PALOMA-2:n alkamisen jälkeen aloitettiin toinen vaiheen III tutkimus, PALOMA-3, jossa arvioitiin palbosiklibin ja fulvestrantin turvallisuutta ja tehoa premenopausaalisilla tai postmenopausaalisilla naisilla, joilla oli pitkälle edennyttä edennyttä rintasyöpää sairastava HR+-luokan rintasyöpä, joka oli edennyt etenevässä vaiheessa aiemmalla ET:llä. Ensimmäinen raportti 5,6 kuukauden seurannan jälkeen osoitti, että PFS:n mediaani parani (9,2 vrt. 3,8 vrt. 3,8 vrt. 9,2 kk) ja eteneminen väheni 58 % (HzR, 0,42; 95 %:n CI, 0,32-0,56; P <.001).12 PALOMA-3-tutkimuksen käyttöikää (OS) koskeva esispesifioitu analyysi, jossa käytettiin seurannan mediaaniaikaa 44.8 kuukautta, todettiin, että erot OS:ssä eivät saavuttaneet tilastollista merkitsevyyttä koko aiotun hoitoryhmän osalta, mutta yhdistelmä pidensi OS:ää 10 kuukaudella potilailla, jotka olivat herkkiä aiemmalle ET:lle.14
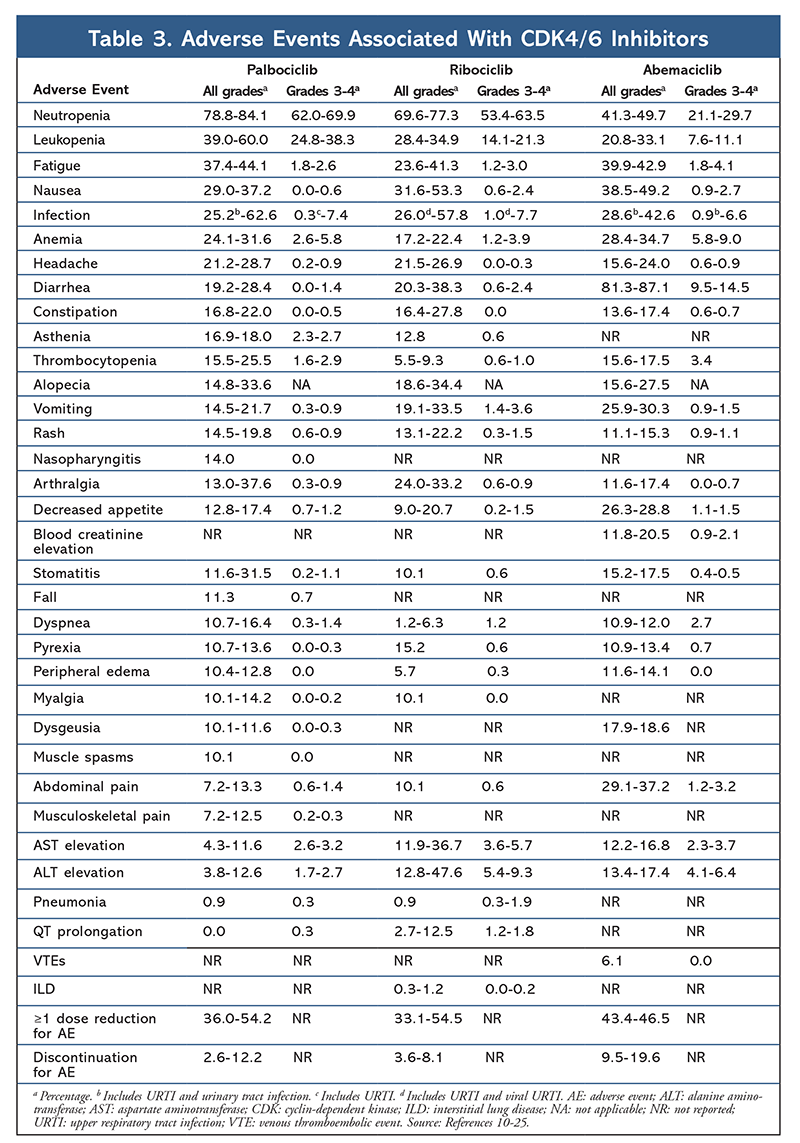
Asioiden haittavaikutusprofiili pysyi yhtenäisenä kaikissa tutkimusraporteissa (TAULUKKO 3), ja yleisimmin raportoidut haittavaikutukset olivat kaikenasteinen neutropenia (78,8-84,1 %), leukopenia (39-60 %) ja väsymys (37,4-44,1 %). Neutropeniaa esiintyi paljon, mutta kuumeinen neutropenia oli harvinaista (enintään 2 %). Palbosiklibin yleistä siedettävyyttä pidettiin hallittavana, ja aineesta saatiin myönteisiä elämänlaatutietoja, kun sitä käytettiin yhdistelmähoidossa verrattuna endokriiniseen monoterapiaan.9,14
Ribosiklibi
Toinen CDK4/6:n estäjä, ribosiklibi, hyväksyttiin FDA:lla vuonna 2017, ja sen käyttöindikaatio oli laajempi. Ribosiklibi on hyväksytty postmenopausaalisille ja pre- tai perimenopausaalisille naisille, joilla on HR+, HER2- pitkälle edennyt tai metastasoitunut rintasyöpä (yhdistelmähoitona AI:n kanssa alkuvaiheen ET:nä tai postmenopausaalisilla naisilla yhdistettynä fulvestranttiin alkuvaiheen ET:nä tai taudin etenemisen jälkeen ET:llä).7
Ribosiklibi sai ensimmäisen kerran FDA:n hyväksynnän sen jälkeen, kun MONALEESA-2-tutkimuksessa havaittiin, että PFS parani, kun lääkettä annettiin yhdistelmähoitona yhdessä letrotsolin kanssa, kun sitä annettiin yhdessä pelkän letrotsolin kanssa. Paikallisesti arvioidut PFS-arvot pelkkään letrotsoliin verrattuna olivat 18 kuukauden kuluttua 63,0 % (95 % CI, 54,6-70,3) ja 42,2 % (95 % CI, 34,8-49,5).15 Laajennettu seurantaraportti 26,4 kuukauden kuluttua osoitti edelleen yhdistelmän tehon ja siedettävyyden.16 PFS:n paranemisesta huolimatta MONALEESA-2:n OS-tiedot ovat edelleen epäkypsät.
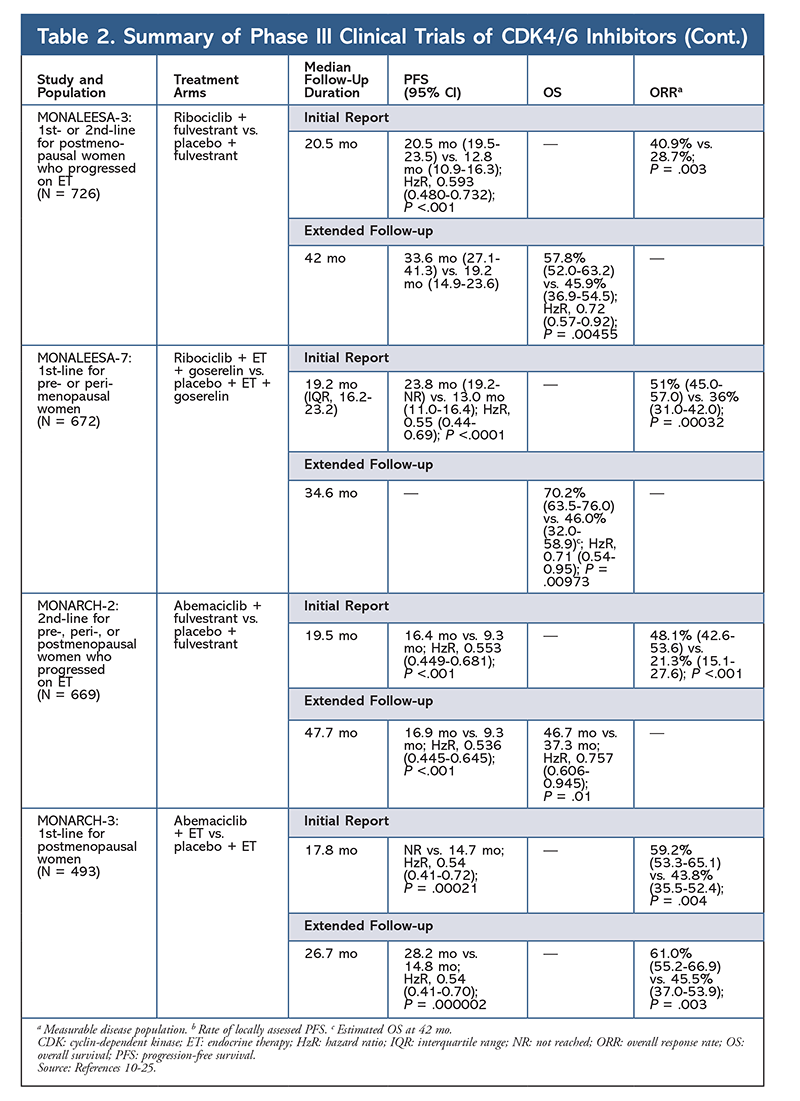
Ribosiklibia tutkitaan myös (MONALEESA-3:ssa) yhdistelmänä fulvestrantin kanssa hoitoa saavilla potilailla ja potilailla, jotka ovat uusiutuneet ET:n jälkeen. Ensimmäinen raportti osoitti yhdistelmän parantuneen PFS:n verrattuna pelkkään fulvestranttiin (20,5 kk vs. 12,8 kk; HzR, 0,593; 95 % CI, 0,480-0,732; P <.001), mikä johti FDA:n hyväksyntään tälle yhdistelmälle.17 Toisessa ja viimeisimmässä CDK4/6:n estäjiä koskeneessa raportissa, jossa seurantaa oli jatkettu vielä 21,6 kk:n ajanjakson verran, osoitettiin edelleen johdonmukainen parantunut PFS. Tässä raportissa osoitettiin myös ribosiklibin ja fulvestrantin yhdistelmällä saavutettu hyöty elossaoloaikana verrattuna pelkkään fulvestranttiin: arvioitu elossaoloaika 42 kuukauden kohdalla oli 57,8 % verrattuna 45,9 %:iin ja suhteellinen kuolemanriski pieneni 28 % (HzR, 0,72; 95 % CI, 0,57-0.92; P = 0,00455).18
Kolmas kliininen tutkimus, MONALEESA-7, on tällä hetkellä ainoa vaiheen III tutkimus, jossa arvioidaan CDK4/6:n estäjän tehoa ja turvallisuutta ensilinjan hoitona metastasoitunutta rintasyöpää sairastaville pre- tai perimenopausaalisille naisille. Tässä tutkimuksessa ribosiklibi yhdessä tamoksifeenin tai ei-steroidisen AI:n (NSAI) – kuten letrotsolin tai anastrotsolin – ja gosereliinin kanssa paransi merkittävästi PFS:ää 23,8 kuukaudella verrattuna 13 kuukauteen plaseboryhmän 13 kuukauteen (HzR, 0,55; 95 %:n CI, 0,44-0,69; P <.0001), ja yhdistelmä johti laajempaan käyttöaiheeseen, joka käsittää myös pre- ja perimenopausaaliset naiset.19 Laajennetussa seurantaraportissa osoitettiin ribosiklibin ja tamoksifeenin tai NSAI:n ja gosereliinin yhdistelmän OS-hyöty lumelääkkeeseen verrattuna: arvioitu 42 kuukauden OS oli 70,2 % verrattuna 46,0 %:iin.20
Ribosiklibin toksisuusprofiili on hyvin samankaltainen kuin palbosiklibillä, ja neutropenia ja leukopenia ovat korkeimmat raportoidut yleiset ja vakavat (asteet 3 / 4 / 4) AE-esiintymiset, vaikkakin alhaisemmalla prosentilla kuin palbosiklibillä (TAULUKKO 3).15-20 Kuumeinen neutropenia oli harvinaista, eikä ribosiklibille altistumisen pidentyessä ilmennyt uusia turvallisuusongelmia yhdessäkään laajennetun seurannan raportissa.
Abemasiklibi
Kolmas CDK4/6-estäjä, joka on saanut FDA:n hyväksynnän, on abemasiklibi. Tämä aine on tarkoitettu yhdessä tekoälyn kanssa ensimmäiseksi ET:ksi postmenopausaalisille naisille, joilla on pitkälle edennyt rintasyöpä, tai yhdessä fulvestrantin kanssa pre-, peri- tai postmenopausaalisille naisille, joilla tauti etenee ET:n jälkeen. Abemasiklibi on hyväksytty myös monoterapiana miehille ja naisille, joiden tauti on edennyt ET:n ja sitä edeltävän solunsalpaajahoidon jälkeen metastaattisessa tilanteessa.6 Alun perin aine sai hyväksynnän MONARCH-1-hoidon tulosten perusteella, jotka osoittivat lupaavaa kliinistä aktiivisuutta 12 kuukauden jälkeen: kokonaisvasteosuus (ORR) oli 19,7 % (95 %:n CI 13,3-27,5) ja PFS-ajan mediaani 6 kuukautta.5,21 Tänä aikana abemasiklibia tutkittiin myös MONARCH-2-tutkimuksessa ET:n jälkeen etenevien pre-, peri- ja postmenopausaalisten naisten hoitoon. Tässä tutkimuksessa osoitettiin tilastollisesti merkitsevä PFS-hyöty abemasiklibin ja fulvestrantin yhdistelmällä verrattuna pelkkään fulvestranttiin (16,4 kk vs. 9,3 kk; HzR, 0,553; 95 % CI, 0,449-0,681; P <.001).22 Laajennetussa seurantatutkimuksessa, jonka mediaanikesto oli 47.7 kk:n tutkimuksessa raportoitiin hieman parempia PFS-tuloksia ja OS-hyötyjä abemasiklibi-yhdistelmällä verrattuna lumelääkkeeseen ja fulvestranttiin (46,7 mo vs. 37,3 mo; 95 % CI, 0,606-0,945; P = 0,01).23
Lyhyesti sen jälkeen, kun kaksi abemasiklibitutkimusta oli aloitettu, aloitettiin MONARCH-3. Tässä tutkimuksessa havaittiin tilastollisesti merkitsevä parannus PFS:ssä ja ORR:ssä abemasiklibilla ja NSAI:lla verrattuna lumelääkettä ja NSAI:ta sisältävään käsivarteen ensilinjan hoitona postmenopausaalisille naisille. Päivitetty raportti, jossa oli 8,9 kuukauden lisäseuranta, vahvisti entisestään alkuperäisen analyysin PFS- ja ORR-tulokset; OS-tiedot ovat kuitenkin vielä kypsymättömiä, ja lopullinen OS-analyysi tehdään 315 tapahtuman jälkeen.24,25
Kokonaisuutena abemasiklibiä on pidetty tehokkaimpana CDK4/6:n estäjänä, ja sillä on rakenteensa vuoksi erinomainen keskushermostovaikutus, minkä ansiosta se pystyy läpäisemään veri-aivoesteen ja pysymään pidempään tehokohteena.5 Tästä voi olla etua potilailla, joilla on aivoetäpesäkkeitä. Vaikka abemasiklibillä on myös suuri osuus hematologisia haittavaikutuksia, nämä osuudet ovat paljon pienempiä kuin muilla CDK4/6-estäjillä. Abemasiklibiin liittyy enemmän gastrointestinaalisia toksisuuksia, kuten ripulia, kuin muihin CDK4/6-inhibiittoreihin (kaikki asteet: 81,3 %-87,1 %; asteet 3-4: 9,5 %-14,5 %).22-25
Apteekkarin rooli
Kaiken kaikkiaan eri CDK4/6-inhibiittoreiden AE-profiilit ovat samankaltaisia, mutta kullakin lääkeaineella on yksilölliset AE:t. Yleisimmät CDK4/6-estäjillä raportoidut AE:t ovat neutropenia, leukopenia, väsymys, pahoinvointi, infektio, nivelrikko, anemia, päänsärky ja ripuli (TAULUKKO 3). Neutropeniaa ja leukopeniaa lukuun ottamatta suurin osa potilaista raportoi asteen 1 tai 2 haittavaikutuksia. Luokan 3 tai 4 neutropeniaa ja leukopeniaa, jotka olivat hyvin yleisiä kaikilla CDK:n estäjillä, erityisesti palbosiklibillä ja ribosiklibillä, hoidettiin useimmiten annoksen keskeyttämisellä ja/tai pienentämisellä. Potilaan CBC-arvoja on seurattava lähtötilanteessa, kahden ensimmäisen syklin ajan kahden viikon välein, jokaisen seuraavan neljän syklin alussa ja kliinisen tarpeen mukaan luuytimen suppression vuoksi.6-8 Kaatumisia, lihaskouristuksia ja nenänielutulehdusta liittyy palbosiklibiin, mutta ne ovat useimmissa tapauksissa lieviä.10,11,14 Ribosiklibillä on raportoitu QT-ajan pidentymisen vähäistä esiintyvyyttä.15-20 Abemasiklibiin liittyi palbosiklibiin ja ribosiklibiin verrattuna huomattavasti suurempi ripulin esiintyvyys; tapauksia esiintyi useimmiten ensimmäisen syklin aikana, ja ne voitiin hoitaa ripulilääkityksellä.22-25 Abemasiklibiin liittyi seerumin kreatiniinin nousua ja laskimotromboembolisia tapahtumia (enimmäkseen lieviä), joita ei raportoitu palbosiklibin ja ribosiklibin kohdalla, sekä vatsakivun korkeampi esiintyvyys.22-25 Syyskuussa 2019 FDA varoitti, että harvinaista, mutta vakavaa, henkeä uhkaavaa tai kuolemaan johtanutta interstitiaalista keuhkosairautta (ILD) ja keuhkoputkentulehdusta voi ilmaantua potilailla, joita hoidetaan CDK4/6:n estäjillä.26 Siksi potilaita on seurattava säännöllisesti ILD:hen ja/tai pneumoniittiin viittaavien keuhko-oireiden varalta.
Johtopäätös
Palbosiklibin, ribosiklibin ja abemasiklibin hyväksynnät viime vuosina ovat laajentaneet pitkälle edennyttä rintasyöpää sairastavien potilaiden hoitovaihtoehtoja. Vaikka niillä kaikilla on sama vaikutusmekanismi, näillä lääkkeillä on pieniä eroja tehossa ja turvallisuudessa. Useissa meneillään olevissa tutkimuksissa, jotka eivät sisälly tässä katsauksessa mainittuihin, tutkitaan edelleen näitä estäjiä eri potilasryhmissä ja eri hoitoyhdistelmillä. Näiden aineiden mahdollisuudet laajentaa CDK4/6:n estäjien käyttöä muihin kuin HR+, HER2- pitkälle edenneeseen rintasyöpään vaikuttavat lupaavilta.27
1. Siegel RL, Miller KD, Jemal A. Cancer statistics, 2020. CA Cancer J Clin. 2020;70(1):7-30.
2. Preusser M, De Mattos-Arruda L, Thill M, et al. CDK4/6-inhibiittorit rintasyöpäpotilaiden hoidossa: yhteenveto monitieteisestä pyöreän pöydän keskustelusta. ESMO Open. 2018;3(5):e000368.
3. Tripathy D, Bardia A, Sellers WR. Ribosiklibi (LEE011): tämän selektiivisen sykliini-riippuvaisen kinaasi 4/6:n estäjän vaikutusmekanismi ja kliininen vaikutus erilaisissa kiinteissä kasvaimissa. Clin Cancer Res. 2017;23(13):3251-3262.
4. Portman N, Alexandrou S, Carson E ym. CDK4/6-inhibiittoriresistenssin voittaminen ER-positiivisessa rintasyövässä. Endocr Relat Cancer. 2019;26(1):R15-R30.
5. Sobhani N, D’Angelo A, Pittacolo M, ym. päivitykset CDK4/6-estäjästrategiasta ja yhdistelmistä rintasyövässä. Cells. 2019;8(4):E321.
6. Ibrance (palbociclib) pakkausseloste. New York, NY: Pfizer Inc; September 2019.
7. Kisqali (ribosiklibi) pakkausseloste. East Hanover, NJ: Novartis Pharmaceuticals Corp; syyskuu 2019.
8. Verzenio (abemasiklibi) pakkausseloste. Indianapolis, IN: Eli Lilly and Co; syyskuu 2019.
9. Finn RS, Crown JP, Lang I, et al. The cyclin-dependent kinase 4/6 inhibitor palbociclib in combination with letrozole versus letrozole alone as first-line treatment of oestrogen receptor-positive, HER2-negative, advanced breast cancer (PALOMA-1/TRIO-18): a randomised phase 2 study. Lancet Oncol. 2015;16(1):25-35.
10. Finn RS, Martin M, Rugo HS, et al. Palbociclib and letrozole in advanced breast cancer. N Engl J Med. 2016;375(20):1925-1936.
11. Rugo HS, Finn RS, Diéras V, et al. Palbociclib plus letrotsoli ensilinjan hoitona estrogeenireseptoripositiivisessa/human epidermisen kasvutekijän reseptori 2 -negatiivisessa pitkälle edenneessä rintasyövässä laajennetulla seurannalla. Breast Cancer Res Treat. 2019;174(3):719-729.
12. Turner NC, Ro J, André F, et al. Palbociclib hormonireseptoripositiivisessa pitkälle edenneessä rintasyövässä. N Engl J Med. 2015;373(3):209-219.
13. Cristofanilli M, Turner NC, Bondarenko I, et al. Fulvestrantti plus palbosiklibi versus fulvestrantti plus lumelääke edellisellä hormonireseptoripohjaisella hoidolla edenneen hormonireseptoripositiivisen, HER2-negatiivisen metastaattisen rintasyövän hoidossa (PALOMA-3): monikeskuksisen, kaksoissokkoutetun, satunnaistetun, kontrolloidun, vaiheen 3 tutkimuksen loppuanalyysi. Lancet Oncol. 2016;17(4):425-439.
14. Turner NC, Slamon DJ, Ro J, et al. Palbosiklibin ja fulvestrantin kokonaiseloonjääminen pitkälle edenneessä rintasyövässä. N Engl J Med. 2018;379(20):1926-1936.
15. Hortobagyi GN, Stemmer SM, Burris HA, et al. Ribosiklibi HR-positiivisen, pitkälle edenneen rintasyövän ensilinjan hoitona. N Engl J Med. 2016;375(18):1738-1748.
16. Hortobagyi GN, Stemmer SM, Burris HA, et al. Updated results from MONALEESA-2, a phase III trial of first-line ribociclib plus letrozole versus placebo plus letrozole in hormone receptor-positive, HER2-negative advanced breast cancer. Ann Oncol. 2018;29(7):1541-1547.
17. Slamon DJ, Neven P, Chia S, et al. Vaiheen III satunnaistettu tutkimus ribosiklibistä ja fulvestrantista hormonireseptoripositiivisessa, ihmisen epidermaalisen kasvutekijän reseptorin 2-negatiivisessa edenneessä rintasyövässä: MONALEESA-3. J Clin Oncol. 2018;36(24):2465-2472.
18. Slamon DJ, Neven P, Chia S, et al. Overall survival with ribociclib plus fulvestrant in advanced breast cancer. N Engl J Med. 2020;382(6):514-524.
19. Tripathy D, Im SA, Colleoni M, et al. Ribosiklibi plus endokriininen hoito premenopausaalisille naisille, joilla on hormonireseptoripositiivinen, pitkälle edennyt rintasyöpä (MONALEESA-7): satunnaistettu, vaiheen 3 tutkimus. Lancet Oncol. 2018;19(7):904-915.
20. Im SA, Lu YS, Bardia A, et al. Overall survival with ribociclib plus endocrine therapy in breast cancer. N Engl J Med. 2019;381(4):307-316.
21. Dickler MN, Tolaney SM, Rugo HS, ym. MONARCH 1, vaiheen II tutkimus CDK4:n ja CDK6:n estäjän, abemasiklibin, käytöstä yksittäisenä aineena potilailla, joilla on refraktorinen HR+/HER2- metastaattinen rintasyöpä. Clin Cancer Res. 2017;23(17):5218-5224.
22. Sledge GW Jr, Toi M, Neven P, et al. MONARCH 2: abemasiklibi yhdessä fulvestrantin kanssa naisilla, joilla oli HR+/HER2- pitkälle edennyttä rintasyöpää, joka oli edennyt endokriinisen hoidon aikana. J Clin Oncol. 2017;35(25):2875-2884.
23. Sledge GW Jr, Toi M, Neven P, ym. abemasiklibin ja fulvestrantin vaikutus kokonaiseloonjäämiseen hormonireseptoripositiivisessa, ERBB2-negatiivisessa rintasyövässä, joka eteni endokriinisellä hoidolla – MONARCH 2: satunnaistettu kliininen tutkimus. JAMA Oncol. 2020;6(1):116-124.
24. Goetz MP, Toi M, Campone M, et al. MONARCH 3: abemasiklibi pitkälle edenneen rintasyövän aloitushoitona. J Clin Oncol. 2017;35(32):3638-3646.
25. Johnston S, Martin M, Di Leo A, et al. MONARCH 3 final PFS: satunnaistettu tutkimus abemasiklibista pitkälle edenneen rintasyövän aloitushoitona. NPJ Breast Cancer. 2019;17(5):5.
26. FDA. FDA varoittaa harvinaisesta mutta vakavasta keuhkotulehduksesta rintasyövän hoitoon tarkoitettujen Ibrance-, Kisqali- ja Verzenio-valmisteiden yhteydessä. www.fda.gov/drugs/drug-safety-and-availability/fda-warns-about-rare-severe-lung-inflammation-ibrance-kisqali-and-verzenio-breast-cancer. Viitattu 15. tammikuuta 2020.
27. Shah M, Nunes MR, Stearns V. CDK4/6-inhibiittorit: pelin muuttajat hormonireseptoripositiivisen pitkälle edenneen rintasyövän hoidossa? Oncology (Williston Park). 2018;32(5):216-222.
Tämän artikkelin sisältö on tarkoitettu vain tiedoksi. Sisältöä ei ole tarkoitettu korvaamaan ammatillista neuvontaa. Tässä artikkelissa annettuihin tietoihin luottaminen tapahtuu yksinomaan omalla vastuullasi.
