Moments dipolaires
La distribution asymétrique des charges dans une substance polaire comme le HCl produit un moment dipolaire où \( Qr \) en mètres (m). est abrégé par la lettre grecque mu (µ). Le moment dipolaire est défini comme le produit de la charge partielle Q sur les atomes liés et de la distance r entre les charges partielles.
Lorsqu’une molécule possédant un moment dipolaire est placée dans un champ électrique, elle a tendance à s’orienter avec le champ électrique en raison de sa distribution asymétrique des charges (figure \(\PageIndex{4}\)).
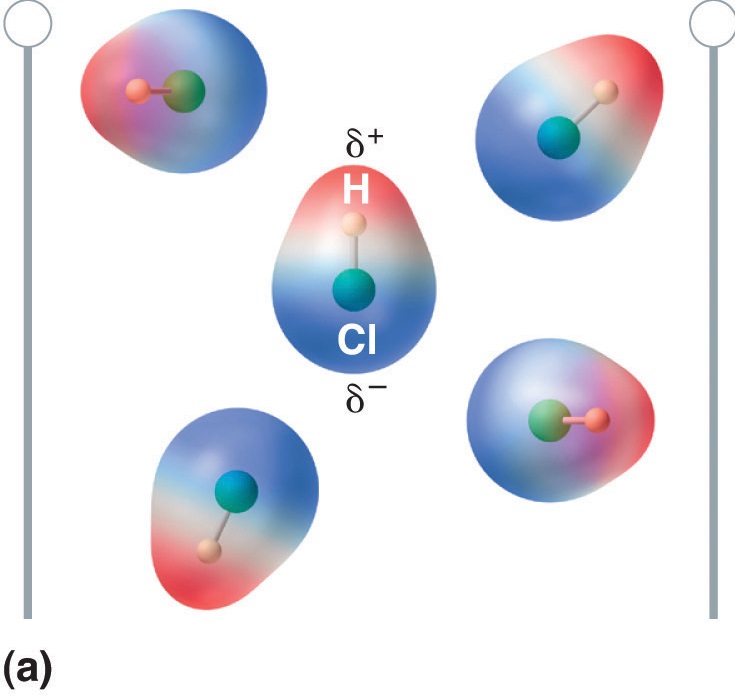
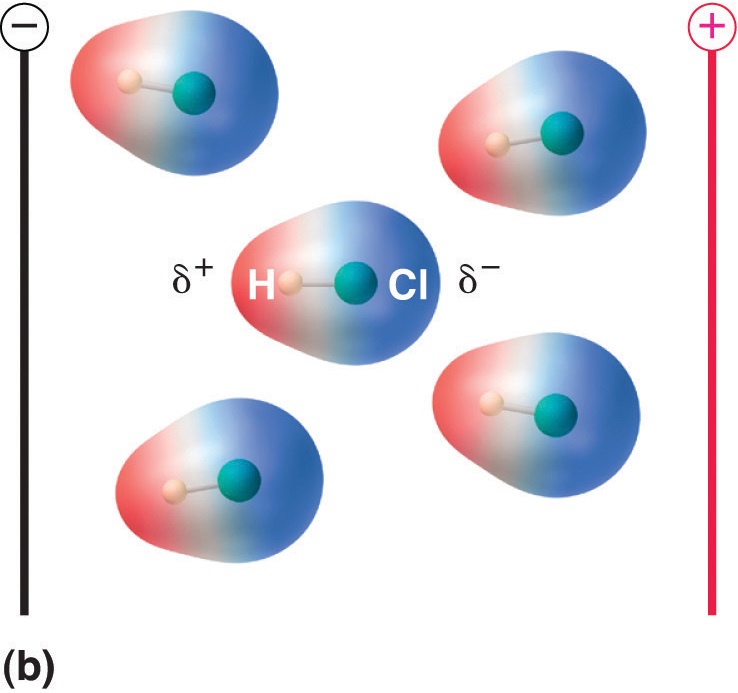
Figure \(\PageIndex{5}\) : Les molécules qui possèdent un moment dipolaire s’alignent partiellement avec un champ électrique appliqué. En l’absence de champ (a), les molécules de HCl sont orientées de manière aléatoire. Lorsqu’un champ électrique est appliqué (b), les molécules ont tendance à s’aligner avec le champ, de sorte que l’extrémité positive du dipôle moléculaire pointe vers la borne négative et vice versa.
Le moment dipolaire mesuré du HCl indique que la liaison H-Cl a un caractère ionique d’environ 18 % (0,1811 × 100), ou un caractère covalent de 82 %. Au lieu d’écrire HCl comme
\
nous pouvons donc indiquer la séparation de charge quantitativement comme
\
Nos résultats calculés sont en accord avec la différence d’électronégativité entre l’hydrogène et le chlore χH = 2,20 ; χCl = 3,16, χCl – χH = 0,96), une valeur bien dans la gamme des liaisons covalentes polaires. On indique le moment dipolaire en inscrivant une flèche au-dessus de la molécule. Mathématiquement, les moments dipolaires sont des vecteurs, et ils possèdent à la fois une magnitude et une direction. Le moment dipolaire d’une molécule est la somme vectorielle des dipôles des liaisons individuelles. Dans HCl, par exemple, le moment dipolaire est indiqué comme suit :
![]()
La flèche indique la direction du flux d’électrons en pointant vers l’atome le plus électronégatif.
La charge des atomes de nombreuses substances en phase gazeuse peut être calculée à l’aide des moments dipolaires mesurés et des distances entre les liaisons. La figure \(\PageIndex{6}\) montre un graphique du pourcentage de caractère ionique en fonction de la différence d’électronégativité des atomes liés pour plusieurs substances. D’après le graphique, la liaison dans des espèces telles que NaCl(g) et CsF(g) est sensiblement inférieure à 100 % de caractère ionique. Cependant, lorsque le gaz se condense en un solide, les interactions dipôle-dipôle entre les espèces polarisées augmentent les séparations de charge. Dans le cristal, un électron est donc transféré du métal au non-métal, et ces substances se comportent comme des composés ioniques classiques. Les données de la figure \(\PageIndex{6}\) montrent que les espèces diatomiques dont la différence d’électronégativité est inférieure à 1,5 ont un caractère ionique à moins de 50%, ce qui est cohérent avec notre description précédente de ces espèces comme contenant des liaisons covalentes polaires. L’utilisation des moments dipolaires pour déterminer le caractère ionique d’une liaison polaire est illustrée dans l’exemple \(\PageIndex{2}\).
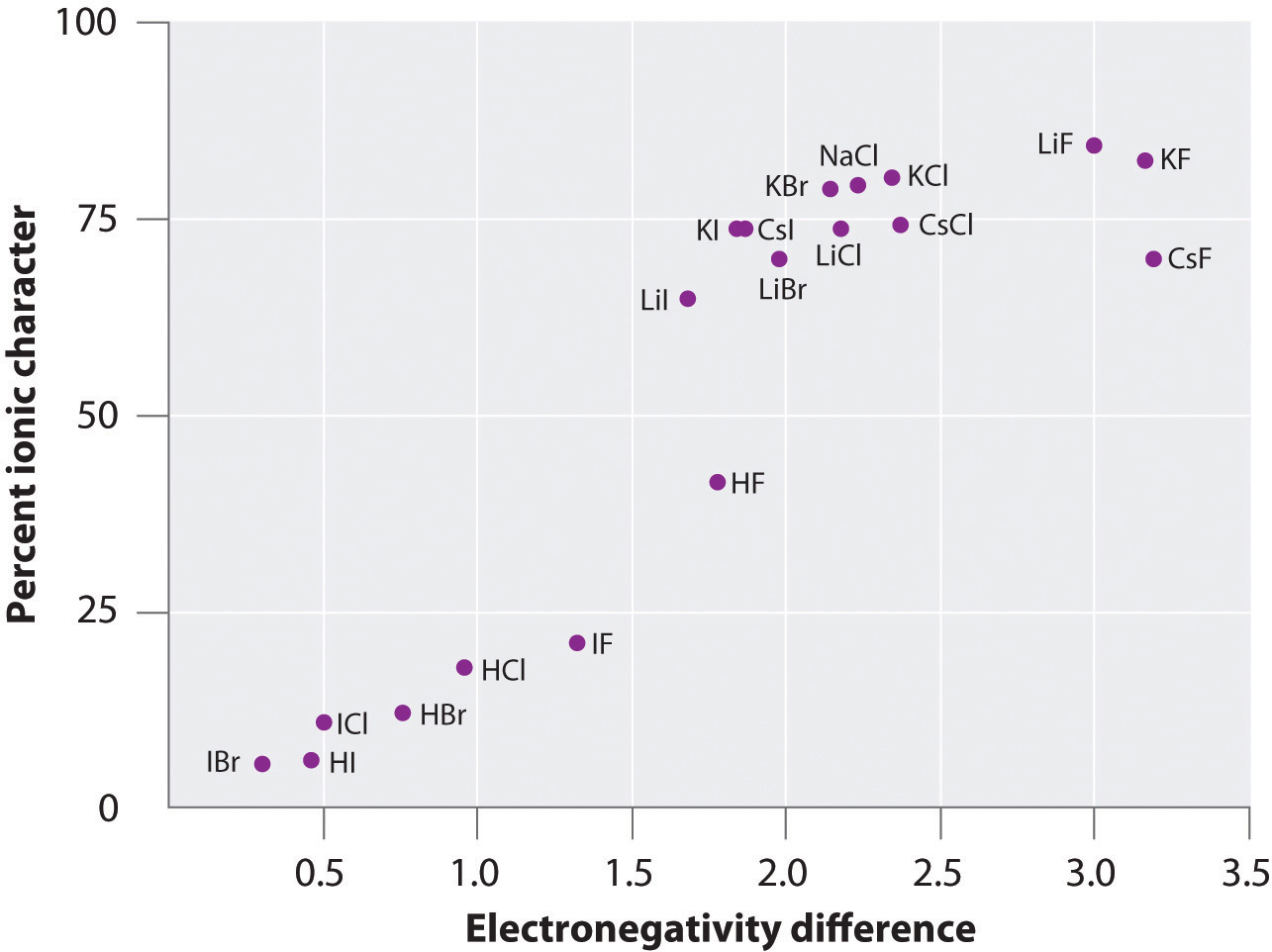
Figure \(\PageIndex{6}\) : Tracé du pourcentage de caractère ionique d’une liaison, déterminé à partir des moments dipolaires mesurés, en fonction de la différence d’électronégativité des atomes liés.En phase gazeuse, même le CsF, qui présente la plus grande différence possible d’électronégativité entre les atomes, n’est pas ionique à 100 %. En phase gazeuse, même le CsF, qui présente la plus grande différence possible d’électronégativité entre les atomes, n’est pas 100 % ionique. Le CsF solide, cependant, est mieux considéré comme 100 % ionique en raison des interactions électrostatiques supplémentaires dans le réseau.
