Enthalpie
La thermodynamique est l’étude de la relation entre la chaleur (ou l’énergie) et le travail. L’enthalpie est un facteur central de la thermodynamique. Il s’agit du contenu thermique d’un système. La chaleur qui entre ou sort du système au cours d’une réaction est le changement d’enthalpie. Que l’enthalpie du système augmente (c’est-à-dire lorsque de l’énergie est ajoutée) ou diminue (parce que de l’énergie est cédée) est un facteur crucial qui détermine si une réaction peut se produire.
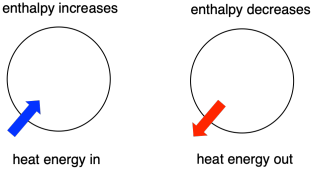
Parfois, nous appelons l’énergie des molécules subissant un changement l' »enthalpie interne ». Parfois, nous l’appelons « enthalpie du système ». Ces deux expressions font référence à la même chose. De même, l’énergie des molécules qui ne participent pas à la réaction est appelée « enthalpie externe » ou « enthalpie du milieu ».
En gros, les changements d’énergie que nous avons examinés dans l’introduction à la thermodynamique étaient des changements d’enthalpie. Nous verrons dans la prochaine section qu’il existe un autre facteur énergétique, l’entropie, que nous devons également prendre en compte dans les réactions. Pour l’instant, nous ne nous intéresserons qu’à l’enthalpie.
- L’enthalpie est le contenu calorifique d’un système.
- La variation d’enthalpie d’une réaction est à peu près équivalente à la quantité d’énergie perdue ou gagnée au cours de la réaction.
- Une réaction est favorisée si l’enthalpie du système diminue au cours de la réaction.
Cette dernière affirmation ressemble beaucoup à la description de l’énergétique à la page précédente. Si un système subit une réaction et dégage de l’énergie, son propre contenu énergétique diminue. Il lui reste moins d’énergie que s’il en avait libéré. Pourquoi l’énergie d’un ensemble de molécules change-t-elle lorsqu’une réaction se produit ? Pour répondre à cette question, nous devons réfléchir à ce qui se passe dans une réaction chimique.
Dans une réaction, il y a un changement de liaison chimique. Certaines des liaisons des réactifs sont rompues, et de nouvelles liaisons sont créées pour former les produits. La rupture des liaisons coûte de l’énergie, mais de l’énergie est libérée lorsque de nouvelles liaisons sont faites.
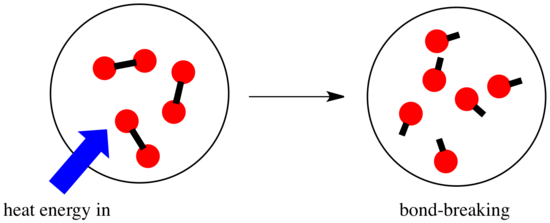
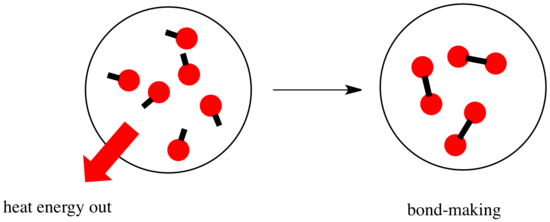
La possibilité pour une réaction d’avancer peut dépendre de l’équilibre entre ces étapes de fabrication et de rupture de liaisons.
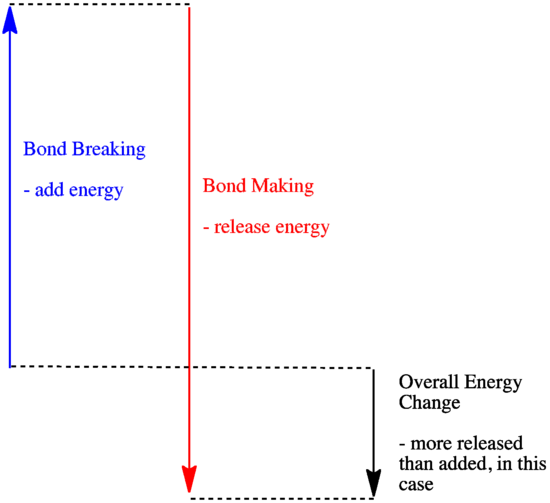
- Une réaction est exothermique si plus d’énergie est libérée par la formation de nouvelles liaisons que celle consommée par la rupture des anciennes liaisons.
- Une réaction est exothermique si des liaisons plus faibles sont échangées contre des liaisons plus fortes.
- Une réaction est endothermique si la rupture des liaisons coûte plus d’énergie que ce qui est fourni lors de la fabrication des liaisons.
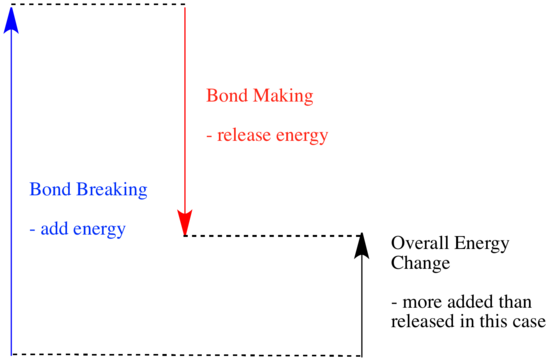
L’énergie des liaisons (la quantité d’énergie qui doit être ajoutée pour rompre une liaison) est un facteur important pour déterminer si une réaction va se produire. Les énergies de liaison ne sont pas toujours faciles à prédire, car la force d’une liaison dépend d’un certain nombre de facteurs. Cependant, beaucoup de gens ont fait beaucoup de travail pour mesurer la force des liaisons, et ils ont rassemblé les informations dans des tableaux, donc si vous avez besoin de savoir quelle est la force d’une liaison, vous pouvez simplement chercher l’information dont vous avez besoin.
| La liaison | L’énergie de liaison (kcal/mol) | La liaison | L’énergie de liaison (kcal/mol) |
| H-H | 104 | O-H | 111 |
| C-C | 83 | C-H | 99 |
| O=O | 119 | N-H | 93 |
| N=N | 226 | C=O | 180 |
Par exemple, supposons que vous vouliez savoir si la combustion du méthane est une réaction exothermique ou endothermique. Je vais supposer que c’est exothermique, parce que cette réaction (et d’autres comme elle) est utilisée pour fournir de la chaleur à beaucoup de maisons en brûlant du gaz naturel dans les fours.
La « combustion » du méthane signifie qu’il est brûlé dans l’air, afin qu’il réagisse avec l’oxygène. Les produits de la combustion des hydrocarbures sont principalement du dioxyde de carbone et de l’eau. L’atome de carbone du méthane (CH4) est incorporé dans une molécule de dioxyde de carbone. Les atomes d’hydrogène sont incorporés dans les molécules d’eau. Il y a quatre atomes d’hydrogène dans le méthane, donc c’est suffisant pour faire deux molécules de H2O.
- Quatre liaisons C-H doivent être rompues dans la combustion du méthane.
- Quatre nouvelles liaisons O-H sont faites lorsque les hydrogènes du méthane sont ajoutés dans de nouvelles molécules d’eau.
- Deux nouvelles liaisons C=O sont faites lorsque le carbone du méthane est ajouté dans une molécule de CO2.
L’autre pièce du puzzle est la source d’oxygène pour la réaction. L’oxygène est présent dans l’atmosphère principalement sous forme de O2. Comme nous avons besoin de deux atomes d’oxygène dans la molécule de CO2 et de deux autres atomes d’oxygène pour les deux molécules d’eau, nous avons besoin d’un total de quatre atomes d’oxygène pour la réaction, qui pourraient être fournis par deux molécules d’O2.
-
Deux liaisons O=O doivent être rompues pour fournir les atomes d’oxygène pour les produits.
En tout, cela représente quatre liaisons C-H et deux liaisons O=O rompues, plus deux liaisons C=O et quatre liaisons O-H réalisées. Cela représente 4 x 99 kcal/mol pour les liaisons C-H et 2 x 119 kcal/mol pour les liaisons O=O, soit un total de 634 kJ/mol ajoutés. La réaction libère 2 x 180 kcal/mol pour les liaisons C=O et 4 x 111 kcla/mol pour les liaisons OH, soit un total de 804 kcal/mol. Globalement, il y a 170 kcal/mol de plus libérés que consommés.
Cela signifie que la réaction est exothermique, donc qu’elle produit de la chaleur. C’est probablement un bon moyen de chauffer votre maison.
