


Avec un traitement anti-VEGF, les patients atteints de dégénérescence maculaire néovasculaire liée à l’âge présentent généralement des améliorations significatives de leur acuité visuelle et de leur qualité de vie. Bien que les résultats à court terme ne soient rien moins que spectaculaires, plusieurs questions importantes concernant la gestion à long terme de ces patients persistent. Elles comprennent :
- Quel est le meilleur agent ?
- À quelle fréquence doit-on traiter ?
- L’administration à long terme de ces agents entraîne-t-elle une perte de vision et des dommages ?
- De nouvelles plateformes sont-elles à l’horizon pour l’administration à long terme de ces agents ?
- Cet article répond à ces questions en se basant sur les résultats des essais cliniques pivots.
Les agents anti-VEGF sont-ils tous égaux ? A quelle fréquence faut-il traiter ?
En 2006, les études historiques ANCHOR et MARINA ont démontré l’efficacité et la sécurité du ranibizumab (Lucentis, Roche/Genentech) à posologie mensuelle. Les patients ont gagné 10,7 et 6,6 lettres, respectivement, au bout de deux ans.1-2 Par la suite, les études parallèles VIEW1 et VIEW2 ont montré une amélioration moyenne de la vision au bout de deux ans avec l’aflibercept (Eylea, Regeneron Pharmaceuticals) toutes les huit semaines après trois doses de charge mensuelles initiales.3
Des essais ultérieurs nous ont permis d’évaluer l’efficacité de ces médicaments en utilisant des intervalles de dosage moins fréquents, notamment des schémas trimestriels, pro re nata (PRN) et treat-and-extend. L’étude PIER a examiné une posologie trimestrielle de ranibizumab après trois doses de charge mensuelles et, bien que supérieure à l’observation, les patients de l’étude PIER ont perdu 2,3 lettres par rapport à la ligne de base à un an4.
L’une des premières exceptions a été PrONTO, un essai de phase I/II qui a évalué 40 patients sur deux ans avec une surveillance mensuelle et un retraitement PRN en fonction de l’acuité visuelle, de l’examen clinique et des paramètres de la tomographie par cohérence optique.5 Les résultats en matière d’acuité visuelle se sont rapprochés de ceux d’ANCHOR et de MARINA avec près de la moitié du nombre d’injections, mais l’étude ne comportait pas de groupe témoin de traitement mensuel. Ces résultats n’ont pas été reproduits dans les essais PRN ultérieurs.
L’essai HARBOR a comparé l’administration mensuelle et PRN du ranibizumab. Le groupe recevant mensuellement 0,5 mg a gagné 9,1 lettres à 24 mois contre 7,9 lettres pour le groupe PRN. Bien que cette différence ne soit pas statistiquement significative, le nombre médian d’injections (mais pas le nombre de visites) a été réduit de 21,4 à 13,3.6
CATT et IVAN étaient des études similaires qui ont comparé l’administration mensuelle et PRN du ranibizumab et du bevacizumab (Avastin, Roche/Genentech) hors indication. Après deux ans, la posologie PRN s’est avérée non inférieure au traitement mensuel dans les deux études (sauf pour le bevacizumab PRN dans l’étude CATT), bien qu’il y ait une tendance à une meilleure vision dans les groupes mensuels7,8. L’étude
TREX a comparé le ranibizumab mensuel à un régime de traitement prolongé (T&E).9 Une fois encore, la différence d’acuité visuelle n’était pas statistiquement significative (10,5 dans le groupe mensuel et 8,7 dans le groupe T&E), mais la tendance était à une meilleure vision dans le groupe mensuel. Le nombre moyen d’injections était de 25,5 contre 18,6 sur deux ans. Par ailleurs, aucun patient de la cohorte mensuelle n’a perdu plus de 2 lettres, alors que cinq patients du groupe T&E ont perdu au moins 3 lignes de vision.
Bien que ces études aient montré des résultats statistiquement similaires avec la posologie mensuelle à court terme, les résultats en données absolues ont été presque unanimement supérieurs avec la posologie mensuelle des agents anti-VEGF.
Que se passe-t-il après deux ans ?
Les données au-delà de deux ans de ces essais cliniques ne sont pas aussi faciles à interpréter et à appliquer que celles des essais cliniques, principalement parce que ces études d’extension ont principalement évalué la sécurité du médicament à long terme. Ainsi, le suivi et les calendriers de traitement n’étaient pas aussi rigoureux.

HORIZON était l’étude d’extension pour les patients des essais MARINA, ANCHOR et FOCUS. Ces patients n’ont pas suivi de protocole ; ils ont reçu un traitement à la discrétion des investigateurs lors de visites d’évaluation tous les trois à six mois. Après quatre ans, les patients de l’étude HORIZON ont essentiellement perdu les gains initiaux de VA et ont régressé jusqu’à la vision de base (-0,1 lettre).10 Une analyse plus poussée des données a révélé une association entre une meilleure vision et un plus grand nombre d’injections.
L’étude CATT sur cinq ans a évalué les patients suivis et traités à la discrétion des investigateurs après les deux premières années de l’essai. En moyenne, les patients ont perdu 3 lettres par rapport à la vision de départ. Les patients ont été vus en moyenne huit fois par an et ont reçu en moyenne cinq traitements par an.11 On s’est demandé si la perte de vision était due à un traitement insuffisant ou au développement d’une atrophie maculaire, mais l’essai n’avait pas la puissance nécessaire pour faire ressortir cette différence.12
L’étude de prolongation VIEW 1 a suivi les patients de manière plus rigoureuse. Les participants ont reçu des doses à intervalles fixes >q8 semaines, mais ils pouvaient recevoir des traitements plus fréquents s’ils répondaient à des critères préspécifiés. Dans cette extension, les patients ont conservé une bien meilleure vision, avec une vision moyenne de gain de 7,1 lettres par rapport au début de l’étude (contre un gain de 10,4 lettres lors du critère principal d’évaluation à un an).13
Que se passe-t-il à long terme et la fréquence de dosage a-t-elle de l’importance ?

Les meilleures données à long terme dont nous disposons proviennent d’études observationnelles. L’étude SEVEN-UP était une extension des essais sur le ranibizumab. Bien qu’il n’y ait pas eu de calendrier de visites préspécifié ni de protocole d’injection, les données fournissent certaines informations. Au bout de sept ans, les patients avaient perdu en moyenne 8,6 lettres par rapport au début de l’étude. Les patients qui n’ont reçu aucune injection au cours des trois années suivantes ont perdu 8,7 lettres par rapport à la ligne de base ; ceux qui ont reçu de une à cinq injections ont perdu 10,8 lettres ; ceux qui ont reçu de six à dix injections ont perdu 6,9 lettres ; et ceux qui ont reçu plus de 11 injections ont gagné 3,9 lettres par rapport à la ligne de base.14
Le Fight Retinal Blindness Study Group d’Australie a observé des patients traités par anti-VEGF pendant sept ans. Ces patients ont perdu en moyenne 2,6 lettres par rapport à la ligne de base, ayant reçu en moyenne cinq injections par an après la deuxième année, alors qu’ils avaient gagné 4 lettres par rapport à la ligne de base.15
Enfin, l’étude FIDO était une étude observationnelle monocentrique utilisant un dosage fixe q4 semaines pendant les deux premières années et >q8 semaines au-delà. Ces patients ont gagné 12,1 lettres par rapport à la ligne de base (d’un pic de 16,1 lettres à deux ans) avec une moyenne de 10,5 injections par an.16
Le message central de ces études d’observation à long terme est que clairement, en moyenne, plus d’injections se traduisaient par une meilleure vision.

Nous avons maintenant des données sur 10 ans
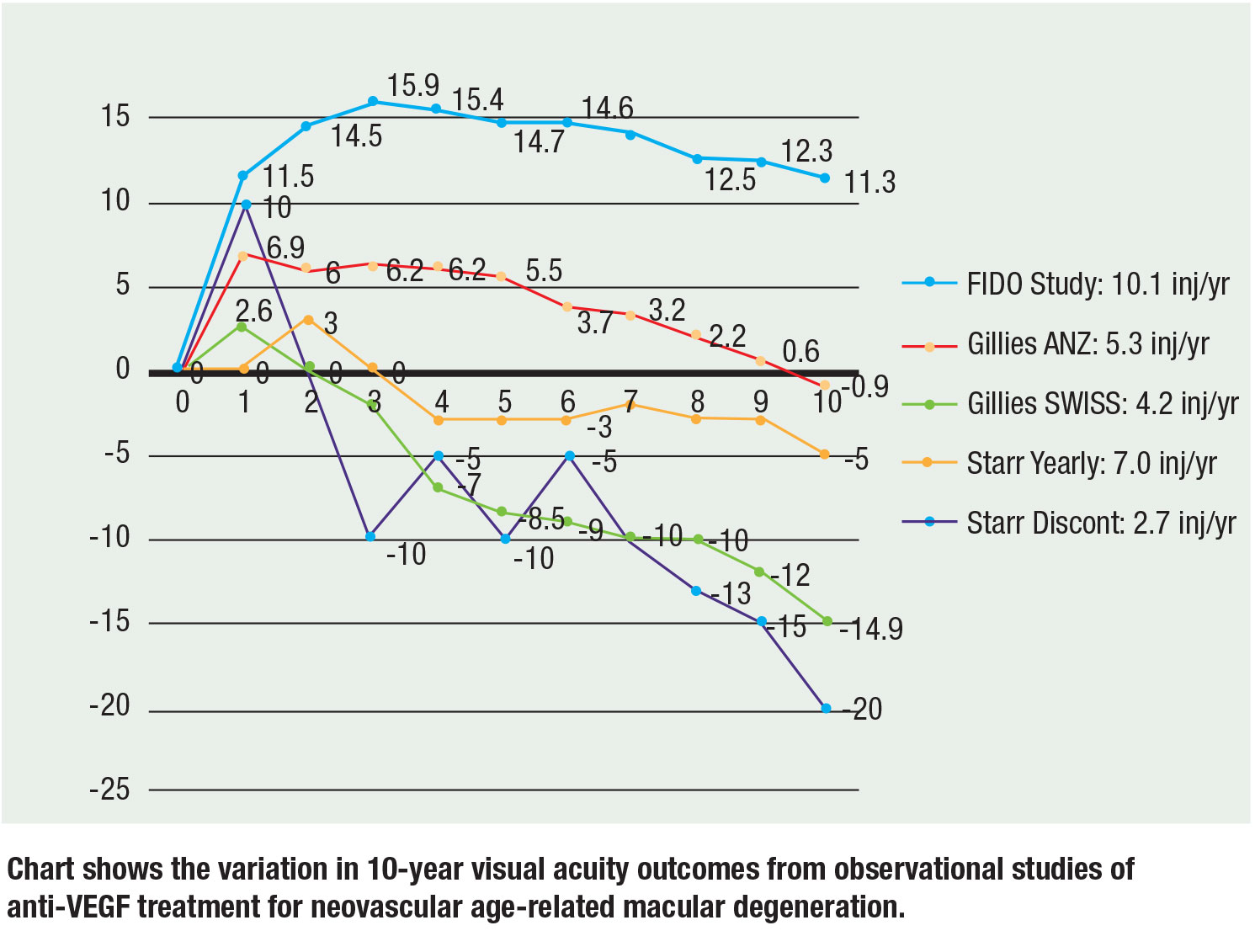
Récemment, trois grandes études d’observation ont rapporté des données sur 10 ans et les résultats restent cohérents : Plus d’injections se traduisent par une meilleure acuité visuelle. Mark Gillies, MD, et ses collègues ont rapporté des données d’observation provenant d’Australie-Nouvelle-Zélande et de Suisse. Chez les patients de l’ANZ, la vision moyenne a diminué de 0,9 lettre par rapport à la ligne de base à 10 ans avec une médiane de 5,3 injections par an sur un régime T&E par rapport aux patients suisses, dont la vision a diminué en moyenne de 14,9 lettres avec une médiane de 4,2 injections par an sur PRN. Leur conclusion était qu’un traitement continu et un plus grand nombre d’injections permettaient d’obtenir une meilleure vision.17
Matthew Starr, MD, et ses collègues ont évalué une cohorte comprenant des patients qui avaient reçu au moins deux injections. En moyenne, les patients ont reçu cinq à sept injections par an. Les yeux recevant au moins une injection par an ont perdu environ 7 lettres par rapport à la ligne de base, tandis que les yeux qui n’ont pas reçu au moins une injection annuelle ont perdu 15 lettres par rapport à la ligne de base.18
Notre cohorte FIDO de 10 ans a atteint une augmentation moyenne de la vision de 11,3 lettres à partir d’un pic de 15,9 avec une moyenne de 10,1 injections par an au cours de la période d’étude19.
Il est important de noter qu’il y a des risques inhérents aux comparaisons entre essais étant donné les différentes acuités visuelles initiales et les populations de patients, mais les pentes et les tendances tiennent à la corrélation entre plus d’injections et une meilleure vision. La figure (page 29) résume les données à 10 ans des trois essais.
Les traitements fréquents entraînent-ils une progression vers l’atrophie géographique ?
L’inquiétude de la progression de l’atrophie géographique avec le traitement anti-VEGF a été une préoccupation et une raison fréquemment invoquée pour ne pas traiter fréquemment. Certaines données suggèrent que le risque de perte de vision lié à un sous-traitement l’emporte largement sur cette inquiétude potentielle. L’essai SEVEN-UP a montré une plus grande incidence d’AG dans les yeux non traités que dans les yeux traités par anti-VEGF14.
De plus, les données à 10 ans de la FIDO ont démontré une incidence légèrement inférieure d’AG avec perte de vision à 10 ans dans les yeux traités par rapport aux autres yeux non traités (15 contre 19 pour cent).19 Il est probable que la progression d’un véritable AG est indépendante du
traitement anti-VEGF, et que ce qui est observé est un assèchement du complexe néovasculaire qui ressemble à un AG mais avec un impact moins délétère sur la vision.
La ligne de fond
Un traitement continu et régulier avec des agents anti-VEGF donne des résultats remarquables dans la gestion de la DMLA humide. Les données à long terme démontrent que le risque de perte de vision est plus important en cas de sous-traitement qu’en cas de traitement continu à intervalles réguliers, tel qu’il est actuellement appliqué dans les schémas posologiques à intervalles fixes ou les schémas conservateurs de type « treat-and-extend ». Les plateformes d’administration à long terme, telles que le système d’administration par port et la thérapie génique, semblent prometteuses pour réduire les obstacles à la non-conformité, la charge des visites fréquentes et les défis posés par les exigences de dosage individuel variable. RS
1. Brown DM, Kaiser PK, Michels M, et al. Ranibizumab versus verteporfin pour la dégénérescence maculaire néovasculaire liée à l’âge. N Engl J Med. 2006;355:1432-1444.
2. Rosenfeld PJ, Brown DM, Heier JS, et al. MARINA Study Group, Ranibizumab for neovascular age-related macular degeneration. N Engl J Med. 2006;355:1419-1431.
3. Schmidt-Erfurth U, Kaiser PK, Korobelnik JF, et al. Intravitreal aflibercept injection for neovascular age-related macular degeneration : ninety-six-week results of the VIEW studies. Ophtalmologie. 2014;121:193-201.
4. Regillo CD, Brown DM, Abraham P, et al. Essai randomisé, à double insu et contrôlé contre l’insu du ranibizumab pour la dégénérescence maculaire néovasculaire liée à l’âge : PIER Study year 1. Am J Ophthalmol. 2008;145:239-248.
5. Lalwani GA, Rosenfeld PJ, Fung AE, et al. Un schéma posologique variable avec le ranibizumab intravitréen pour la dégénérescence maculaire néovasculaire liée à l’âge : année 2 de l’étude PrONTO. Am J Ophthalmol. 2009;148:43-58.
6. Ho AC, Busbee BG, Regillo CD, et al, pour le groupe d’étude HARBOR. Efficacité et sécurité à vingt-quatre mois de 0,5 ou 2,0 mg de ranibizumab chez les patients atteints de dégénérescence maculaire liée à l’âge néovasculaire sous-fovéale. Ophtalmologie. 2014;121:2181-2192.
7. Martin DF, Maguire MG, Fine SL, et al, pour le groupe de recherche Comparison of Age-related Macular Degeneration Treatments Trials (CATT). Ranibizumab et bevacizumab pour le traitement de la dégénérescence maculaire néovasculaire liée à l’âge : résultats à deux ans. Ophtalmologie. 2012;119:1388-1398.
8. Chakravarthy U, Harding SP, Rogers CA, et al. Traitements alternatifs pour inhiber le VEGF dans la néovascularisation choroïdienne liée à l’âge : résultats à deux ans de l’essai de contrôle randomisé IVAN. Lancet. 2013;382:1258-1267.
9. Wykoff CC, Ou WC, Brown DM, et al. Essai randomisé de traitement et de prolongation par rapport à une dose mensuelle pour la dégénérescence maculaire néovasculaire liée à l’âge : résultats à 2 ans de l’étude TREX-AMD. Ophthalmol Retina. 2017;1:314-321.
10. Singer MA, Awh CC, Sadda S, et al. HORIZON : un essai d’extension ouvert du ranibizumab pour la néovascularisation choroïdienne secondaire à la dégénérescence maculaire liée à l’âge. Ophtalmologie. 2012;119:1175-1183.
11. Maguire MG, Martin DF, Ying GS, et al. Résultats à cinq ans du traitement par facteur de croissance endothélial vasculaire de la dégénérescence maculaire liée à l’âge néovasculaire : The comparison of age-related macular degeneration treatments trials. Ophtalmologie. 2016;123:1751-1761.
12. Grunwald JE, Pistilli M, Ying GS, et al. Croissance de l’atrophie géographique dans la comparaison des essais de traitements de la dégénérescence maculaire liée à l’âge. Ophtalmologie. 2015;122:809-816.
13. Kaiser PK, Singer M, Tolentino M, et al. Sécurité à long terme et résultat visuel de l’aflibercept intravitréen dans la dégénérescence maculaire liée à l’âge néovasculaire. Ophthalmol Retina. 2017;1:304-313.
14. Rofagha S, Bhisitkul RB, Boyer DS, Sadda SR, Zhang K, pour le groupe d’étude SEVEN-UP. et al. Seven-year outcomes in ranibizumab-treated patients in ANCHOR, MARINA, and HORIZON : A multicenter cohort study (SEVEN-UP). Ophtalmologie. 2013;120:2292-2299.
15. Gillies MC, Campain A, Barthelmes D, et al, pour le groupe d’étude Fight Retinal Blindness. Résultats à long terme du traitement de la dégénérescence maculaire néovasculaire liée à l’âge : Data from an observational study. Ophtalmologie. 2015;122:1837-1845.
16. Peden MC, Suñer IJ, Hammer ME, Grizzard WS. Résultats à long terme chez les yeux recevant des doses à intervalle fixe d’agents anti-facteur de croissance endothélial vasculaire pour la dégénérescence maculaire liée à l’âge humide. Ophtalmologie. 2015;122:803-808.
17. Gillies M, Arnold J, Bhandari S, et al. Résultats à dix ans de la dégénérescence maculaire liée à l’âge néovasculaire de deux régions. Am J Ophthalmol. 2020;210:116-124.
18. Starr MR, Kung FF, Bui YT, et al. Suivi à dix ans de patients atteints de dégénérescence maculaire liée à l’âge exsudative traités par des injections intravitréennes de facteur de croissance endothélial anti-vasculaire. Retina. Publié en ligne le 13 novembre 2019.
19. Suñer IJ, Peden MC, Hammer ME, Grizzard WS. Résultats à dix ans chez les yeux recevant des doses à intervalle fixe d’agents de facteur de croissance endothélial anti-vasculaire pour la dégénérescence maculaire liée à l’âge humide. Document présenté à la Retina Society 2019 ; 12 septembre 2019 ; Londres, Royaume-Uni.
20. Campochiaro PA, Marcus DM, Awh CC, et al. Le système d’administration par port avec le ranibizumab pour la dégénérescence maculaire liée à l’âge néovasculaire : résultats de l’essai clinique randomisé de phase 2 LADDER. Ophtalmologie. 2019;126:1141-1154.
21. Ho AC ; le groupe d’étude Janssen/ORBIT. Programmes de livraison de précision pour la thérapie cellulaire et génique. Document présenté à : Vail Vitrectomy Meeting ; 10 février 2019 ; Vail, CO.
22. Thérapie génique ADVM-022 pour la DMLA humide (OPTIC). Sponsor : Adverum Biotechnologies. Identificateur ClinicalTrials.gov : NCT03748784. Disponible à l’adresse suivante : https://clinicaltrials.gov/ct2/show/NCT03748784. Consulté le 18 avril 2020.
23. RegenxBio annonce les résultats financiers et opérationnels du premier trimestre 2019 et une mise à jour supplémentaire positive intermédiaire de l’essai de phase I/IIa du RGX-314 pour le traitement de la DMLA humide . Rockville, MD ; 7 mai 2019. https://www.prnewswire.com/news-releases/regenxbio-reports-first-quarter-2019-financial-and-operating-results-and-additional-positive-interim-phase-iiia-trial-update-for-rgx-314-for-the-treatment-of-wet-amd-300845423.html Consulté le 9 juillet 2020.
