Nom générique : vert d’indocyanine
Formation posologique : injection, poudre, lyophilisée, pour solution
Médicament revu par Drugs.com. Dernière mise à jour le 1er octobre 2020.
- Effets secondaires
- Dosage
- Professionnel
- Interactions
- Grossesse
- Plus
Indications et utilisation de IC-Green
IC-Green® est indiqué :
Pour la détermination du débit cardiaque, de la fonction hépatique et du débit sanguin hépatique
Dosage et administration de l’IC-Green
Études de dilution de colorant
Dans la réalisation de courbes de dilution de colorant, une quantité connue de colorant est injectée en un seul bolus aussi rapidement que possible via un cathéter cardiaque dans des sites sélectionnés du système vasculaire. Un instrument d’enregistrement (oxymètre ou densitomètre) est fixé à une aiguille ou un cathéter pour le prélèvement du mélange colorant-sang à partir d’un site de prélèvement artériel systémique.
Dans des conditions stériles, la poudre IC-Green® doit être dissoute avec l’eau stérile pour injection, USP fournie pour ce produit, et la solution doit être utilisée dans les 6 heures suivant sa préparation. Si un précipité est présent, jeter la solution.
Les doses habituelles d’IC-Green® pour les courbes de dilution sont les suivantes :
Adultes – 5,0 mg
Enfants – 2,5 mg
Infants – 1,25 mg
Ces doses de colorant sont habituellement injectées dans un volume de 1 mL. Une moyenne de cinq courbes de dilution est recommandée lors de la réalisation d’un cathétérisme cardiaque diagnostique. La dose totale de colorant injectée doit rester inférieure à 2 mg/kg.
Alors que l’eau stérile pour injection peut être utilisée pour rincer la seringue, une solution saline isotonique doit être utilisée pour rincer le colorant résiduel du cathéter cardiaque dans la circulation afin d’éviter une hémolyse. A l’exception du rinçage de la seringue d’injection du colorant, une solution saline doit être utilisée dans toutes les autres parties de la procédure de cathétérisme.
Calibrage des courbes de colorant : Pour quantifier les courbes de dilution, des dilutions standard d’IC-Green® dans le sang total sont réalisées comme suit . Il est fortement recommandé d’utiliser le même colorant que celui qui a été utilisé pour les injections dans la préparation de ces dilutions standard. La solution de colorant la plus concentrée est réalisée en diluant avec précision 1 ml de colorant à 5 mg/ml dans 7 ml d’eau distillée. Cette concentration est ensuite successivement divisée par deux en diluant 4 mL de la concentration précédente avec 4 mL d’eau distillée.
Si une concentration de 2,5 mg/mL a été utilisée pour les courbes de dilution, 1 mL du colorant à 2,5 mg/mL est ajouté à 3 mL d’eau distillée pour réaliser la solution « standard » la plus concentrée. Cette concentration est ensuite successivement divisée par deux en diluant 2 mL de la concentration précédente avec 2 mL d’eau distillée.
Puis des portions de 0,2 mL (mesurées avec précision à l’aide d’une seringue calibrée) de ces solutions de colorant sont ajoutées à des aliquotes de 5 mL du sang du sujet, ce qui donne des concentrations finales de colorant dans le sang commençant par 24,0 mg/litre, approximativement (la concentration réelle dépend du volume exact de colorant ajouté). Cette concentration est, bien entendu, successivement divisée par deux dans les aliquotes successives du sang du sujet. Ces aliquotes de sang contenant des quantités connues de colorant, ainsi qu’un échantillon à blanc auquel on a ajouté 0,2 ml de solution saline ne contenant pas de colorant, sont ensuite passés dans l’instrument de détection et une courbe d’étalonnage est construite à partir des déflexions enregistrées.
Etudes de la fonction hépatique
En raison de son spectre d’absorption, on peut suivre l’évolution des concentrations d’IC-Green® (vert d’indocyanine pour injection) dans le sang par densitométrie auriculaire ou en prélevant des échantillons de sang à intervalles réguliers. La technique pour les deux méthodes est la suivante.
Le patient doit être étudié à jeun, à l’état basal. Le patient doit être pesé et la posologie calculée sur la base de 0,5 mg/kg de poids corporel.
Dans des conditions stériles, la poudre IC-Green® doit être dissoute avec l’eau stérile pour injection, USP fournie. Il faut ajouter exactement 5 ml d’eau stérile pour injection, USP au flacon de 25 mg, ce qui donne 5 mg de colorant par ml de solution.
Injecter la quantité calculée de colorant (0,5 mg/kg de poids corporel) dans la lumière d’une veine du bras aussi rapidement que possible, sans laisser le colorant s’échapper à l’extérieur de la veine. (Si la méthode photométrique est utilisée, avant d’injecter IC-Green®, prélever 6 ml de sang veineux du bras du patient pour le blanc de sérum et la construction de la courbe standard, et par la même aiguille, injecter la quantité correcte de colorant.)
Densitométrie auriculaire : L’oxymétrie auriculaire a également été utilisée et permet de suivre l’apparition et la disparition de l’IC-Green® sans qu’il soit nécessaire de procéder à un prélèvement et à une analyse spectrophotométrique des échantillons de sang pour l’étalonnage. Il convient d’utiliser un densitomètre auriculaire qui possède une cellule photoélectrique de compensation pour corriger les variations du volume sanguin et de l’hématocrite, et une cellule photoélectrique de détection qui enregistre les niveaux. Cet appareil permet de mesurer simultanément le débit cardiaque, le volume sanguin et la clairance hépatique d’IC-Green®*. Cette technique a été employée chez des nouveau-nés, des adultes en bonne santé et chez des enfants et des adultes atteints de maladies du foie. Chez le sujet normal, le taux d’élimination est de 18 à 24 % par minute. En raison de l’absence d’élimination extra-hépatique, IC-Green® s’est révélé adapté à l’étude en série des maladies hépatiques chroniques graves et à la mesure stable du débit sanguin hépatique. A doses plus importantes, IC-Green® peut être utilisé dans la détection des altérations de la fonction hépatique induites par les médicaments et dans la détection des lésions hépatiques légères.
En utilisant le densitomètre auriculaire, une dose de 0,5 mg/kg chez des sujets normaux donne le schéma de clairance suivant .
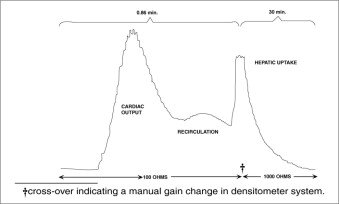
*Densitomètre auriculaire bichromatique fourni par The Waters Company, Rochester, Minnesota.
Méthode photométrique –
Détermination à l’aide du pourcentage de rétention du colorant:
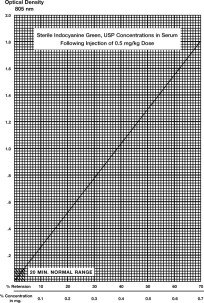
Une courbe typique obtenue en traçant la concentration du colorant en fonction de la densité optique est présentée. Le pourcentage de rétention peut être lu à partir de ce tracé. Si des résultats plus précis sont souhaités, une courbe utilisant le sang du patient et le flacon d’IC-Green® utilisé pour la détermination peut être construite comme suit :
- Prélever 6 ml de sang veineux ne contenant pas de colorant sur le bras du patient. Le placer dans un tube à essai et laisser le sang coaguler. Le sérum doit être séparé par centrifugation.
- Pipette 1 mL du sérum dans une microcuvette.
- Ajouter 1 lambda (λ) de la solution aqueuse IC-Green® (vert d’indocyanine stérile) à 5 mg/mL au sérum, ce qui donne une dilution de 5 mg/litre, la norme pour une rétention de 50 %. (L’ajout de 2 lambda (λ) de la solution IC-Green® à 5 mg/mL donnerait une rétention de 100% ; cependant, cette concentration ne peut pas être lue sur le spectrophotomètre.)
- La densité optique de cette solution doit être lue à 805 nm, en utilisant du sérum normal comme blanc.
- En utilisant un papier graphique similaire à celui utilisé dans l’illustration, tracer le chiffre de 50% obtenu à l’étape 4, et tracer une ligne reliant ce point aux coordonnées du zéro.
Rétention en pourcentage : Un seul échantillon de 20 minutes (prélevé dans une veine du bras opposé à celui injecté) doit être prélevé et laissé coaguler, centrifugé et sa densité optique déterminée à 805 nm en utilisant le sérum normal du patient comme blanc. La concentration du colorant peut être lue à partir de la courbe ci-dessus. Un seul échantillon de sérum de 20 minutes chez des sujets sains ne doit pas contenir plus de 4 % de la concentration initiale du colorant. L’utilisation du pourcentage de rétention est moins précise que le pourcentage de disparition. L’hémolyse ne devrait pas interférer avec une lecture.
Détermination à l’aide du taux de disparition du colorant : Pour calculer le taux de disparition en pourcentage, obtenir des échantillons à 5, 10, 15 et 20 minutes après l’injection du colorant. Préparez l’échantillon comme dans la section précédente et mesurez les densités optiques à 805 nm, en utilisant le sérum normal du patient comme blanc. La concentration d’IC-Green® dans chaque échantillon chronométré doit être déterminée à l’aide de la courbe de concentration illustrée. Les valeurs doivent être reportées sur du papier semilogarithmique.
Les échantillons contenant de l’IC-Green® doivent être lus à la même température car sa densité optique est influencée par les variations de température.
Valeurs normales : Le taux de disparition en pourcentage chez les sujets sains est de 18 à 24% par minute. La demi-vie biologique normale est de 2,5 à 3,0 minutes.
Etudes d’angiographie ophtalmique
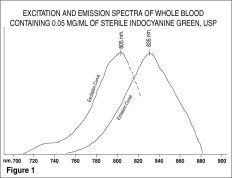
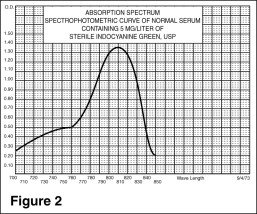
Les spectres d’excitation et d’émission (figure 1) et les spectres d’absorption (figure 2) de l’IC-Green® le rendent utile en angiographie ophtalmique.
Des dosages allant jusqu’à 40 mg de colorant IC-Green® dans 2 ml d’eau stérile pour injection, USP doivent être utilisés, selon l’équipement et la technique d’imagerie utilisés. La veine antécubitale peut être injectée avec un bolus de colorant IC-Green® et doit être immédiatement suivie d’un bolus de 5 mL de solution saline normale.
Formes posologiques et dosages
IC-Green® est une poudre verte stérile et lyophilisée contenant 25 mg de vert d’indocyanine avec pas plus de 5% d’iodure de sodium.
Contre-indications
IC-Green® contient de l’iodure de sodium et doit être utilisé avec prudence chez les patients ayant des antécédents d’allergie aux iodures en raison du risque d’anaphylaxie.
Avertissements et précautions
Anaphylaxie
Des décès par anaphylaxie ont été rapportés après l’administration d’IC-Green® lors d’un cathétérisme cardiaque.
Instabilité du médicament
IC-Green® est instable en solution aqueuse et doit être utilisé dans les 6 heures. Cependant, le colorant est stable dans le plasma et le sang total, de sorte que les échantillons obtenus par des techniques de prélèvement discontinu peuvent être lus quelques heures plus tard. Des techniques stériles doivent être utilisées pour la manipulation de la solution de colorant ainsi que pour l’exécution des courbes de dilution. Si un précipité est présent, jeter la solution.
Interactions médicament/test de laboratoire
Les études de captation de l’iode radioactif ne doivent pas être réalisées pendant au moins une semaine après l’utilisation d’IC-Green®.
Réactions indésirables
Des réactions anaphylactiques ou urticariennes ont été rapportées chez des patients avec ou sans antécédents d’allergie aux iodures. Si de telles réactions se produisent, traiter avec les agents appropriés, par ex, épinéphrine, antihistaminiques et corticostéroïdes.
Interactions médicamenteuses
Les préparations contenant du bisulfite de sodium, y compris certains produits à base d’héparine réduisent le pic d’absorption d’IC-Green® dans le sang et, par conséquent, ne doivent pas être utilisées comme anticoagulant pour le prélèvement d’échantillons à analyser.
Utilisation dans des populations particulières
Grossesse
Des études de reproduction animale n’ont pas été menées avec IC-Green®. On ne sait pas non plus si IC-Green® peut causer des dommages au fœtus lorsqu’il est administré à une femme enceinte ou peut affecter la capacité de reproduction. IC-Green® ne doit être administré à une femme enceinte que si cela est clairement indiqué.
Mères allaitantes
On ne sait pas si ce médicament est excrété dans le lait maternel. Comme de nombreux médicaments sont excrétés dans le lait maternel, il faut faire preuve de prudence lorsque IC-Green® est administré à une femme qui allaite.
Utilisation pédiatrique
L’innocuité et l’efficacité chez les patients pédiatriques ont été établies. Voir POSOLOGIE ET ADMINISTRATION (2) pour des informations posologiques spécifiques chez les patients pédiatriques.
Utilisation gériatrique
Aucune différence globale de sécurité ou d’efficacité n’a été observée entre les patients âgés et les patients plus jeunes.
Surdosage
Il n’existe aucune donnée décrivant les signes, les symptômes ou les résultats de laboratoire accompagnant le surdosage. La DL50 après administration intraveineuse est comprise entre 60 et 80 mg/kg chez la souris, 50 et 70 mg/kg chez le rat et 50 et 80 mg/kg chez le lapin. En fonction de la surface corporelle, ces doses représentent 2,4 à 13 fois la dose maximale recommandée pour l’homme (MRHD) de 2 mg/kg pour les études de dilution des indicateurs, 10 à 52 fois la MRHD de 0,5 mg/kg pour les études sur la fonction hépatique, et 7 à 39 fois la MRHD de 0.67 mg/kg pour les études d’angiographie ophtalmique.
IC-Green Description
IC-Green® est une poudre verte stérile et lyophilisée contenant 25 mg de vert d’indocyanine avec pas plus de 5% d’iodure de sodium. Il est conditionné avec de l’eau stérile pour injection, USP utilisée pour dissoudre le vert d’indocyanine. IC-Green® doit être administré par voie intraveineuse.
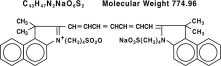
Le vert d’indocyanine est un colorant tricarbocyanine hydrosoluble dont le pic d’absorption spectrale se situe à 800 nm. Le nom chimique du vert d’indocyanine est 1 H-Benzindolium, 2- indol-2-ylidène]-1,3,5-heptatriényl]-1,1-diméthyl-3-(4-sulfobutyl)-,hydroxyde, sel interne, sel de sodium. IC-Green® a un pH d’environ 6,5 lorsqu’il est reconstitué. Chaque flacon d’IC-Green® contient 25 mg de vert d’indocyanine sous forme de poudre lyophilisée stérile.
IC-Green – Pharmacologie clinique
IC-Green® permet l’enregistrement des courbes d’indicateur-dilution à des fins de diagnostic et de recherche indépendamment des fluctuations de la saturation en oxygène. Après injection intraveineuse, IC-Green® se lie rapidement aux protéines plasmatiques, dont l’albumine est le principal vecteur (95%). IC-Green® ne subit aucune circulation extrahépatique ou entérohépatique significative ; des estimations simultanées de sang artériel et veineux ont montré une absorption rénale, périphérique, pulmonaire ou cérébro-spinale négligeable du colorant. IC-Green® est absorbé du plasma presque exclusivement par les cellules parenchymateuses hépatiques et est entièrement sécrété dans la bile. Après une obstruction biliaire, le colorant apparaît dans la lymphe hépatique, indépendamment de la bile, ce qui suggère que la muqueuse biliaire est suffisamment intacte pour empêcher la diffusion du colorant, tout en permettant la diffusion de la bilirubine. Ces caractéristiques font de IC-Green® un indice utile de la fonction hépatique.
Le pic d’absorption et d’émission de IC-Green® se situe dans une région (800 à 850 nm) où la transmission de l’énergie par l’épithélium pigmentaire est plus efficace que dans la région de l’énergie lumineuse visible. IC-Green® a également la propriété d’être lié à près de 98 % aux protéines sanguines, ce qui évite une extravasation excessive du colorant dans le système vasculaire choroïdien hautement fenestré. Il est donc utile en angiographie infrarouge d’absorption et de fluorescence de la vascularisation choroïdienne lors de l’utilisation de filtres et de films appropriés dans une caméra de fond d’œil.
Le taux de disparition fractionnelle du plasma à la dose recommandée de 0,5 mg/kg a été signalé comme étant significativement plus élevé chez les femmes que chez les hommes, bien qu’il n’y ait pas de différence significative dans la valeur calculée de la clairance.
Toxicologie non clinique
Carcinogenèse, mutagenèse, altération de la fertilité
Aucune étude n’a été réalisée pour évaluer la cancérogénicité, la mutagenèse ou l’altération de la fertilité.
Mode de fourniture/entreposage et manipulation
IC-Green® est fourni dans une trousse (NDC 17478-701-02) contenant six flacons de 25 mg d’IC-Green® et six ampoules de 10 mL d’eau stérile pour injection, USP :
NDC 17478-701-25 flacon d’IC-Green®. Remplissage de 25 mg dans un flacon de 20 mL.
NDC 17478-701-10 Ampoule d’eau stérile pour injection, USP. Remplir l’ampoule de 10 mL.
CONTEMPTION : Conserver entre 20° et 25°C (68° et 77°F).
AKORN
Fabriqué par : Akorn, Inc.
Lake Forest, IL 60045
IG00N Rev. 06/16
Texte principal d’affichage pour l’étiquette du contenant :
NDC 17478-701-25
IC-Green®
(vert d’indocyanine
pour injection, USP)
25 mg Rx stérile seulement

Texte principal d’affichage pour l’étiquette du carton :
Logo Akorn NDC 17478-701-02
IC-Green®
(vert d’indocyanine
pour injection, USP)
Kit de 25 mg
Rx stérile uniquement

Texte principal de l’étiquette du récipient :
NDC 17478-701-10
Eau stérile
pour injection, USP
pour IC-Green® (indocyanine
verte pour injection, USP)
10 mL Rx stérile uniquement

Texte principal de l’étiquette du carton :
NDC 17478-701-10
Logo Akorn
Eau stérile
pour injection, USP
pour IC-Green®
(vert indocyanine
pour injection, USP)
Stérile
6 Ampoules
(10 mL chacune) Rx seulement

| IC-Vert Kit vert d’indocyanine |
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
Partie 1 de 2 CI.Vert
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
Partie 2 de 2 SOLVANT AQUEUX
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
Étiqueteur – Akorn, Inc. (117696770)
Étiquetteur – Akorn, Inc. Akorn Operating Company LLC (117693100)
| Establishment | |||
| Nom | Adresse | ID/FEI | Opérations |
| Akorn, Inc. | 117696790 | LABEL(17478-701), PACK(17478-701) | |
| Etablissement | |||
| Nom | Adresse | ID/FEI | Opérations |
| Akorn, Inc. | 117696832 | Fabrication(17478-701), ANALYSE(17478-701), STÉRILISATION(17478-701) | |
