Introduction
La bronchopneumopathie chronique obstructive (BPCO) est une cause importante de mortalité et de morbidité dans le monde moderne. Le taux de mortalité de cette maladie est en augmentation et on prévoit qu’elle deviendra la troisième cause de décès dans le monde d’ici 2020.1 Il n’est pas possible de définir la BPCO en se basant uniquement sur le volume expiratoire forcé dans les 1s (VEMS), c’est pourquoi la Global Initiative for Chronic Obstructive lung Disease (GOLD) a conçu une définition multidimensionnelle pour évaluer la BPCO.2 La nouvelle définition inclut la prévalence des symptômes et les antécédents d’exacerbations en plus de la valeur du VEMS et met également l’accent sur l’évaluation des comorbidités. Pour évaluer les symptômes, il est recommandé d’utiliser le test modifié du Medical Research Council (mMRC) ou le COPD Assessment Test (CAT). En outre, une échelle de qualité de vie spécifique à la maladie (SGRQ, SF-36, CCQ) a été utilisée pour évaluer l’impact de la maladie sur la vie quotidienne. Certaines études ont démontré une forte relation entre le CAT et le questionnaire respiratoire de St George (SGRQ).3,4 Ladeira et al.5 ont montré que le CAT était corrélé à l’indice BODE.
La BPCO est une maladie complexe et comprend des composantes génétiques, cellulaires et moléculaires. Il existe de nombreuses cellules et molécules différentes impliquées dans les voies inflammatoires. Plusieurs indicateurs ont été utilisés pour démontrer une éventuelle inflammation systémique liée à la maladie.6-9 L’inflammation des voies aériennes et du parenchyme pulmonaire est un mécanisme pathogène majeur de la BPCO. En outre, une inflammation systémique persistante peut être associée à diverses comorbidités extrapulmonaires et à des effets pulmonaires.10 Des recherches récentes ont apporté la preuve de l’existence d’un » nouveau phénotype inflammatoire systémique distinct de la BPCO « . 7 Une étude récente a montré que la comorbidité cardiovasculaire et le diabète étaient associés à des niveaux plus élevés de certains marqueurs de l’inflammation systémique.11 Par conséquent, la charge génétique, l’inflammation systémique et les maladies comorbides sont associées à divers phénotypes de la BPCO. Il est essentiel de développer de nouvelles perspectives dans la gestion de cette maladie.
À l’heure actuelle, la TAO est de plus en plus utilisée pour évaluer et surveiller la BPCO. Bien que plusieurs biomarqueurs sériques aient été définis dans la BPCO, il n’y a pas un seul biomarqueur unique suffisant et efficace qui puisse être utilisé pour évaluer l’état des patients atteints de BPCO. Il a été démontré que les biomarqueurs sont associés à plusieurs paramètres tels que l’inflammation, l’hospitalisation et la mortalité.7-13 Cependant, la relation entre la CAT et les biomarqueurs n’a pas été clairement démontrée. Par conséquent, la présente étude vise à enquêter sur les niveaux d’inflammation systémique dans la BPCO et à déterminer la relation entre la CAT et les marqueurs d’inflammation et la qualité de vie.
Matériels et méthodesDispositif de l’étude
Il s’agissait d’une étude observationnelle transversale à visite unique. Cent dix patients atteints de BPCO diagnostiqués selon les critères GOLD14 et soixante-cinq sujets témoins ont été recrutés entre février 2013 et août 2013. Les sujets témoins ont été choisis parmi ceux qui étaient adressés à une clinique de pneumologie et de médecine interne de l’hôpital universitaire de Balikesir et qui subissaient des examens de routine. Un consentement éclairé écrit a été obtenu de tous les participants et l’étude a été approuvée par le comité d’éthique institutionnel de la faculté de médecine de l’université de Balikesir.
Tous les patients ont été soumis à un examen physique, une radiographie pulmonaire, une épreuve fonctionnelle respiratoire et des tests d’analyse sanguine de routine. Le nombre d’exacerbations au cours de l’année précédente et les antécédents de tabagisme ont été enregistrés. Le CAT, le score de dyspnée mMRC ont été réalisés par des entretiens en face-à-face avec des pneumologues. Les scores SGRQ ont été rapportés par les patients. Pour le groupe témoin sain, seules une épreuve fonctionnelle respiratoire et des analyses sanguines de routine ont été réalisées.
La population de l’étude
Critères d’inclusion : Les patients étaient inclus s’ils : (1) étaient âgés de plus de 40 ans ; (2) étaient fumeurs ou ex-fumeurs avec un historique de tabagisme ≥10 paquets-années ; (3) présentaient un VEMS post-bronchodilatateur
80% et un VEMS/FVC0,7. Les sujets témoins ont été inclus s’ils : (1) étaient âgés de plus de 40 ans ; (2) n’avaient pas de maladie pulmonaire telle que déterminée par un médecin ; (3) présentaient une spirométrie normale (VEMS>85% et VEMS/FVC>0,7) ; et (4) avaient un historique de tabagisme de
Critères d’exclusion : Ont été exclus les patients qui : (1) ont eu une exacerbation de la BPCO au cours des 6 semaines précédentes ; (2) avaient un trouble respiratoire autre que la BPCO ou une tumeur maligne ; (3) avaient une maladie inflammatoire chronique (vascularite, maladie intestinale inflammatoire, arthrite rhumatoïde, etc.) (4) avait une maladie concomitante non contrôlée ou sévère (IM, arythmie, etc.).
Mesures
Les caractéristiques démographiques, l’âge, le sexe, les habitudes tabagiques, l’admission dans un service d’urgence ou l’hospitalisation au cours de la dernière année, les maladies accompagnantes et les traitements existants ont tous été enregistrés de manière appropriée. Nous avons défini une exacerbation comme une aggravation des symptômes qui a nécessité des corticostéroïdes oraux et/ou des antibiotiques et/ou une hospitalisation. Les maladies concomitantes ont été établies à partir des antécédents cliniques et des résultats de l’examen physique au cours de la visite et ont été confirmées par un examen des dossiers médicaux disponibles. Les médicaments actuels, y compris les inhalateurs, les antihypertenseurs ou d’autres médicaments, ont été documentés. Les indices de taille, de poids et d’IMC ont été mesurés, et une spirométrie a également été effectuée conformément aux directives internationales (ATS/ERS).15 La maladie a été classée selon l’ancienne et la nouvelle version de la stadification GOLD.14 Premièrement, la stadification spirométrique GOLD (basée sur le VEMS (1-4)) et deuxièmement, la stadification GOLD (classe A-D). La dyspnée a été évaluée par l’échelle de dyspnée mMRC.16 Les patients atteints de BPCO ont été classés en A, B, C et D en combinant l’évaluation des symptômes par les scores de dyspnée mMRC et le risque d’exacerbation.
CAT : La validité et la fiabilité de la version turque de cette échelle ont été vérifiées précédemment.17 Le CAT comprend 8 items et donne des scores totaux allant de 0 à 40 ; des scores plus élevés indiquent une altération plus sévère de l’état de santé ou un contrôle moins réussi de la BPCO.3
Questionnaire sur la qualité de vie : La qualité de vie a été évaluée à l’aide de la traduction turque du questionnaire sur les maladies respiratoires de Saint-Georges (SGRQ).18
Biomarqueurs
Nous avons choisi les biomarqueurs sur la base d’études antérieures.7,9-13 Les échantillons de sang prélevés sur tous les sujets ont été centrifugés et conservés à -80°C. Tous les échantillons ont été analysés à la fin de l’étude. Le sérum a été étudié dans un appareil de diagnostic (BioTek, ELx 800, USA) à l’aide de kits commerciaux (eBioscience, Human TNF-α and Human IL-6 Platinum ELISA, Autriche), et avec les méthodes de dosage immuno-enzymatique (ELISA) du taux de nécrose tumorale alpha (TNF-α) et d’interleukine-6 (IL-6). Les niveaux de protéine C-réactive (CRP) ont été évalués avec un analyseur de chimie clinique (Cobes Integra 800, Roche diagnostics) en utilisant un kit commercial. La valeur de référence de la CRP est de 0-0,5mg/L, tandis que la valeur la plus faible analysée de l’IL-6 est de 0,92pg/ml. La valeur minimale analysée du TNFα est de 2,3pg/ml. Les concentrations de TNF-α et d’IL-6 de certains échantillons étaient inférieures à la limite inférieure de quantification (LQM). Dans l’analyse des individus présentant des valeurs inférieures à la limite inférieure de quantification, un niveau nominal de la moitié de la valeur de la limite inférieure de quantification a été utilisé pour éviter un biais vers le bas des données de la population.19
Analyse statistique
Les valeurs moyennes de CRP des groupes BPCO et témoin (3,2 (1,5,7,1), 1,3 (0,6,2,7)) ont été identifiées à partir d’études similaires.7 Ensuite, dans chaque groupe, la taille de l’échantillon a été calculée en utilisant la formule de calcul de la moyenne avec une précision de 80 % et une erreur de 5 %. En conséquence, la taille de l’échantillon s’est avérée être d’au moins 55 sujets dans chaque groupe. Les résultats sont présentés sous forme de moyenne±DS, de médiane ou de pourcentage, selon le cas. Le test t de Student et l’ANOVA ont été utilisés pour les tests paramétriques ; le test U de Mann-Whitney, les statistiques de Kruskal-Wallis et de chi-deux ont été utilisées pour les tests non-paramétriques de comparaison des groupes. Le test exact de Fisher a évalué les différences entre les pourcentages de comorbidités et les différences entre les sexes. Le test du chi-deux a évalué les différences entre les pourcentages de comorbidités. La corrélation par paire des variables continues chez les patients atteints de BPCO a été examinée par la corrélation de Pearson. Une valeur de p
0,05 a été considérée comme statistiquement significative. Toutes les analyses statistiques ont été réalisées avec le logiciel SPSS (version 20.0).RésultatsCaractérisation clinique des sujets
L’étude a inclus 110 patients (âge moyen de 64±8,9 ans ; 100 hommes (90,9%)), et 65 sujets témoins (âge moyen de 61,5±9,2 ans, 55 hommes (84,6%)). Les caractéristiques démographiques et cliniques des groupes de patients et de contrôle sont indiquées dans le tableau 1. Quarante-cinq (40,9 %) patients atteints de BPCO avaient une maladie concomitante (cardiopathie ischémique (n=21), hypertension (n=13), diabète sucré (n=8), autre (n=3)). Le VEMS moyen était de 48,8% de la valeur prédite et le VEMS/CVF moyen de 55,4% dans le groupe BPCO. Le score CAT moyen était de 22,6 (±9,2), le mMRC : 1,9 (±0,9) et le SGRQ total : 58,4 (±22,2). Sur les 110 patients, 9,1 % étaient au stade 1, 37,3 % au stade 2, 42,7 % au stade 3 et 10,9 % au stade 4 selon la classification spirométrique GOLD. Lorsque les patients ont été classés par rapport à la stadification GOLD, 27,3% étaient du groupe A, 30,9% du groupe B, 7,3% du groupe C et 34,5% du groupe D.
Caractéristiques démographiques, fonctionnelles, cliniques des groupes de patients et de contrôle.
| Patient (n=110) | Contrôle (n=65) | p-value | ||
|---|---|---|---|---|
| Age | 64.0±8.9 | 61.5±9.2 | 0,080 | |
| Homme n, (%) | 100 (90,9) | 55 (84.6) | 0,224 | |
| BMI, kg/m2 | 26,5±5,6 | 25±2,6 | 0.064 | |
| Pack-années | 38,9±23 | 0,1±1,2 | ||
| Co-morbidités, n (%) | ||||
| Toute | 65 (59.1) | 42 (64,6) | 0,95 | |
| Cardiopathie ischémique | 21(19,1) | 11 (16,9) | ||
| HT | 13 (11.8) | 6 (9,2) | ||
| DM | 8 (7,3) | 4 (6,2) | ||
| Autre | 3 (2.7) | 2 (3,1) | ||
| mMRC | 1,94±0,9 | 0,04±0,2 | ||
| FEV1, % prédit | 48,8±17.8 | 89.4±5.6 | ||
| FVC, % prédit | 68.7±17.8 | 92.1±5.8 | ||
| FEV1/FVC, % | 55.4±12,9 | 89,6±4,7 | ||
| Stade spirométrique OR, n (%) | ||||
| 1 | 10 (9.1) | |||
| 2 | 41 (37.3) | |||
| 3 | 47 (42.7) | |||
| 4 | 12 (10.9) | |||
| Stade OR, n (%) | ||||
| A | 30 (27.3) | |||
| B | 34 (30.9) | |||
| C | 8 (7,3) | |||
| D | 38 (34.5) | |||
| SGRQ-score total | 58,4±22,2 | |||
| Score CAT | 22.6±9,2 | |||
| TNFα (pg/ml) | 109,5±58 | 14,6±18 | ||
| IL-6 (pg/ml) | 10.3±18 | 2,14±1,9 | ||
| CRP (mg/L) | 1,6±1,7 | 0,4±0,3 | ||
Abréviations : IMC, indice de masse corporelle, HT : hypertension, DM : diabète, VEMS : volume expiratoire forcé en 1 seconde, CVF : capacité vitale forcée, CAT : COPD assessment test.
Comparaisons BPCO/contrôle
Il n’y avait pas de différence significative entre les âges (p=0,080, test t de Student) et les sexes des deux groupes (p=0,453, test exact de fisher) (tableau 1). Les groupes présentaient des incidences similaires de comorbidités (p=0,095, test χ2). Comme prévu, les patients atteints de BPCO présentaient des paramètres de fonction pulmonaire (VEMS, CVF, VEMS/CVF) significativement plus faibles que les témoins (p
0,001, test t de Student). En général, les patients atteints de BPCO présentaient des taux sériques plus élevés de CRP (1,6±1,7mg/L) et de TNF-α (109,5±58pg/ml) et d’IL-6 (10,3±18pg/ml) que les témoins sains (CRP : 0,4±0,3mg/L, p0,001 ; TNF-α : 14,6±18pg/ml, p0,001 ; IL-6 : 2,14±1,9pg/ml, p0,001, test t de Student) (Tableau 1).Association des questionnaires CAT et des caractéristiques des patients
Il y avait une corrélation entre le score CAT et le stade spirométrique GOLD (r de Pearson=0,43 ; p
0,001). Le score CAT augmente parallèlement à la gravité de la maladie. Il existe une relation statistiquement significative entre le score CAT et le nombre d’exacerbations au cours de l’année précédente (r=0,35 de Pearson, p0,001), la durée de la maladie (r=0,29 de Pearson, p0,001), le tabagisme (paquet-année) (r=0,27 de Pearson, p=0,014) et le mMRC (r=0,59 de Pearson, p0,001). Le score CAT s’est avéré être significativement corrélé au VEMS (r de Pearson = 0,39, p0,001) et à la CVF (r de Pearson = 42, p=0,003). Parallèlement, une forte corrélation a été observée entre le score CAT et les scores SGRQ symptôme, activité, impact et total (r=0,72 de Pearson ; p0,001).Association entre les biomarqueurs et les caractéristiques des patients
Les marqueurs inflammatoires et les paramètres de la fonction pulmonaire ont été comparés. Au fur et à mesure que le VEMS diminuait, les niveaux de biomarqueurs augmentaient significativement. Les niveaux de CRP étaient corrélés avec le VEMS (r=-0,39 de Pearson, p
0,001), la CVF (r=-0,33 de Pearson, p0,001) et le VEMS/CVF (r=-0,38 de Pearson, p0,001). Les niveaux de TNF-α étaient également corrélés avec le VEMS (r=-0,57, p0,001), la CVF (r=-0,37, p0,001) et le VEMS/CVF (r=-0,66, p0,001). Les niveaux d’IL-6 étaient également corrélés avec le VEMS (r=-0,31 de Pearson, p0,001), la CVF (r=-0,32 de Pearson, p0,001) et le VEMS/CVF (r=-0,34 de Pearson, p0,001). Une corrélation significative a été observée entre CRP, TNF-α, IL-6 et le tabagisme (paquet-année) (r=0,35, r=0,44, r=0,27, p0,001, respectivement, selon Pearson). Les patients atteints de BPCO et souffrant de maladies cardiovasculaires présentaient un niveau accru de CRP (2,98±2.4mg/L) par rapport aux patients sans comorbidités (1,56±1,5mg/L, p=0,008 test ANOVA suivi du test post hoc LSD). Il n’y avait pas d’association significative avec d’autres biomarqueurs et comorbidités. Plus l’IL-6 augmentait, plus le score mMRC augmentait, mais cette relation n’était pas statistiquement significative (p=0,06). Lorsque les marqueurs inflammatoires ont été comparés au score CAT, les niveaux de CRP ont montré une corrélation significative (r=0,43, p0,001) (Fig. 1) alors qu’aucune corrélation n’a été observée avec le TNF-α et l’IL-6. Il existait une corrélation entre les niveaux de CRP et le TNFα (r=0,48, p0,001). Aucune association directe n’a été observée entre les biomarqueurs et la classe A-D ou les stades spirométriques.
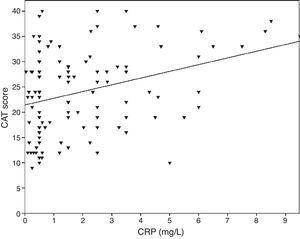
La relation entre les scores CAT et CRP (r=0,43, p0,001).
Discussion
Certains outils d’évaluation sont utilisés tels que les tests cliniques (CAT, BODE), les marqueurs d’inflammation et les questionnaires de qualité de vie pour évaluer la BPCO. Il est communément admis qu’une évaluation multidimensionnelle est nécessaire pour comprendre et gérer la maladie. La BPCO est un trouble complexe avec une composante systémique et certains patients semblent présenter un phénotype inflammatoire. Dans cette étude, la CAT a été réalisée en tant que nouveau test clinique, et la relation de la CAT avec d’autres composantes de la BPCO a été étudiée.
L’une de ces composantes est l’inflammation systémique. Les biomarqueurs les plus souvent étudiés dans la BPCO pour indiquer l’inflammation systémique qui sont couramment utilisés sont la CRP, l’IL-6, le TNF-α, l’IL-8 et le fibrinogène. Plusieurs études ont précédemment rapporté des taux circulants élevés de ces marqueurs chez les patients atteints de BPCO stable.6-9,20-23 Dans une étude récente, Agustí et al. ont montré que 30 % des patients atteints de BPCO ne présentaient pas de signes d’inflammation systémique et que 16 % des patients présentaient une inflammation systémique persistante.7 Il est intéressant de noter que dans cette étude, les taux sériques de TNF-α et d’IL-8 étaient plus élevés chez les fumeurs avec une spirométrie normale que chez les patients atteints de BPCO. Les autres marqueurs comme les globules blancs, l’IL-6, la CRP et le fibrinogène étaient plus élevés chez les patients BPCO que chez les fumeurs avec une spirométrie normale et les non-fumeurs. Dans notre étude, les niveaux de CRP, TNF-α, IL-6 étaient significativement plus élevés chez tous les patients BPCO par rapport au groupe de contrôle. Tous les biomarqueurs étaient corrélés à l’exposition cumulative au tabac et à la réduction des paramètres des tests de la fonction pulmonaire (VEMS, CVF et VEMS/CVF). Le niveau des biomarqueurs est lié au degré d’obstruction des voies respiratoires. Ces résultats sont cohérents avec ceux rapportés dans des études transversales antérieures.13 Dans une autre étude qui a examiné les résultats de l’étude ECLIPSE, les comorbidités cardiovasculaires et le diabète ont été corrélés avec certains marqueurs d’inflammation systémique.9 Dans notre étude, les patients atteints de BPCO et de maladies cardiovasculaires présentaient un niveau accru de CRP par rapport aux patients sans comorbidités. L’augmentation de l’inflammation systémique chez les BPCO avec des maladies cardiovasculaires soutient un mécanisme pathophysiologique entre la BPCO et ces comorbidités.
La relation entre la CAT et l’inflammation systémique n’a pas été clarifiée par les études menées jusqu’à présent. Dans une étude, une corrélation significative a été montrée entre les LCN1, LCN2 et la CAT.8 Dans notre étude, une relation significative a été montrée entre la CAT et la CRP. Cependant, une corrélation similaire n’a pas pu être montrée avec le TNF-α et l’IL-6.
Dans la présente étude, les patients atteints de BPCO ont été classés en quatre groupes (A-D) et stades (1-4) selon l’ancienne et la nouvelle version de la classification GOLD. On peut observer que le stade 1 et le stade 4 constituent la plus petite proportion de la population avec 10% chacun selon l’ancienne classification. Dans la nouvelle version, la population était répartie de manière presque égale entre les groupes A, B et D ; la plus petite distribution était celle du groupe C. Dans d’autres études, il a également été montré que le groupe C constituait la plus petite proportion de la distribution.24,25 La nouvelle classification indique qu’il peut y avoir des patients présentant des symptômes multiples mais une obstruction légère des voies respiratoires, ainsi que des patients présentant peu de symptômes mais une obstruction sévère des voies respiratoires. Les comorbidités et l’inflammation systémique peuvent entraîner une augmentation de l’exacerbation et des symptômes chez les patients présentant une obstruction légère/modérée, et c’est ainsi que ces patients sont placés dans les groupes à haut risque (classe C ou D). Dans une étude, il a été démontré que le sous-type C comprend les patients présentant un statut de comorbidité plus élevé et que le sous-type D comprend les patients présentant l’exacerbation la plus sévère, un taux élevé d’exacerbation lié à l’hospitalisation et les résultats les plus faibles26. Dans une étude récente, Agustí et al. ont comparé deux groupes avec et sans inflammation systémique persistante et ont montré que les patients présentant une inflammation persistante pendant le suivi avaient des taux d’exacerbation plus élevés par an par rapport à l’autre groupe bien que les anomalies pulmonaires étaient similaires dans ces deux groupes.7
GOLD recommande l’utilisation de l’échelle CAT ou mMRC pour évaluer les symptômes. Nous avons utilisé l’échelle mMRC pour l’affectation des groupes, car lorsque nous avons considéré les symptômes sur la base du CAT, le nombre de patients ayant moins de 10 points de rupture était très faible (8 patients). Les scores CAT plus élevés peuvent être associés à une meilleure perception des symptômes des patients. Il a également été démontré que le CAT et le mMRC ne sont pas équivalents, ce qui peut entraîner certaines différences dans la classification.24,25,27 Dans la nouvelle classification, les autres points de coupure sont composés du nombre d’exacerbations par an. La relation entre le score CAT basal et la fréquence des exacerbations a été démontrée chez les patients atteints de BPCO.28 Pothirat et al. ont montré que le changement du score CAT au cours des visites de contrôle est un outil utile pour détecter une détérioration aiguë de l’état de santé des patients atteints de BPCO.29 Dans notre étude, une forte relation a été observée entre le CAT, le mMRC et les taux d’exacerbation. La CAT s’est également avérée être corrélée à la durée de la maladie et au tabagisme (paquet-année). Le VEMS moyen des patients était de 48,8 % de la valeur prédite et le score CAT moyen était de 22,6. Une forte association a été démontrée entre le CAT et le VEMS, le CVF et le stade spirométrique GOLD. Plus le VEMS et la CVF diminuaient, plus le score CAT augmentait. Le score CAT était également corrélé positivement avec un stade GOLD plus lourd. Ces résultats montrent que le CAT reflète très bien la sévérité de la maladie.
Une autre composante importante de la prise en charge de la BPCO est la qualité de vie. Une variété de questionnaires de vie ont été utilisés pour évaluer les effets de la maladie sur la vie quotidienne. La fiabilité et la validité de la version turque du SGRQ ont été prouvées.30 Quelques études ont montré qu’une corrélation significative était observée entre le CAT et le SGRQ.3,4 Dans une étude, il a été rapporté que le CAT est sensible au changement de l’état de santé associé aux exacerbations de la BPCO.31 Dans notre étude, une forte relation a été montrée entre le CAT et le SGRQ. Puisque le CAT, comparé au SGRQ, est un test plus court et plus facile à comprendre, l’utilisation du CAT est plus pratique.
La présente étude présente plusieurs limites, telles que la conception transversale, une étude dans un seul centre et un petit échantillon. En outre, les marqueurs d’inflammation n’ont pas pu être comparés chez les fumeurs qui ont une fonction pulmonaire normale, car ils n’ont pas été inclus dans la présente étude. Les médicaments des patients peuvent exercer une influence sur la réponse inflammatoire systémique et l’état de santé et ils peuvent également affecter les résultats.
En résumé, le CAT est un test qui peut être utilisé dans l’évaluation de la BPCO, puisque sa fiabilité et sa validité ont été clairement démontrées. Les résultats de notre étude indiquent la relation entre le CAT et la CRP ainsi que d’autres composantes de la BPCO (paramètres cliniques, fonctionnels). Cependant, des études longitudinales multicentriques sont nécessaires pour évaluer la relation entre la CAT et les biomarqueurs.
Divulgations éthiquesProtection des sujets humains et animaux
Les auteurs déclarent qu’aucune expérience n’a été réalisée sur des humains ou des animaux pour cette étude.
Confidentialité des données
Les auteurs déclarent avoir suivi les protocoles de leur centre de travail sur la publication des données des patients et que tous les patients inclus dans l’étude ont reçu des informations suffisantes et ont donné leur consentement éclairé écrit pour participer à l’étude.
Droit à la vie privée et consentement éclairé
Les auteurs ont obtenu le consentement éclairé écrit des patients ou des sujets mentionnés dans l’article. L’auteur correspondant est en possession de ce document.
Authorship
Conception de l’étude : NS, FE et AAH ; Collecte des données : NS, CB ; Analyse et interprétation des données : NS, AAH et CB ; Révision critique du manuscrit : NS, FE, CB et AAH.
Conflits d’intérêts
Les auteurs déclarent ne pas avoir de conflit d’intérêts dans la préparation de ce manuscrit.
