- Qu’est-ce que l’entropie ?
- Qu’est-ce que la troisième loi de la thermodynamique ?
- Importance de la troisième loi de la thermodynamique
La troisième loi de la thermodynamique stipule que lorsque la température d’un système s’approche du zéro absolu, son entropie devient constante, ou la variation de l’entropie est nulle. La troisième loi de la thermodynamique prédit les propriétés d’un système et le comportement de l’entropie dans un environnement unique connu sous le nom de température absolue.
L’entropie d’un système borné ou isolé devient constante lorsque sa température s’approche de la température absolue (zéro absolu).
La thermodynamique est l’une des branches les plus importantes et les plus étudiées des sciences physiques. Autre que de tourmenter les étudiants en génie mécanique pour la plupart de leur vie académique, son omniprésence est vu de la brise froide de mon climatiseur à l’un des sommets de l’ère industrielle – le moteur à vapeur. Sa mise en œuvre est régie par trois lois, connues sous le nom de lois de la thermodynamique. Ces lois définissent comment le travail, la chaleur et l’énergie affectent un système. Un système est une région de l’Univers qui est limitée de manière finie et à travers laquelle l’énergie est transférée. Tout ce qui se trouve à l’extérieur de cette limite est son environnement.
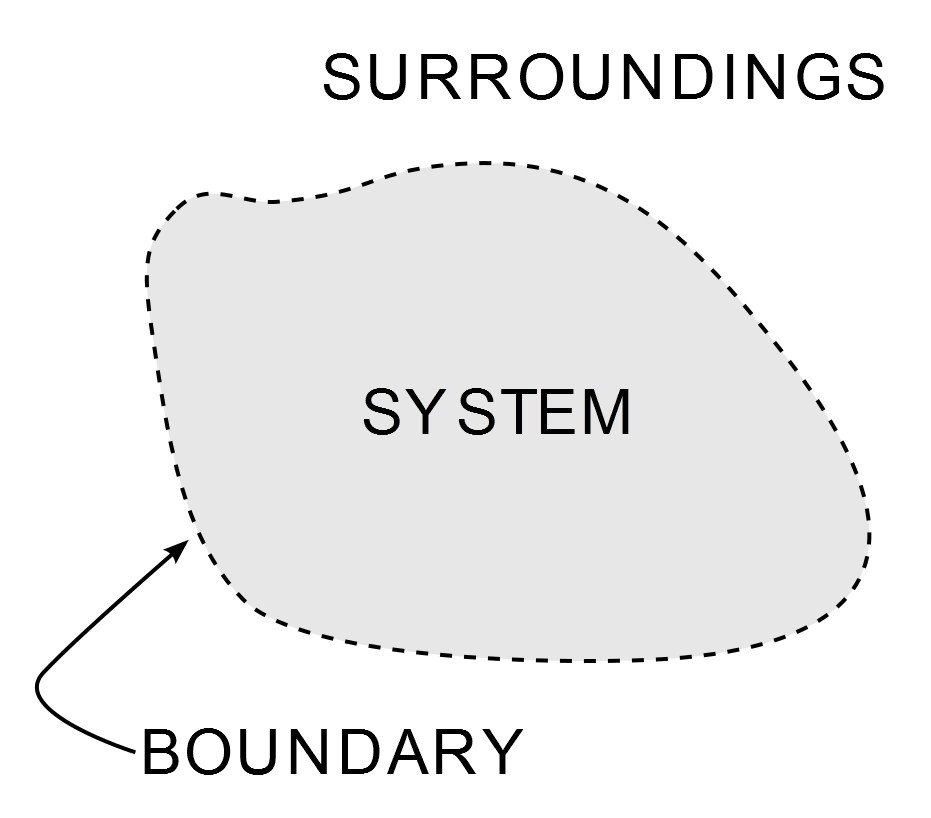
Illustration d’un système en thermodynamique. (Crédit photo : Wavesmikey / Wikipedia Commons)
Qu’est-ce que l’entropie ?
Alors que la première loi de la thermodynamique implique que l’Univers a commencé avec une énergie utilisable finie, où un système tirant de l’énergie la dépensera en partie en effectuant un travail et en partie en augmentant sa température interne, la deuxième loi explore ses implications. Cela inclut la conversion de cette énergie utilisable finie en énergie inutilisable ; par exemple, la formation de la matière qui s’est produite il y a des milliards d’années en raison de la condensation de l’énergie avec laquelle l’Univers a commencé. Dans ce processus, l’énergie utilisable finie est maintenant convertie en énergie inutilisable.
Cette énergie inutilisable est mesurée par quelque chose appelé « Entropie », un baromètre pour mesurer le caractère aléatoire ou le désordre dans un système.
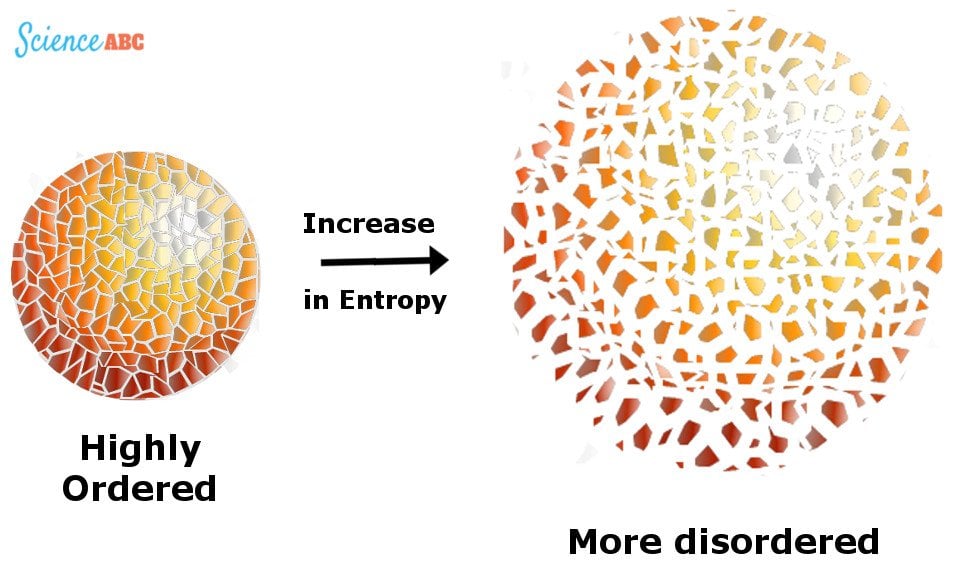
Illustration de l’entropie comme une augmentation du désordre.
L’Univers est comme une pièce remplie de vêtements qui traînent de manière non organisée. L’entropie de ce système augmente à mesure que de plus en plus de vêtements sont utilisés et jetés, complétant le désordre, à moins que l’habitant ne fasse un effort pour les ramasser et les organiser, ce qui réduit ce désordre.
En considérant l’Univers comme un seul système, il n’y a rien dans son environnement pour en tirer de l’énergie, donc avec toute son énergie convertie en énergie inutilisable, tout ce qui reste derrière est un endroit froid et sombre. C’est ce qu’on appelle la mort thermique et c’est l’une des façons dont l’Univers pourrait se terminer. Un système borné comme notre Univers possède des sources d’énergie finies, comme ses étoiles brillantes, qui brûleront pendant des lustres avant de se rendre aux lois cruelles de la nature.

Qu’est-ce que la troisième loi de la thermodynamique ?
La troisième loi de la thermodynamique prédit les propriétés d’un système et le comportement de l’entropie dans un environnement unique connu sous le nom de température absolue. La température absolue est la plus basse température connue et fixe une limite inférieure à la gamme de température de l’Univers.
Comme c’est cool ! Non, sérieusement, à quel point c’est froid ? La température absolue est de 0 Kelvin, l’unité standard de température ou -273.15 degrés Celsius ! La température absolue est également connue sous le nom de zéro absolu dans certains cercles et pays. Cette échelle vous donnera une idée.
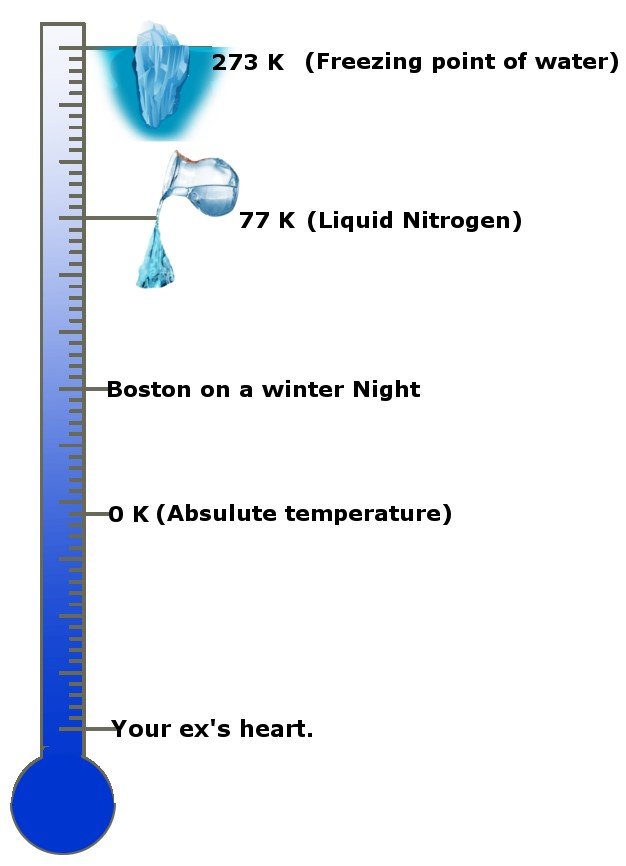
La troisième loi stipule que lorsque la température d’un système s’approche du zéro absolu, son entropie devient constante, ou le changement d’entropie est nul.

L’énoncé est représenté par cette équation, où T ressemble à la température et delta S à la variation de l’entropie du système. La dénotation « tend vers zéro » représentée par une flèche pointant vers zéro implique que lorsque la température diminue jusqu’à une valeur infinitésimale, le système atteint une entropie constante en tirant de l’énergie de son environnement, mais comme la première loi le dicte, une partie de cette énergie s’ajoutera à l’énergie interne du système, niant ainsi un état d’entropie constante.
Importance de la troisième loi de la thermodynamique
La troisième loi est rarement applicable à notre vie quotidienne et régit la dynamique des objets aux plus basses températures connues. Elle définit ce que l’on appelle un « cristal parfait », dont les atomes sont collés dans leurs positions. Le cristal parfait ne possède donc absolument aucune entropie, ce qui n’est réalisable qu’à la température absolue.
Le concept d’entropie a également été populaire dans certaines théories définissant objectivement l’écoulement continu du temps, comme l’augmentation linéaire de l’entropie de l’Univers.
Idéalement, à 0 Kelvin, les changements d’entropie pour les réactions concernant la formation de la matière seront nuls, bien que pratiquement toute matière manifeste une certaine quantité d’entropie, en raison de la présence de la plus infime quantité de chaleur. Le plus froid que nous ayons mesuré est de 3 K, dans les profondeurs lointaines de l’Univers, au-delà des étoiles et des galaxies.
En d’autres termes, profitez de l’été tant qu’il dure !
Qu’est-ce que la première loi de la thermodynamique ?
