Mark B. Abelson, MD, Aron Shapiro, et Ingrid Lapsa
North Andover, Mass.
La conjonctivite bactérienne est le fléau infectieux des garderies, des écoles et des communautés de vie institutionnalisées, redoutée pour ses symptômes inconfortables et sa capacité à se propager.
Pour prouver sa nature infectieuse, il suffit de se rappeler l’épidémie de l’hiver 2002 au Dartmouth College. Là, 13,8 % des étudiants du campus ont reçu un diagnostic de conjonctivite bactérienne, dont 22 % de la classe des étudiants de première année. Le taux d’attaque a suscité une telle inquiétude que le département de la santé de l’État a demandé l’aide des Centers for Disease Control and Prevention pour enquêter et gérer la crise. L’agent pathogène responsable a été identifié comme étant Streptococcus pneumoniae. Les facteurs associés à l’infection comprenaient un contact étroit avec un élève infecté, le port de lentilles de contact, l’appartenance à une équipe sportive et la participation à des fêtes.1
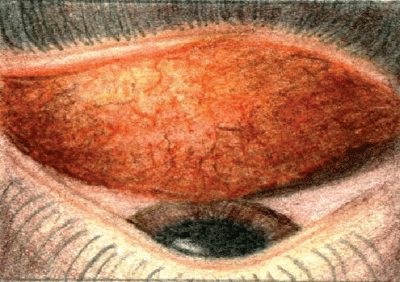
Les papilles seront présentes dans les yeux atteints de conjonctivite d’origine bactérienne.
Toutes les illustrations : Ingrid Lapsa
Une campagne encourageant le lavage des mains et le traitement précoce des symptômes – tout en mettant en garde contre le partage des verres à boire, des serviettes et des ustensiles – a été lancée. Entre une sensibilisation accrue, un traitement rapide et peut-être des départs en vacances de printemps, l’épidémie a été étouffée.
Les médecins de soins primaires voient des conjonctivites infectieuses plus que tout autre trouble oculaire, et l’incidence est la plus élevée chez les enfants. Traiter la conjonctivite bactérienne avec un agent offrant une couverture à large spectre et un début d’action rapide est la clé pour prévenir les séquelles possibles, notamment un ulcère cornéen résultant d’une rupture de la surface oculaire en présence de bactéries pathogènes. Un traitement rapide est impératif pour réduire les possibilités de propagation de l’infection.
L’infection
La conjonctivite fait référence à un certain nombre d’affections. Celles-ci peuvent être infectieuses ou non infectieuses, et aiguës, hyperaiguës ou chroniques. La rougeur oculaire est apparente dans presque tous les cas, bien que les autres aspects de la présentation varient. Il faut veiller à différencier les infections bactériennes des maladies virales et des affections allergiques.
Les trois agents pathogènes responsables les plus fréquents de la conjonctivite bactérienne aiguë sont Haemophilus influenzae, Streptococcus pneumoniae et Staphylococcus aureus. Les enfants sont le plus souvent touchés par S. pneumoniae et H. influenzae, ce dernier représentant la majorité des cas.2 Les infections à S. aureus sont plus fréquentes chez les adultes. Dans notre expérience des infections bactériennes aiguës, les climats chauds et humides, les conditions de vie surpeuplées et une mauvaise hygiène personnelle sont apparus comme des facteurs de risque supplémentaires.
Les symptômes sont similaires quel que soit l’agent pathogène. Le symptôme définitif est un écoulement mucopurulent abondant, de sorte que les paupières des patients sont souvent collées au réveil. L’injection de la conjonctive bulbaire et palpébrale est évidente, ce qui vaut à cette affection le nom familier d' »œil rose ». Il peut y avoir des papilles, un chémosis et un léger œdème des paupières, et les patients peuvent signaler une sensation de brûlure oculaire, une irritation et un larmoiement. Le plus souvent, les symptômes commencent dans un œil et s’étendent à l’autre. Un œdème des paupières important ou progressif peut annoncer une cellulite orbitaire.
La conjonctivite bactérienne aiguë est généralement autolimitée et ne présente généralement pas de menace sérieuse pour la vision. Les infections hyperaiguës sont beaucoup plus graves et menacent la vue. L’agent pathogène le plus souvent responsable est Neisseria gonorrhoeae, suivi de Neisseria meningitidis, beaucoup moins fréquent.
Les infections à N. gonorrhoeae apparaissent généralement chez les nouveau-nés et les jeunes adultes sexuellement actifs.3 Les nouveau-nés contractent la maladie en passant par un canal de naissance infecté. Les adultes introduisent le plus souvent l’organisme dans les tissus oculaires avec leurs mains, après avoir été en contact avec des organes génitaux infectés. Des symptômes rapidement progressifs se développent en quelques jours. Ils comprennent un écoulement purulent jaune-vert excessif, une injection et un chémosis conjonctival, un gonflement des paupières et une adénopathie préauriculaire sensible. Sans traitement, l’atteinte de la cornée est inévitable. Les infiltrations, les ulcérations et les perforations peuvent entraîner une perte permanente de la vision.
L’organisme Chlamydia trachomatis est responsable d’autres infections potentiellement dangereuses pour la vue. Il existe deux manifestations cliniques distinctes de C. trachomatis oculaire : le trachome et la conjonctivite à inclusion, plus bénigne.
Le trachome affecte principalement les sociétés rurales des pays en développement.4 Les conditions de vie insalubres et l’accès limité à l’eau potable sont également des facteurs de risque. C’est une maladie chronique, généralement contractée pour la première fois pendant l’enfance. Les réinfections répétées entraînent des cicatrices conjonctivales, une atteinte de la cornée et une éventuelle cécité.5 On pense que la transmission se fait par contact direct avec des mains ou des tissus qui ont été contaminés par des sécrétions oculaires ou nasales. Dans certaines régions, on pense également que les mouches oculaires propagent l’organisme.
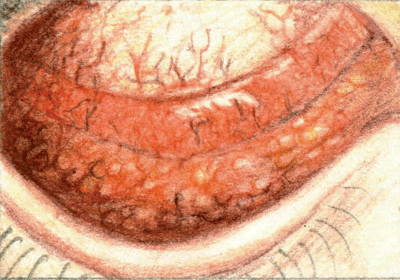
Les follicules sont le signe distinctif de la conjonctivite virale.
Si le trachome est rare aux États-Unis, les communautés marquées par la pauvreté, la promiscuité et/ou une mauvaise hygiène restent plus à risque. L’incidence peut également être plus élevée chez les immigrants provenant de régions où le trachome est répandu.
La transmission vénérienne est typique de la conjonctivite à inclusions. Les nourrissons et les adultes sexuellement actifs sont là encore les plus fréquemment touchés. Les nourrissons sont infectés à la naissance et commencent à présenter un écoulement mucopurulent bilatéral, un gonflement des paupières et un chémosis dans les cinq à 14 jours. Chez les adultes, l’infection est souvent subaiguë ou chronique et peut se limiter à un seul œil. Les symptômes sont les mêmes que chez les nourrissons, mais comprennent également l’émergence de follicules dans la conjonctive palpébrale et de papilles dans la conjonctive tardive. La sensation de corps étranger et les adénopathies préauriculaires sont fréquentes. Dans certains cas, des lésions cornéennes peuvent résulter de la cicatrisation et de la néovascularisation.
Diagnostic
Lorsqu’il s’agit de diagnostic, on ne saurait trop insister sur l’importance d’une anamnèse approfondie. En plus d’aider à l’identification d’un sous-type particulier de conjonctivite bactérienne, un compte rendu détaillé des antécédents du patient est important. Les profils symptomatiques des conjonctivites infectieuses et non infectieuses se chevauchent, notamment en ce qui concerne l’érythème. Les signes et symptômes caractéristiques diffèrent.
Une règle simple est que la conjonctivite bactérienne aiguë se présente sous forme de papilles, la conjonctivite virale sous forme folliculaire, et la conjonctivite à chlamydia sous forme des deux. La conjonctivite virale présente également un écoulement oculaire aqueux qui ne fait pas matcher les paupières, et un ganglion prétragonal ou préauriculaire palpable est généralement présent.
La kératite bactérienne sera généralement unilatérale, avec une rougeur sévère, une douleur vive, une photophobie et un œdème cornéen. Bien qu’un écoulement mucopurulent soit souvent présent, il sera épais et ronronnant plutôt que collant comme dans la conjonctivite.
Deux autres causes possibles de rougeur conjonctivale sont l’œil sec et la conjonctivite allergique. Comme pour la conjonctivite virale, l’écoulement purulent est absent dans l’œil sec. Les symptômes comprennent une sensation de brûlure oculaire, des picotements et de la fatigue. La rougeur peut apparaître comme une « bande » interpalpébrale plutôt que comme une distribution uniforme sur la surface de l’œil.
Dans la conjonctivite allergique, la rougeur apparaît souvent avec des veines prononcées. Le symptôme clé est la démangeaison. La description par le patient du moment où les symptômes apparaissent ou s’aggravent (par exemple, pendant une saison particulière) peut également impliquer une allergie.
Un examen à la lampe à fente peut révéler beaucoup de choses. Les cultures ne sont généralement pas justifiées en cas de conjonctivite bactérienne aiguë légère, mais les cas graves, récurrents ou résistants au traitement peuvent suggérer un problème plus grave. Si l’on soupçonne une infection gonococcique ou chlamydiale, une culture doit être réalisée pour exclure la maladie ou commencer un traitement. Les cultures doivent être réalisées à l’aide d’un écouvillon sec et synthétique, tel que le Dacron ou la rayonne, et il faut éviter les tiges en bois. Il faut s’efforcer de recueillir les cellules épithéliales de la conjonctive palpébrale et veiller à ne pas toucher les cils, les paupières ou tout écoulement muqueux. Une discussion des techniques de culture se trouve dans notre chronique de septembre 2002.
La gélose au sang et la gélose au chocolat doivent être utilisées comme milieux pendant l’incubation. Les chlamydia sont identifiées par inoculation et incubation dans une culture cellulaire.
Est-ce qu’AzaSite est la réponse aux problèmes d’observance ?
Les patients se lassent des dosages q2h ou q.i.d, et omettent souvent de prendre chaque dose de leur médicament comme indiqué, compromettant leur réponse future à l’antibiotique ainsi que leur rétablissement immédiat.
Traitement
Comme la conjonctivite bactérienne aiguë est généralement autolimitée, elle peut se résoudre sans traitement. Tenter le coup est cependant une mauvaise idée pour un certain nombre de raisons.
Pour commencer, la maladie est très contagieuse. Ne pas traiter un état infectieux augmente le risque d’exposition à d’autres personnes. De plus, les symptômes et les jours de travail perdus compromettent la qualité de vie du patient. De nombreuses écoles exigent que les enfants atteints de l’infection soient gardés à la maison jusqu’à ce qu’ils soient sous antibiotiques pendant au moins 24 heures.
En outre, il reste la possibilité que l’affection ne se résorbe pas sans intervention, auquel cas le patient risque des complications telles que des infiltrats cornéens et même une ulcération. Dans le pire des cas, la cicatrisation d’un ulcère cornéen, une endophtalmie, une perforation ou la perte d’un œil peuvent survenir en cas de rupture de la surface oculaire. Il existe également un risque de maladie extra-orbitaire : Les infections à H. influenzae de type B non traitées peuvent entraîner une maladie systémique.6
Lors du choix d’un antibiotique pour traiter une affection aiguë, les médicaments topiques à large spectre offrent de multiples avantages. Les cultures étant rarement effectuées dans les cas aigus, un agent à large couverture assure généralement une éradication microbienne rapide. Les pommades offrent l’avantage d’un contact prolongé avec la surface oculaire et d’un effet apaisant complémentaire. Les gouttes oculaires sont généralement mieux tolérées par les enfants et n’interfèrent pas avec la vision, cependant.
Les fluoroquinolones offrent une couverture à large spectre et se targuent d’une faible toxicité, d’un début d’action rapide et d’une meilleure pénétration oculaire que tout autre antibiotique topique.7 La résistance bactérienne a exigé à plusieurs reprises le développement de nouvelles formulations, chaque génération aspirant à déjouer les souches résistantes. S. aureus est particulièrement habile à développer une résistance.
Les fluoroquinolones de quatrième génération introduites en 2003 comprennent la gatifloxacine (Zymar, Allergan) et la moxifloxacine (Vigamox, Alcon), qui offrent toutes deux une activité accrue contre les organismes aérobies et anaérobies gram-positifs et gram-négatifs. Il est intéressant de noter que la moxifloxacine a montré une concentration conjonctivale sept fois supérieure à celle de la gatifloxacine 20 minutes après l’instillation.8
Bien que la moxifloxacine soit à une concentration légèrement plus élevée que la gatifloxacine, 0,5 % contre 0,3 %, respectivement, une étude sponsorisée par Alcon a trouvé que les concentrations tissulaires plus élevées peuvent être dues à la solubilité biphasique (à la fois lipidique et aqueuse) de la moxifloxacine. (Rusinko A, et al. IOVS 2004;45:ARVO E-Abstract 4907) De plus, la notice de la moxifloxacine recommande une posologie t.i.d. pendant sept jours, tandis que la notice de la gatifloxacine indique une posologie q2h pour les jours un et deux et q.i.d. pour les jours trois à sept. Un schéma posologique réduit peut entraîner une meilleure observance du patient. Une pénétration rapide et plus importante peut conduire à une destruction accélérée des bactéries.
Même si les fluoroquinolones restent la meilleure option, S. aureus et ses pairs n’ont montré aucun signe de céder pour de bon : Des études suggèrent que les mutations peuvent être spécifiquement influencées par le médicament particulier auquel elles sont exposées.9-11
Les mutations bactériennes ne sont pas le seul facteur contribuant à la résistance. Un mauvais diagnostic peut entraîner la surexposition d’un patient aux antibiotiques, par exemple lorsqu’un virus est traité avec un antibiotique. Une étude a révélé que si plus de 80 % des cas de conjonctivite sont traités par des antibiotiques, seuls 32 % des cas testés étaient en réalité d’origine bactérienne. Dans une étude plus récente que nous avons menée, des techniques de culture améliorées et une gestion contrôlée du site ont permis d’obtenir un taux de culture positive de 46 %.13
L’observance de la posologie est un autre facteur, et elle peut être difficile à atteindre, en particulier chez les patients pédiatriques. Les fluoroquinolones peuvent nécessiter jusqu’à huit doses par jour au début de la période de traitement, diminuant à q.i.d. pour le reste du traitement (voir encadré, p. 80). Il peut être plus facile d’obtenir un dosage consciencieux lorsque les symptômes sont au plus fort, mais lorsqu’ils commencent à s’atténuer, l’adhésion au traitement commence souvent à diminuer. Cela donne aux souches rustiques une fenêtre pour renouveler leur activité et développer des résistances. Il est impératif que les patients suivent l’intégralité du traitement.
Traiter une infection à Neisseria ou à Chlamydia peut présenter des défis plus immédiats. Le traitement approprié doit inclure un antibiotique systémique, un antibiotique topique et une irrigation saline régulière. Pour la conjonctivite à inclusions de l’adulte, l’azithromycine (Zithromax, Pfizer) est un favori. Elle est conditionnée en une seule dose de 1 ou 2 g, et les patients n’ont alors qu’à utiliser un seul schéma posologique et maintenir une irrigation saline.
La ceftriaxone est préférée pour les affections gonococciques, administrée en une seule injection de 125 mg. Les adultes et leurs partenaires sexuels doivent également subir d’autres tests de dépistage des maladies vénériennes, car l’atteinte oculaire est souvent secondaire à une infection génitale.
Les nourrissons doivent être hospitalisés pendant le traitement et faire l’objet d’une surveillance attentive pour détecter une infection disséminée. Pour éviter la propagation de la maladie à d’autres nourrissons, ils doivent être maintenus isolés du reste de la pouponnière. Comme pour les adultes, une dose unique intraveineuse ou intramusculaire (25-50 mg/kg pour les nourrissons, sans dépasser 125 mg) de ceftriaxone est recommandée contre les espèces de Neisseria. Contre les chlamydia, l’érythromycine par voie orale (12,5 mg/kg q.i.d. pendant 14 jours) est recommandée. Couplé à une antibiothérapie topique et à une irrigation saline régulière, le pronostic des patients est généralement très bon.
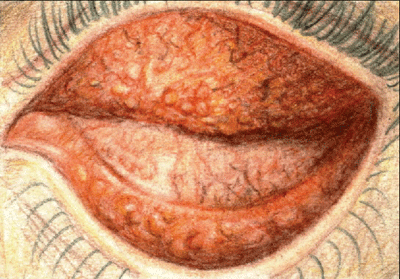
La conjonctivite à chlamydia présente à la fois des follicules et des papilles.
Autres considérations
La plupart des patients entrent dans le système de santé par le rayon de la pharmacie ou le médecin de famille. Beaucoup, notamment les patients pédiatriques, n’ont jamais mis les pieds dans le cabinet d’un ophtalmologiste. Lorsqu’une condition est considérée comme aiguë et non compliquée, une infirmière praticienne peut simplement appeler une ordonnance et le patient n’aura jamais de visite au cabinet. Cette stratégie ne présente aucun inconvénient tant que la prescription est adaptée à l’affection. Cependant, dans les cas plus critiques ou hyper-aigus, le retard du traitement systémique rend un mauvais service au patient.
Il est probable qu’un patient soit référé si les symptômes ne disparaissent pas comme prévu. Parfois, un détail non révélé dans les antécédents médicaux d’un patient est tout ce qui se trouve entre son état actuel et un retour à la santé. Les abus sexuels peuvent provoquer le rare cas pédiatrique de conjonctivite hyperaiguë. Aucun antibiotique ne soulagera la rougeur oculaire d’un patient allergique dont la maison est remplie de chats. Une mauvaise hygiène peut réintroduire quotidiennement des bactéries lorsqu’un enfant repose sa tête sur un oreiller contaminé.
Parler aux pédiatres et aux médecins traitants est un moyen efficace de minimiser les erreurs de diagnostic et les surprescriptions, et de faire en sorte que les références soient émises plus tôt que tard. Comme on l’a vu à Dartmouth, une prise en charge rapide couplée à un régime d’hygiène sain peut rendre à nouveau sûres même les fêtes de collège.
Le Dr Abelson, professeur clinique associé d’ophtalmologie à la Harvard Medical School et scientifique clinique principal au Schepens Eye Research Institute, est consultant en produits pharmaceutiques ophtalmiques. M. Shapiro est directeur des anti-infectieux et Mme Lapsa est associée de recherche clinique en allergologie chez ORA Clinical Research and Development à North Andover.
1. Gigliotti F, Williams WT, Hayden FG, et al. Etiologie de la conjonctivite aiguë chez les enfants. J Pediatr 1981;98:4:531-536.
2. Vichyarond P, Brown Q, Jackson D. Acute bacterial conjunctivitis. Clin Pediatr 1986;25:10:506-509.
3. Morrow GL, Abbot RL. Conjunctivitis. Am Fam Phys 1998;57:735-746.
4. Courtright P, West SK. Contribution de la biologie liée au sexe et des rôles de genre aux disparités avec le trachome. Emerg Infect Dis 2004;10:11:2012-6.
5. Johnson GJ. L’environnement et l’œil. Eye 2004;18:12:1235-50.
6. Limberg MB. Une revue de la kératite bactérienne et de la conjonctivite bactérienne. Am J Ophthalmol 1991:112:29(S).
7. Mah FS. Les fluoroquinolones de quatrième génération : nouveaux agents topiques dans la guerre contre les infections bactériennes oculaires. Curr Opin Ophthalmol 2004;15:316-320.
8 . Wagner RS, Abelson MB, Shapiro A, et al. Évaluation de la concentration de moxifloxacine, ciprofloxacine, gatifloxacine, ofloxacine et lévofloxacine dans le tissu conjonctif humain. Arch Ophthalmol 2005 Sep;123:9:1282-1283.
9. Griggs DJ, Marona H, Piddock JV. Sélection de Staphylococcus aureus résistant à la moxifloxacine par rapport à cinq autres fluoroquinolones. J Antimicrob Chemother 2003;51:1403-1407.
10. Pumbwe L, Randall LP, Woodward MJ, Piddock LJV. Preuve de la résistance multiple aux antibiotiques chez campylobacter jejuni non médiée par CmeB ou CmeF. Antimicrob Agents Chemother 2005;49:4:1289-1293.
11. Ricci V, Peterson ML, Rotschafer JC, et al. Role of topisomerase mutations and efflux in fluoroquinolone resistance of bacteroides fragilis clinical isolates and laboratory mutants. Antimicrob Agents Chemother 2004;48:4:13344-1346.
12. Rietveld RP. Prédire la cause bactérienne dans la conjonctivite infectieuse : Étude de cohorte sur l’informativité des combinaisons de signes et de symptômes. Brit Med J 2004;24;329:7459:206-210.
13. Données sur le fichier, Ophthalmic Research Associates.
