US Pharm. 2020;45(5)(Spécialité&Oncologie suppl):3-8.
ABSTRACT : Ces dernières années, plusieurs nouvelles options de thérapie ciblée ont été développées pour combattre la résistance à la thérapie endocrinienne traditionnelle pour le cancer du sein avancé. Trois inhibiteurs de la CDK4/6 (palbociclib, ribociclib et abemaciclib) ont été approuvés pour les patientes atteintes d’un cancer du sein avancé à récepteurs hormonaux positifs et à récepteurs 2 du facteur de croissance épidermique humain négatifs. Chaque agent a démontré son efficacité, mais des différences entre les trois médicaments existent, notamment dans leurs profils d’effets indésirables.
Le cancer du sein est le type de cancer le plus fréquent chez la femme, avec plus de 276 000 nouveaux cas estimés en 2020.1 Le cancer du sein à récepteurs hormonaux positifs (HR+), qui représente plus de 70 % de ces cas, a historiquement été traité par endocrinothérapie (ET), comme les inhibiteurs sélectifs des récepteurs d’œstrogènes et les inhibiteurs d’aromatase (IA). Bien que l’ET reste l’épine dorsale du traitement du cancer du sein HR+, une résistance se développe chez jusqu’à 50 % des patientes atteintes d’un cancer du sein avancé.2 Pour combattre la résistance, des thérapies ciblées ont été approuvées pour le cancer du sein HR+.3,4
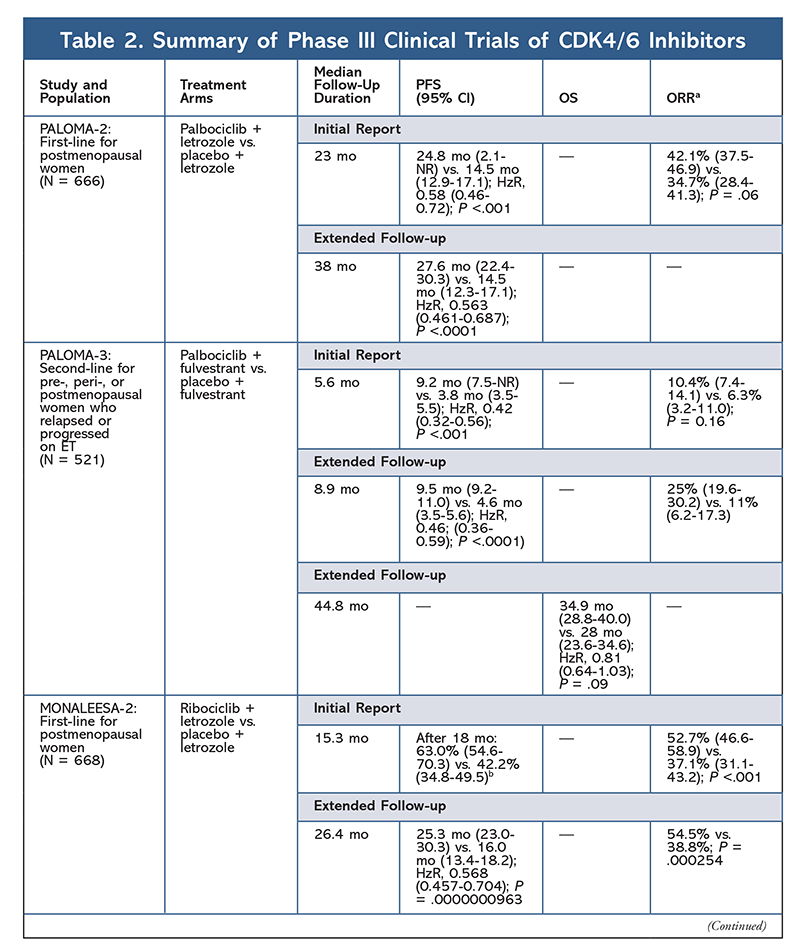
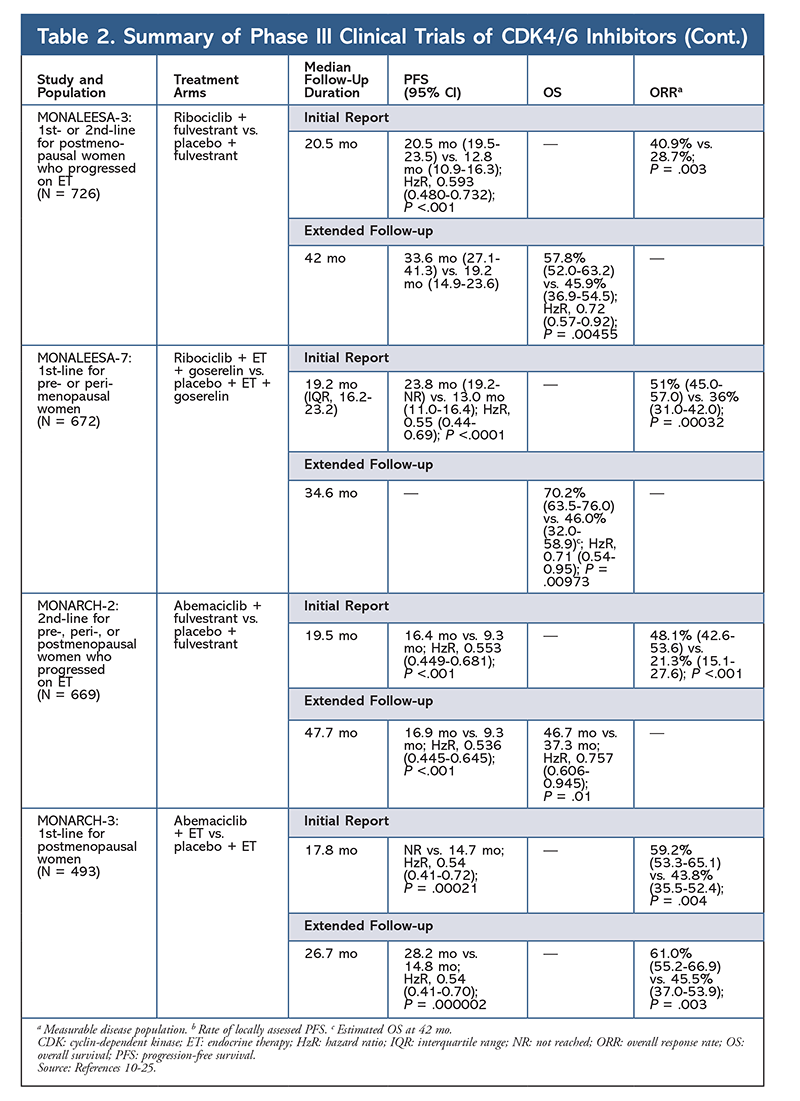
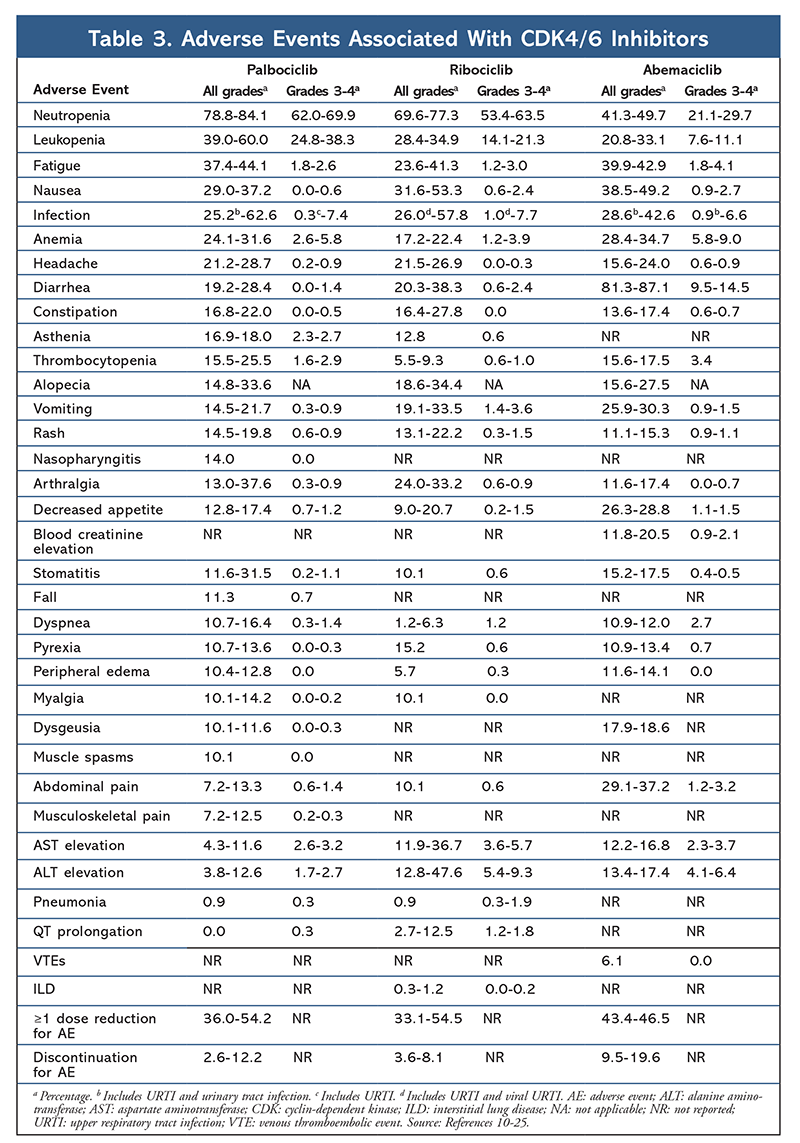
Les inhibiteurs de la kinase dépendante de la cycline (CDK), la plus récente classe d’intérêt pour le cancer du sein avancé, agissent en inhibant spécifiquement les protéines CDK4/6 et en bloquant la transition de la phase G1 à la phase S du cycle cellulaire. Cette classe de médicaments inhibe l’activité de la kinase, qui phosphoryle la voie protéique du rétinoblastome. En bloquant cette voie, les inhibiteurs de CDK4/6 sont capables de bloquer la progression du cycle cellulaire au milieu de la phase G1 et d’empêcher la progression des cellules cancéreuses. Ces dernières années, trois inhibiteurs de la CDK4/6 (palbociclib, ribociclib et abemaciclib) ont été approuvés en tant que traitements d’association pour les cancers du sein HR+, HER2- (human epidermal growth factor receptor 2-negative), avancés ou métastatiques5-8. Cet article passe en revue les différences de ces agents (TABLEAU 1), les essais cliniques de phase III (TABLEAU 2) et les profils d’effets indésirables (EI) (TABLEAU 3).
Palbociclib
En 2015, le palbociclib est devenu le premier inhibiteur de la CDK4/6 à recevoir l’approbation de la FDA pour le traitement du cancer du sein HR+, HER2- (en association avec un IA comme ET initial chez les femmes ménopausées ou chez les hommes, ou en association avec le fulvestrant chez les patientes présentant une progression de la maladie après ET).6,9-14 Le palbociclib a initialement reçu l’approbation après les résultats positifs de l’étude de phase II PALOMA-1, qui a comparé le palbociclib plus le létrozole avec le létrozole seul comme traitement initial pour les patientes atteintes d’un cancer du sein avancé n’ayant jamais reçu d’ET.9
Ces résultats ont conduit à deux essais de phase III évaluant davantage l’effet du palbociclib dans cette population de patients. Les résultats initiaux de PALOMA-2 ont confirmé les effets du palbociclib plus le létrozole, démontrant une amélioration de la survie sans progression (SSP) par rapport au létrozole seul (24,8 mo contre 14,5 mo, respectivement ; rapport de risque pour la progression de la maladie ou le décès, 0,58 ; IC 95 %, 0,46-0,72 ; P <.001). Une étude de suivi à long terme à 38 mois a confirmé l’effet du palbociclib sur la SSP, avec une augmentation à 27,6 mois contre 14,5 mois pour le létrozole seul (HzR, 0,563 ; IC à 95%, 0,461-0,687 ; P <.0001). L’étude de suivi a également rapporté une amélioration constante de la SSP avec le palbociclib plus le létrozole dans tous les sous-groupes étudiés, ainsi qu’un délai médian plus long avant l’instauration d’un traitement ultérieur. Cependant, les données sur la survie globale (SG) pour les rapports initial et de suivi étaient immatures, et les patientes inscrites font l’objet d’un suivi de survie.10,11
Peu après le début de PALOMA-2, un autre essai de phase III, PALOMA-3, a été entamé pour évaluer l’innocuité et l’efficacité du palbociclib plus fulvestrant chez les femmes préménopausées ou postménopausées atteintes d’un cancer du sein avancé HR+ qui a progressé lors d’un ET antérieur. Le rapport initial après 5,6 mois de suivi a montré une amélioration de la SSP médiane (9,2 mois contre 3,8 mois), avec une réduction de 58 % de la progression (HzR, 0,42 ; IC à 95 %, 0,32-0,56 ; P <.001).12 Une analyse préspécifiée de la SG dans l’essai PALOMA-3, utilisant un suivi médian de 44.8 mois, a révélé que les différences de SG pour l’ensemble du groupe en intention de traiter n’atteignaient pas la signification statistique, mais que l’association prolongeait la SG de 10 mois chez les patients qui étaient sensibles à l’ET précédente14.
Le profil des EI est demeuré constant dans tous les rapports d’essais (TABLEAU 3), la neutropénie de tous grades (78,8 %-84,1 %), la leucopénie (39 %-60 %) et la fatigue (37,4 %-44,1 %) étant les EI les plus fréquemment signalés. Les taux de neutropénie étaient élevés ; toutefois, la neutropénie fébrile était rare (jusqu’à 2 %). La tolérabilité globale du palbociclib a été considérée comme gérable, et l’agent a donné lieu à des données positives sur la qualité de vie lorsqu’il était utilisé en association par rapport à une monothérapie endocrinienne.9,14
Ribociclib
Un deuxième inhibiteur de la CDK4/6, le ribociclib, a été approuvé par la FDA en 2017 avec une population de patients indiquée plus large. Le ribociclib est approuvé pour les femmes ménopausées et pré ou périménopausées atteintes d’un cancer du sein HR+, HER2- avancé ou métastatique (en tant que traitement d’association avec un IA en tant qu’ET initial ou, chez les femmes ménopausées, associé au fulvestrant en tant qu’ET initial ou après progression de la maladie sous ET).7
Le ribociclib a d’abord reçu l’approbation de la FDA après que l’essai MONALEESA-2 a révélé que la SSP était améliorée lorsque le médicament était administré en association avec le létrozole par rapport au létrozole seul. Les taux de SSP évalués localement par rapport au létrozole seul après 18 mois étaient respectivement de 63,0 % (IC 95 %, 54,6-70,3) et 42,2 % (IC 95 %, 34,8-49,5).15 Un rapport de suivi prolongé à 26,4 mois a encore démontré l’efficacité et la tolérabilité de l’association.16 Malgré l’amélioration de la PFS, les données sur la SG pour MONALEESA-2 restent immatures.
Le ribociclib est également étudié (dans MONALEESA-3) en association avec le fulvestrant chez les patientes n’ayant jamais reçu de traitement et celles qui ont rechuté après un ET. Le rapport initial a révélé une amélioration de la SSP pour l’association par rapport au fulvestrant seul (20,5 mois contre 12,8 mois, respectivement ; HzR, 0,593 ; IC à 95%, 0,480-0,732 ; P <.001), ce qui a entraîné l’approbation de cette association par la FDA.17 Un deuxième rapport, le plus récent, sur l’inhibiteur CDK4/6, qui comportait 21,6 mois de suivi supplémentaires, a également démontré l’amélioration constante de la SSP. Ce rapport a également prouvé l’avantage OS du ribociclib plus fulvestrant par rapport au fulvestrant seul, avec une OS estimée à 42 mois de 57,8% contre 45,9%, respectivement, et une réduction de 28% du risque relatif de décès (HzR, 0,72 ; 95% CI, 0,57-0.92 ; P = 0,00455).18
Un troisième essai clinique, MONALEESA-7, est actuellement le seul essai de phase III à évaluer l’efficacité et l’innocuité d’un inhibiteur de la CDK4/6 comme traitement de première ligne chez les femmes pré ou périménopausées atteintes d’un cancer du sein métastatique. Dans cet essai, l’association du ribociclib et du tamoxifène ou d’un AINS – comme le létrozole ou l’anastrozole – et de la goséréline a permis d’améliorer significativement la SSP de 23,8 mois par rapport à 13 mois dans le groupe placebo (HzR, 0,55 ; IC à 95 %, 0,44-0,69 ; P <.0001), et cette association a conduit à l’élargissement de l’indication aux femmes pré et périménopausées19. Un rapport de suivi prolongé a démontré l’avantage OS de l’association ribociclib plus tamoxifène ou un AINS plus goséréline par rapport au placebo, avec une OS estimée à 42 mois de 70,2 % contre 46,0 %.20
Le profil de toxicité du ribociclib est très similaire à celui du palbociclib, la neutropénie et la leucopénie étant les EI de tous grades et les plus sévères (grades 3/4) rapportés, bien qu’à des taux plus faibles que pour le palbociclib (TABLEAU 3).15-20 La neutropénie fébrile était rare, et aucun nouveau problème d’innocuité n’est apparu avec une exposition plus longue au ribociclib dans aucun des rapports de suivi prolongé.
Abemaciclib
Le troisième inhibiteur de la CDK4/6 à être approuvé par la FDA est l’abemaciclib. Cet agent est indiqué en association avec un IA comme ET initial chez les femmes ménopausées atteintes d’un cancer du sein avancé, ou en association avec le fulvestrant chez les femmes pré, péri ou post-ménopausées dont la maladie a progressé après l’ET. L’abemaciclib est également approuvé en monothérapie chez les hommes et les femmes dont la maladie a progressé à la suite d’une TE et d’une chimiothérapie antérieure dans un contexte métastatique.6 L’agent a initialement été approuvé sur la base des résultats de l’étude MONARCH-1, qui a démontré une activité clinique prometteuse après 12 mois, avec un taux de réponse global (TRG) de 19,7 % (IC à 95 %, 13,3-27,5) et une SSP médiane de 6 mois.5,21 Pendant ce temps, l’abemaciclib était également étudié dans l’étude MONARCH-2 chez les femmes préménopausées, périménopausées et postménopausées dont la maladie avait progressé à la suite d’une TE. Cette étude a démontré un avantage statistiquement significatif en termes de SSP avec une association d’abemaciclib et de fulvestrant par rapport au fulvestrant seul (16,4 mois contre 9,3 mois ; HzR, 0,553 ; IC à 95%, 0,449-0,681 ; P <.001).22 Une étude de suivi prolongé avec une durée médiane de 47.Une étude de suivi prolongé d’une durée médiane de 47,7 mois a rapporté une légère amélioration des résultats de la SSP et de la SG avec l’association abemaciclib par rapport au placebo et au fulvestrant (46,7 mois contre 37,3 mois ; IC à 95 %, 0,606-0,945 ; P = 0,01).23
Peu après le début des deux essais sur l’abemaciclib, MONARCH-3 a été lancé. Cet essai a révélé une amélioration statistiquement significative de la SSP et du TRO avec l’abemaciclib plus un AINS par rapport au groupe placebo plus AINS en traitement de première intention chez les femmes ménopausées. Un rapport actualisé avec 8,9 mois de suivi supplémentaire a confirmé les résultats de la PFS et de l’ORR de l’analyse initiale ; cependant, les données OS restent immatures, et l’analyse OS finale sera effectuée après 315 événements.24,25
Dans l’ensemble, l’abemaciclib a été noté comme étant l’inhibiteur CDK4/6 le plus puissant, avec une excellente activité sur le système nerveux central en raison de sa structure, lui permettant de traverser la barrière hémato-encéphalique et de rester sur la cible plus longtemps.5 Cela peut être bénéfique pour les patients atteints de métastases cérébrales. Bien que l’abemaciclib présente également des pourcentages élevés d’EI hématologiques, ces taux sont beaucoup plus faibles que ceux des autres inhibiteurs de la CDK4/6. L’abemaciclib est associé à davantage de toxicités gastro-intestinales, telles que la diarrhée, que les autres inhibiteurs de la CDK4/6 (tous grades confondus : 81,3 %-87,1 % ; grades 3-4 : 9,5 %-14,5 %).22-25
Le rôle du pharmacien
Dans l’ensemble, les profils d’EI des différents inhibiteurs de la CDK 4/6 sont similaires, mais chaque médicament présente des EI uniques. Les EI les plus fréquemment rapportés avec les inhibiteurs de la CDK4/6 sont la neutropénie, la leucopénie, la fatigue, les nausées, les infections, l’arthralgie, l’anémie, les céphalées et la diarrhée (TABLEAU 3). Hormis la neutropénie et la leucopénie, la majorité des patients ont signalé des EI de grade 1 ou 2. La neutropénie et la leucopénie de grade 3 ou 4, qui étaient très fréquentes avec tous les inhibiteurs de la CDK, en particulier le palbociclib et le ribociclib, ont été gérées principalement par une interruption et/ou une réduction de la dose. La NFS du patient doit être contrôlée au début du traitement, toutes les deux semaines pendant les deux premiers cycles, au début de chacun des quatre cycles suivants et selon les besoins cliniques pour la suppression de la moelle osseuse.6-8 Des chutes, des spasmes musculaires et des rhinopharyngites sont associés au palbociclib, mais sont légers dans la plupart des cas.10,11,14 Une faible incidence d’allongement de l’intervalle QT a été signalée avec le ribociclib.15-20 L’abemaciclib a été associé à une incidence significativement plus élevée de diarrhée par rapport au palbociclib et au ribociclib ; les cas sont survenus principalement au cours du premier cycle et ont pu être pris en charge par un traitement antidiarrhéique.22-25 L’abemaciclib a été associé à une élévation de la créatinine sérique et à des événements thromboemboliques veineux (pour la plupart légers), qui n’ont pas été signalés pour le palbociclib et le ribociclib, ainsi qu’à une incidence plus élevée de douleurs abdominales.22-25 Notamment, en septembre 2019, la FDA a averti que des pneumopathies interstitielles (PI) et des pneumonites rares mais graves, potentiellement mortelles, peuvent survenir chez les patients traités par des inhibiteurs de la CDK4/626. Par conséquent, les patients doivent être surveillés régulièrement à la recherche de symptômes pulmonaires indiquant une ILD et/ou une pneumonite.
Conclusion
Les approbations du palbociclib, du ribociclib et de l’abemaciclib au cours des dernières années ont élargi les options de traitement pour les patientes atteintes d’un cancer du sein avancé. Bien qu’ils possèdent tous le même mécanisme d’action, ces médicaments présentent de légères différences en termes d’efficacité et de sécurité. Un certain nombre d’études en cours, au-delà de celles mentionnées dans cette revue, continuent d’explorer ces inhibiteurs dans différentes populations de patients et avec différentes combinaisons de traitement. Le potentiel de ces agents pour étendre l’utilisation des inhibiteurs de CDK4/6 à d’autres contextes que le cancer du sein avancé HR+, HER2- semble prometteur.27
1. Siegel RL, Miller KD, Jemal A. Statistiques sur le cancer, 2020. CA Cancer J Clin. 2020;70(1):7-30.
2. Preusser M, De Mattos-Arruda L, Thill M, et al. Les inhibiteurs de CDK4/6 dans le traitement des patientes atteintes d’un cancer du sein : résumé d’une table ronde multidisciplinaire. ESMO Open. 2018;3(5):e000368.
3. Tripathy D, Bardia A, Sellers WR. Ribociclib (LEE011) : mécanisme d’action et impact clinique de cet inhibiteur sélectif de la kinase cycline-dépendante 4/6 dans diverses tumeurs solides. Clin Cancer Res. 2017;23(13):3251-3262.
4. Portman N, Alexandrou S, Carson E, et al. Surmonter la résistance aux inhibiteurs CDK4/6 dans le cancer du sein ER-positif. Endocr Relat Cancer. 2019;26(1):R15-R30.
5. Sobhani N, D’Angelo A, Pittacolo M, et al. Mises à jour de la stratégie et des combinaisons d’inhibiteurs de CDK4/6 dans le cancer du sein. Cells. 2019;8(4):E321.
6. notice d’Ibrance (palbociclib). New York, NY : Pfizer Inc ; septembre 2019.
7. Kisqali (ribociclib) notice d’emballage. East Hanover, NJ : Novartis Pharmaceuticals Corp ; septembre 2019.
8. Verzenio (abemaciclib) notice d’emballage. Indianapolis, IN : Eli Lilly and Co ; septembre 2019.
9. Finn RS, Crown JP, Lang I, et al. L’inhibiteur de la kinase 4/6 dépendant de la cycline palbociclib en association avec le létrozole par rapport au létrozole seul en tant que traitement de première ligne du cancer du sein avancé à récepteurs d’œstrogènes positifs, HER2 négatifs (PALOMA-1/TRIO-18) : une étude de phase 2 randomisée. Lancet Oncol. 2015;16(1):25-35.
10. Finn RS, Martin M, Rugo HS, et al. Palbociclib et letrozole dans le cancer du sein avancé. N Engl J Med. 2016;375(20):1925-1936.
11. Rugo HS, Finn RS, Diéras V, et al. Palbociclib plus letrozole en tant que traitement de première ligne dans le cancer du sein avancé à récepteur d’œstrogène positif/récepteur 2 du facteur de croissance épidermique humain négatif avec un suivi prolongé. Breast Cancer Res Treat. 2019;174(3):719-729.
12. Turner NC, Ro J, André F, et al. Palbociclib dans le cancer du sein avancé à récepteurs hormonaux positifs. N Engl J Med. 2015;373(3):209-219.
13. Cristofanilli M, Turner NC, Bondarenko I, et al. Fulvestrant plus palbociclib versus fulvestrant plus placebo pour le traitement du cancer du sein métastatique hormono-récepteur-positif, HER2-négatif qui a progressé lors d’un traitement endocrinien précédent (PALOMA-3) : analyse finale de l’essai contrôlé randomisé multicentrique, en double aveugle, de phase 3. Lancet Oncol. 2016;17(4):425-439.
14. Turner NC, Slamon DJ, Ro J, et al. Survie globale avec palbociclib et fulvestrant dans le cancer du sein avancé. N Engl J Med. 2018;379(20):1926-1936.
15. Hortobagyi GN, Stemmer SM, Burris HA, et al. Ribociclib comme traitement de première ligne pour le cancer du sein avancé HR-positif. N Engl J Med. 2016;375(18):1738-1748.
16. Hortobagyi GN, Stemmer SM, Burris HA, et al. Résultats actualisés de MONALEESA-2, un essai de phase III du ribociclib plus létrozole en première ligne par rapport au placebo plus létrozole dans le cancer du sein avancé à récepteurs hormonaux positifs et HER2 négatifs. Ann Oncol. 2018;29(7):1541-1547.
17. Slamon DJ, Neven P, Chia S, et al. Étude randomisée de phase III du ribociclib et du fulvestrant dans le cancer du sein avancé à récepteurs hormonaux positifs et à récepteurs 2 du facteur de croissance épidermique humain négatifs : MONALEESA-3. J Clin Oncol. 2018;36(24):2465-2472.
18. Slamon DJ, Neven P, Chia S, et al. Survie globale avec ribociclib plus fulvestrant dans le cancer du sein avancé. N Engl J Med. 2020;382(6):514-524.
19. Tripathy D, Im SA, Colleoni M, et al. Ribociclib plus thérapie endocrinienne pour les femmes préménopausées atteintes d’un cancer du sein avancé à récepteurs hormonaux positifs (MONALEESA-7) : un essai randomisé de phase 3. Lancet Oncol. 2018;19(7):904-915.
20. Im SA, Lu YS, Bardia A, et al. Survie globale avec ribociclib plus endocrinothérapie dans le cancer du sein. N Engl J Med. 2019;381(4):307-316.
21. Dickler MN, Tolaney SM, Rugo HS, et al. MONARCH 1, une étude de phase II de l’abemaciclib, un inhibiteur de CDK4 et CDK6, en monothérapie, chez les patientes atteintes d’un cancer du sein métastatique réfractaire HR+/HER2-. Clin Cancer Res. 2017;23(17):5218-5224.
22. Sledge GW Jr, Toi M, Neven P, et al. MONARCH 2 : abemaciclib en association avec fulvestrant chez les femmes atteintes d’un cancer du sein avancé HR+/HER2- qui avait progressé alors qu’elles recevaient un traitement endocrinien. J Clin Oncol. 2017;35(25):2875-2884.
23. Sledge GW Jr, Toi M, Neven P, et al. L’effet de l’abemaciclib plus fulvestrant sur la survie globale dans le cancer du sein à récepteurs hormonaux positifs, ERBB2-négatifs qui a progressé sous endocrinothérapie-MONARCH 2 : un essai clinique randomisé. JAMA Oncol. 2020;6(1):116-124.
24. Goetz MP, Toi M, Campone M, et al. MONARCH 3 : abemaciclib comme traitement initial du cancer du sein avancé. J Clin Oncol. 2017;35(32):3638-3646.
25. Johnston S, Martin M, Di Leo A, et al. MONARCH 3 final PFS : une étude randomisée de l’abemaciclib comme traitement initial du cancer du sein avancé. NPJ Breast Cancer. 2019;17(5):5.
26. FDA. La FDA met en garde contre une inflammation pulmonaire rare mais grave avec Ibrance, Kisqali et Verzenio pour le cancer du sein. www.fda.gov/drugs/drug-safety-and-availability/fda-warns-about-rare-severe-lung-inflammation-ibrance-kisqali-and-verzenio-breast-cancer. Consulté le 15 janvier 2020.
27. Shah M, Nunes MR, Stearns V. Inhibiteurs de CDK4/6 : game changers in the management of hormone receptor-positive advanced breast cancer ? Oncologie (Williston Park). 2018;32(5):216-222.
Le contenu de cet article est uniquement à titre informatif. Le contenu n’est pas destiné à remplacer les conseils d’un professionnel. La confiance accordée à toute information fournie dans cet article est uniquement à vos propres risques.
