Dipole Moments
HClなどの極性物質では非対称な電荷分布により、メートル(m)単位のdipole moment()、ギリシャ文字でμと略記される다이즈()が生じる。 双極子モーメントは、結合した原子の部分電荷Qと部分電荷間の距離rの積として定義される。
双極子モーメントを持つ分子を電場に置くと、電荷分布が非対称になるため、電場と同じ方向に向く傾向がある(図( \PageIndex{4}) )
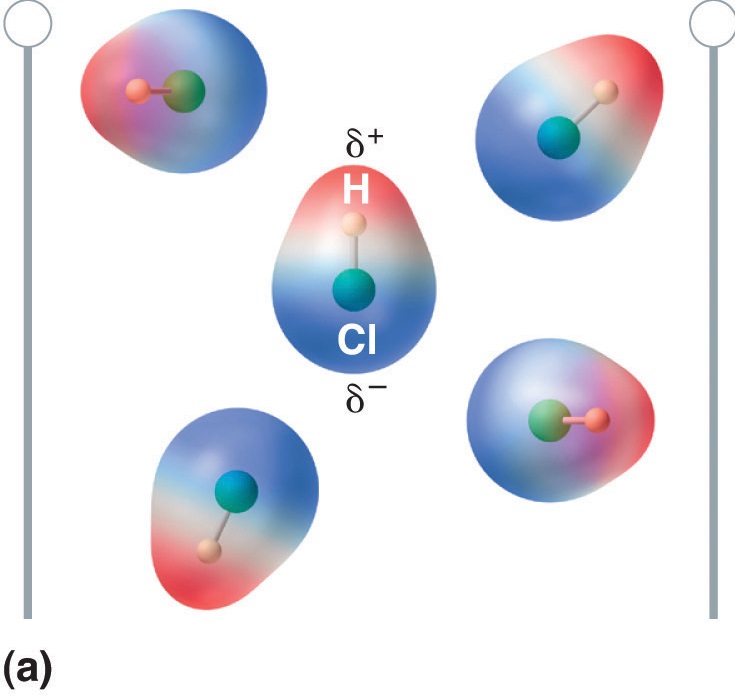
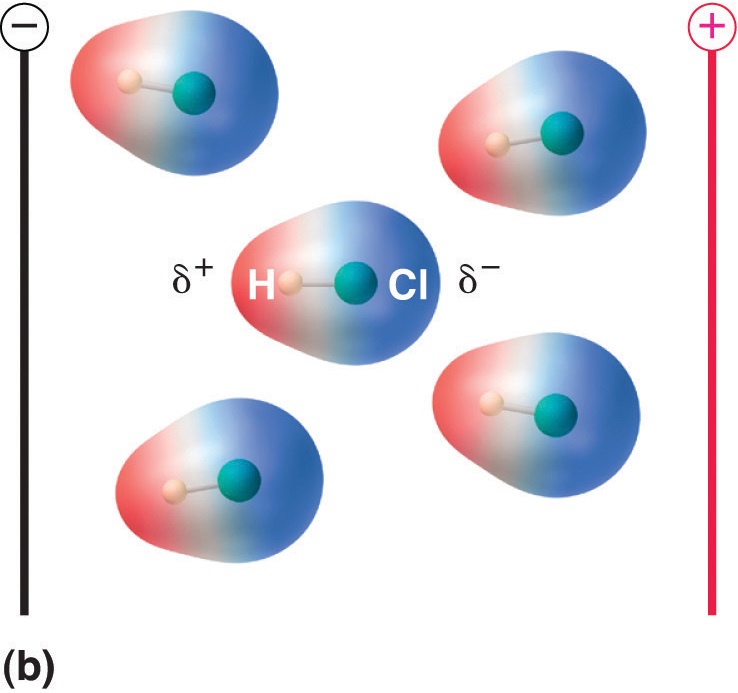
Figure (\PageIndex{5}): ダイポールモーメントを持つ分子は、電界をかけると部分的に整列する。 電場がない場合(a)、HCl分子はランダムに配向している。 電場をかけると(b)、分子は電場に対して整列し、分子双極子の正の端が負の端の方を向き、逆もまた真なりとなる。
HClの双極子モーメントの測定結果は、H-Cl結合が約18%のイオン性(0.1811×100)と、82%の共有性であることを示す。 HClを
と書く代わりに、
と定量的に表すことができる。計算結果は、水素と塩素の電気陰性度の差χH = 2.20; χCl = 3.16, χCl -χH = 0.96) と一致し、極性共有結合の範囲に入る値であることが確認できた。 分子の上に矢印を書くことで、双極子モーメントを示す。 数学的には、双極子モーメントはベクトルであり、大きさと方向の両方を持つ。 分子の双極子モーメントは、個々の結合の双極子のベクトル和である。 例えばHClでは、双極子モーメントは次のように示される。
![]()
矢印は、より電気陰性の原子を指して電子の流れの方向を示している。
気相中の多くの物質の原子上の電荷は、測定された双極子モーメントと結合距離を使って計算することが可能である。 図に、いくつかの物質について、結合原子の電気陰性度の差に対するイオン性パーセントのプロットを示します。 このグラフから、NaCl(g)やCsF(g)などの物質の結合は100%イオン性でないことがわかる。 しかし、気体が凝縮して固体になると、分極した種間の双極子-双極子相互作用により、電荷分離が大きくなる。 そのため、結晶中では金属から非金属に電子が移動し、古典的なイオン化合物のような振る舞いをする。 図中のデータは、電気陰性度の差が1.5以下の2原子種は50%以下のイオン性であることを示しており、極性共有結合を含むという先ほどの説明と一致している。 極性結合のイオン性を決定するための双極子モーメントの使用は、例題( \PageIndex{2}).
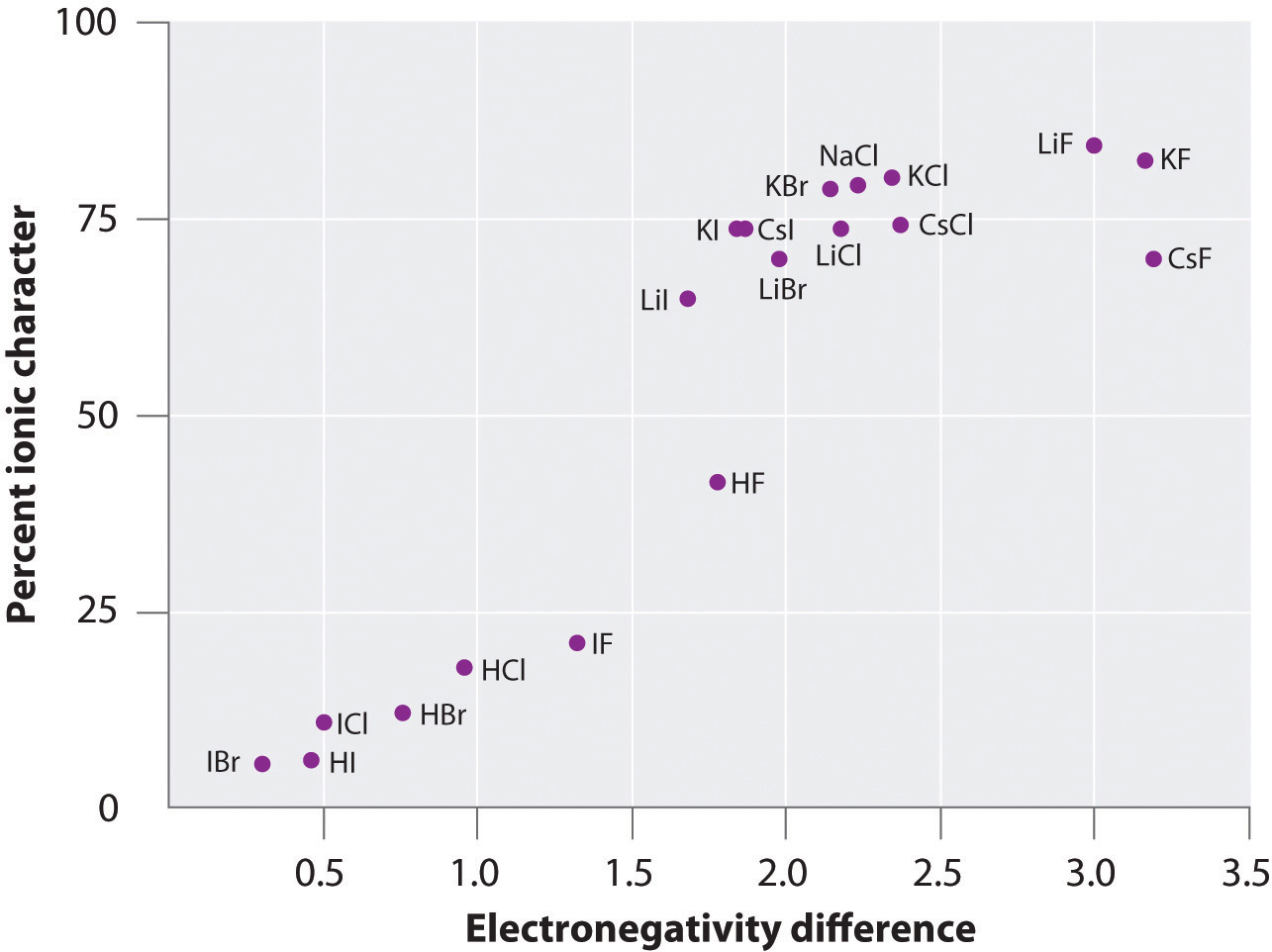
Figure \(\PageIndex{6}). Fig: 気相では、原子間の電気陰性度の差が最も大きいCsFでさえ100%イオン性ではない。 しかし、固体のCsFは、格子の静電相互作用が加わるため、100%イオン性であると見なすのが最も良い。
