エンタルピー
熱力学は、熱(またはエネルギー)と仕事の関係を研究する学問です。 エンタルピーは熱力学の中心的な要素である。 これは系の熱量である。 反応中に系に出入りする熱量がエンタルピー変化である。 系のエンタルピーが増加する(すなわちエネルギーが加えられたとき)か減少する(エネルギーが放出されるため)かは、反応が起こるかどうかを決定する重要な要因である
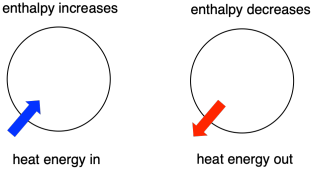
変化を受ける分子のエネルギーを「内部エンタルピー」と呼ぶことがある。 また、”系のエンタルピー “と呼ぶこともある。 この2つのフレーズは同じものを指している。 同様に、反応に関与しない分子のエネルギーを「外部エンタルピー」または「周囲のエンタルピー」と呼ぶ。
熱力学入門で見てきたエネルギー変化は、大雑把に言えばエンタルピーの変化でした。 次節では、反応にはもう一つのエネルギー的な要素であるエントロピーも考慮する必要があることを見ていきます。
- エンタルピーは系の熱量です。
- 反応のエンタルピー変化は、反応中に失われたり得られたりしたエネルギー量とほぼ等しいです。
- 反応に伴って系のエンタルピーが減少する場合、反応は有利になる
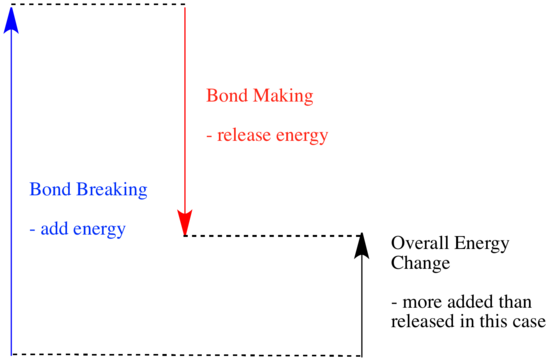
最後の文は前ページのエネルギー学の記述とよく似ている。 ある系が反応を受けてエネルギーを放出すると、それ自身のエネルギー量が減少する。 エネルギーを放出すれば、残ったエネルギーは少なくなります。 反応が起こると、なぜ分子の集合のエネルギーが変化するのでしょうか? それに答えるには、化学反応で何が起こるかを考える必要があります。
反応では、化学結合に変化が生じます。 反応物の結合の一部が壊れ、新しい結合が作られて生成物ができる。 結合を切るにはエネルギーが必要だが、新しい結合が作られるときにエネルギーが放出される。
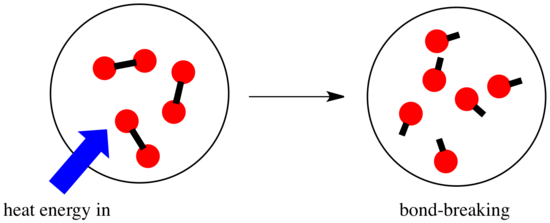
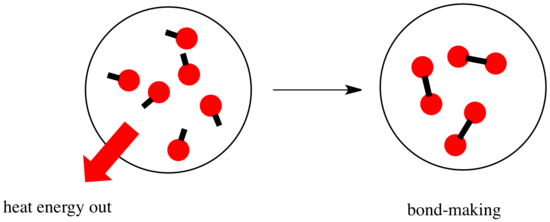
反応が進むかどうかは、この結合を作るステップと結合を壊すステップのバランスに依存するかもしれません。
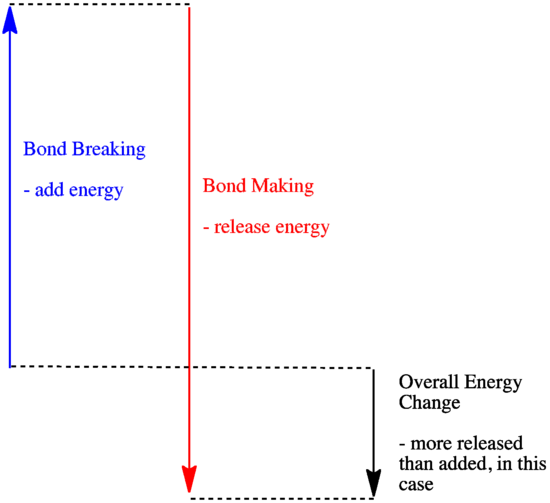
- 新しい結合ができるときに、古い結合が壊れて消費したよりも、多くのエネルギーが放出されていれば発熱反応となります。
- 弱い結合が強い結合と交換される場合、反応は発熱する。
- 結合を作るときに提供されるエネルギーよりも、結合を壊すときに多くのエネルギーがかかる場合、反応は吸熱する。
結合エネルギー(結合を壊すために追加しなければならないエネルギー量)は反応が起こるかどうかを決める重要な要因である。 結合の強さは多くの要因に依存するので、結合の強さを予測するのは必ずしも容易ではありません。 しかし、多くの人が結合の強さを測定し、その情報を表にして集めているので、結合の強さを知りたいときは、必要な情報を調べればよいのです。
| Bond | Bond Energy (kcal/mol) | ||
| H- | Bound | Bond (kcal/mol) | |
| Bond (kcal/mol)H | 104 | -O-H | 111 |
| C-…c | 83 | c-h | 99 |
| o=o | 119 | n-…H | 93 |
| N=N | 226 | C=O | 180 |
例えば、次のような場合です。 メタンの燃焼が発熱反応か吸熱反応か知りたかったとします。 この反応は、天然ガスを炉で燃やして多くの家庭に熱を供給するために使われているので、発熱反応であると推測します。
メタンの「燃焼」とは、空気中で酸素と反応するように燃焼させることです。 炭化水素を燃やしたときの生成物は、ほとんどが二酸化炭素と水です。 メタン(CH4)の炭素原子は二酸化炭素の分子に取り込まれます。 水素原子は水の分子に取り込まれる。
- メタンの燃焼では、4つのC-H結合が切断されなければなりません。
- メタンからの水素が新しい水分子に加えられるとき、4つの新しいO-H結合が作られます。
- メタンからの炭素がCO2分子に加えられるとき、2つの新しいC=O結合が作られます。
パズルのもう一つのピースは、反応のための酸素源です。 酸素は大気中に主にO2として存在する。 CO2分子に2個の酸素原子が必要で、さらに2個の水分子に2個の酸素原子が必要なので、反応には合計4個の酸素原子が必要で、これは2個のO2分子で賄えます。
-
生成物に酸素原子を供給するには2個のO=O結合が壊されなければなりません。 C-H結合が4×99kcal/mol、O=O結合が2×119kcal/molで、合計634kJ/molが加わったことになる。 この反応により、C=O結合が2 x 180 kcal/mol、OH結合が4 x 111 kcla/mol、合計で804 kcal/molが放出される。 3510>
つまり、この反応は発熱反応であり、熱を発生させます。 家の暖房にはいいかもしれませんね。
