US Pharm. 2020;45(5)(Specialty&Oncology suppl):3-8.
ABSTRACT:近年、進行乳癌に対する従来の内分泌療法に対する抵抗性に対抗するために、いくつかの新しい標的療法の選択肢が開発されている。 CDK4/6阻害剤3剤(パルボシクリブ、リボシクリブ、アベマシクリブ)は、ホルモン受容体陽性、ヒト上皮成長因子受容体2陰性の進行乳がん患者に対して承認されている。 その70%以上を占めるホルモン受容体陽性(HR+)乳がんは、これまで選択的エストロゲン受容体阻害薬やアロマターゼ阻害薬(AI)などの内分泌療法(ET)で治療されてきました。 2 耐性に対抗するため、標的治療薬がHR+乳がんに対して承認されています3,4
進行乳がんに対する新しい治療薬として注目されているサイクリン依存性キナーゼ(CDK)阻害薬は、CDK4/6タンパク質を特異的に阻害し、細胞周期のG1からS期への移行を阻害することによって作用します。 この薬剤クラスは、レチノブラストーマタンパク質経路をリン酸化するキナーゼ活性を阻害する。 この経路を阻害することにより、CDK4/6阻害剤はG1期の途中から細胞周期の進行を阻害し、がん細胞の進行を防ぐことができるのです。 近年、3種類のCDK4/6阻害剤(パルボシクリブ、リボシクリブ、アベマシクリブ)が、HR+、ヒト上皮成長因子受容体2陰性(HER2-)、進行または転移性乳癌の併用療法として承認されました5-8。 本稿では、これらの薬剤の相違点(表1)、第III相臨床試験(表2)、有害事象(AE)プロファイル(表3)について概説する。
Palbociclib
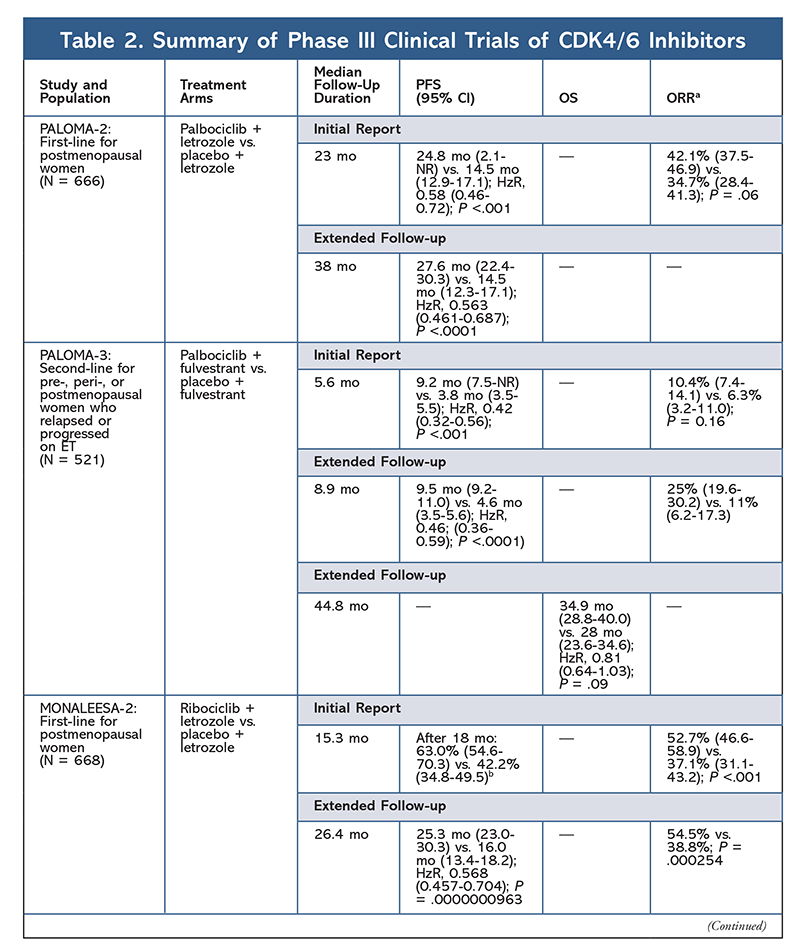
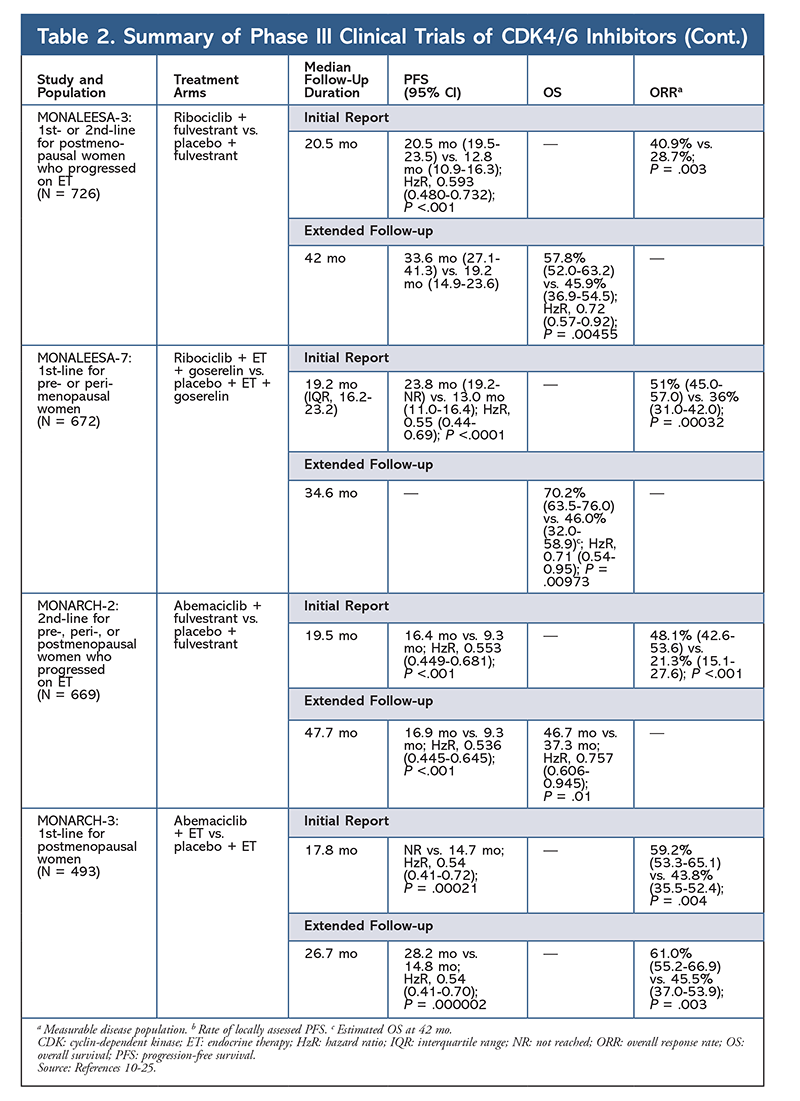
2015年に、パルボシクリブはCDK4/6阻害剤として初めてHR+、HER2-乳がん治療(閉経後女性または男性における最初のETとしてAIとの併用、ET後に疾患進行した患者におけるフルベストラントの併用)においてFDA承認を取得しました。6,9-14 パルボシクリブは、当初、ET未治療の進行乳がん患者の初期治療としてパルボシクリブ+レトロゾール併用療法とレトロゾール単独療法を比較した第II相試験PALOMA-1の結果が良好であったことから承認を取得しました9。
この結果を受けて、この患者集団におけるパルボシクリブの効果をさらに評価する2つの第III相試験が実施されました。 PALOMA-2の最初の結果では、パルボシクリブ+レトロゾールの効果が確認され、レトロゾール単独療法に対して無増悪生存期間(PFS)の改善が示されました(それぞれ24.8カ月 vs 14.5カ月、病勢進行または死亡のハザード比、0.58、95%CI、0.46-0.72、P <.001 )。 38ヶ月の長期追跡試験では、パルボシクリブのPFSに対する効果がさらに確認され、レトロゾール単独の14.5ヶ月に対して27.6ヶ月に増加した(HzR, 0.563; 95% CI, 0.461-0.687; P <.0001 )。 また、追跡調査では、すべての調査対象サブグループにおいてパルボシクリブ+レトロゾールで一貫してPFSが改善し、後続治療開始までの期間中央値も遅延したことが報告されています。 PALOMA-2の開始後まもなく、別の第III相試験であるPALOMA-3が開始され、前治療で進行したHR+進行乳がんの閉経前または閉経後の女性におけるパルボシクリブ+フルベストラントの安全性と有効性が評価されました。 追跡期間5.6カ月後の最初の報告では、PFS中央値が改善し(9.2カ月 vs 3.8カ月)、進行が58%減少した(HzR, 0.42; 95% CI, 0.32-0.56; P <.001)12 PALOMA-3 試験のOSに関する事前特定分析では、追跡期間中央値44.0カ月を使用している。8ヶ月の追跡調査を用いたPALOMA-3試験の事前仕様分析では、intent-to-treatグループ全体のOSの差は統計的有意差に達しなかったが、併用療法は、以前のETに感受性のあった患者においてOSを10ヶ月延長した14。
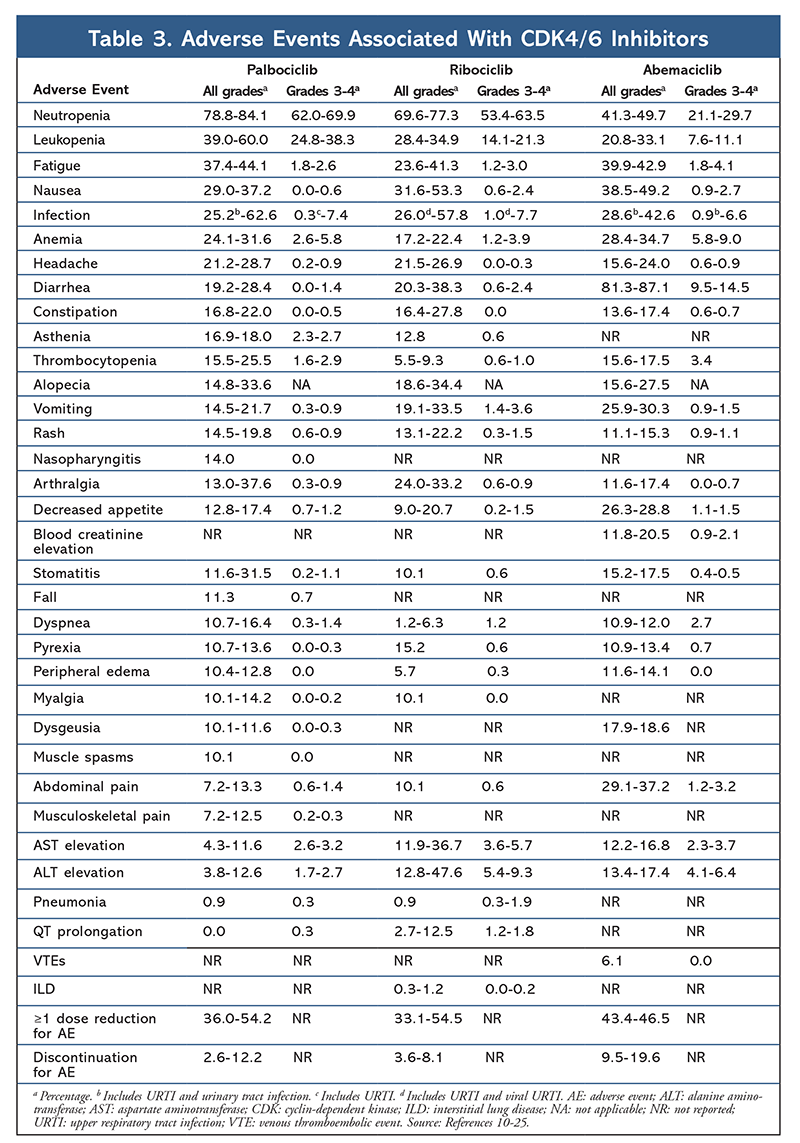
AEプロファイルはすべての試験報告で一貫しており(表3)、全グレード好中球減少(78.8%-84.1%)、白血球減少(39%-60%)、疲労(37.4%-44.1%)などが最も頻繁に報告されたAEであった。 好中球減少症の割合は高かったが、発熱性好中球減少症はまれであった(最大2%)。 パルボシクリブの全体的な忍容性は管理可能であると考えられ、本剤は内分泌単剤療法と比較して併用療法で使用した場合、良好なQOLデータをもたらした9,14
Ribociclib
第2のCDK4/6阻害剤、リボシクリブは、より広い適応患者集団で2017年にFDAに承認されました。 リボシクリブは、HR+、HER2-進行または転移性乳がんの閉経後および閉経前後の女性(初回ETとしてAIとの併用療法として、または閉経後の女性では初回ETとしてまたはETでの疾患進行後にフルベストラントと併用する)7
Riboclib 最初にFDA承認を受けたのはMONALEESA-2試験により、レトロゾール単独に対して併用した場合PFSが改善することが分かったからであった。 18ヶ月後の局所評価によるPFSの割合は、レトロゾール単独に対してそれぞれ63.0%(95% CI, 54.6-70.3), 42.2%(95% CI, 34.8-49.5)15 26.4 ヶ月後の延長フォローアップ報告で、併用療法の有効性と忍容性がさらに実証された16。 リボシクリブは、未治療の患者およびET後に再発した患者を対象に、フルベストラントとの併用で(MONALEESA-3で)検討されている。 最初の報告では、フルベストラント単剤と比較して、この併用療法でPFSが改善したことが明らかになり(それぞれ20.5カ月対12.8カ月、HzR, 0.593; 95% CI, 0.480-0.732; P <.001) 、この併用療法のFDA承認となった17。2番目の、そして最新のCDK4/6阻害剤の報告では、21.6カ月追加してフォローアップし、さらにPFSが安定して改善していることが示されました。 この報告では、フルベストラント単剤と比較したリボシクリブ+フルベストラントのOSベネフィットも証明され、42ヶ月時点での推定OSはそれぞれ57.8%対45.9%、死亡の相対リスクは28%減少した(HzR, 0.72; 95% CI, 0.57-0.9, 0.72)。18
3つ目の臨床試験であるMONALEESA-7は、転移性乳がんを有する閉経前または閉経後の女性に対するCDK4/6阻害剤の第一選択療法としての有効性と安全性を評価する、現在唯一の第III相試験である。 この試験では、リボシクリブとタモキシフェン、またはレトロゾールやアナストロゾールなどの非ステロイド性AI(NSAI)とゴセレリンの併用により、プラセボ群の13カ月に対して23.8カ月と有意にPFSが改善し(HzR, 0.55; 95% CI, 0.44-0.69; P <.0001 )、この組み合わせにより、適応が閉経前および閉経期の女性に拡大しました19。 リボシクリブ+タモキシフェンまたはNSAI+ゴセレリン併用療法のOSベネフィットがプラセボと比較して示され、推定42ヶ月OSは70.2%対46.0%でした20
リボシクリブの毒性プロファイルはパルボシクリブと非常に似ており、パルボシクリブより低い割合ですが、好中球減少と白血球減少が最も高く、重度(等級3/4)AEを報告しています(TABLE 3)。15-20 Febrile neutropeniaはまれであり、どの延長フォローアップ報告においても、リボシクリブの長期曝露によって新たな安全性の懸念が生じることはなかった。 この薬剤は、進行乳癌の閉経後女性における初回治療としてAIとの併用、または治療後に疾患が進行した閉経前、閉経周辺、閉経後女性におけるフルベストラントとの併用を適応としています。 アベマシクリブは、転移性乳がんにおいて、ET後に化学療法を行い病勢進行した男性および女性に対する単剤療法としても承認されています6。本剤は当初、MONARCH-1の結果に基づいて承認を受け、12カ月後の全奏効率(ORR)が19.7%(95%CI、13.3-27.5)、PFS中央値が6カ月と有望な臨床効果を示しています5、21。 この試験では、フルベストラント単独投与に対してアベマシクリブ+フルベストラント併用投与で統計的に有意なPFSの向上が認められました(16.4カ月 vs 9.3カ月、HzR, 0.553; 95% CI, 0.449-0.681; P <.001)22.アベマシクリブ併用療法は、プラセボとフルベストラントに対して、PFSの結果とOSの有益性がわずかに改善したと報告されている(46.7ヶ月 vs. 37.3ヶ月、95%CI, 0.606-0.945; P = 0.01)23
2つのアベマシクリブ試験の開始後まもなく、MONARCH-3が開始された。 この試験では、閉経後女性に対する第一選択治療として、プラセボ+NSAI群と比較して、アベマシクリブ+NSAI群でPFSとORRが統計的に有意に改善されたことが確認された。 8.9ヶ月の追加フォローアップを行った最新報告では、最初の解析のPFSとORRの結果がさらに確認されました。しかし、OSデータはまだ未熟であり、最終的なOS解析は315事象後に実施されます24、25
全体として、abemaciclibは最も効力のあるCDK4/6阻害薬で、その構造により優れた中枢神経活性を持っているので血液脳関門を通過し目標物に長く留まると指摘されています5これは脳転移がある患者に有益であると考えられます。 アベマシクリブも高い割合で血液学的なAEを示しますが、その割合は他のCDK4/6阻害剤と比較してはるかに低いものです。 アベマシクリブは、他のCDK4/6阻害剤よりも下痢などの消化器系毒性が多い(全グレード:81.3%~87.1%、グレード3~4:9.5~14.5%)22-25
薬剤師の役割
全体的に、さまざまなCDK 4/6阻害剤のAEプロファイルは似ているが、それぞれの薬剤には固有のAEがある。 CDK4/6阻害剤で報告された最も一般的なAEは、好中球減少、白血球減少、疲労、吐き気、感染症、関節痛、貧血、頭痛、下痢です(TABLE 3)。 好中球減少症と白血球減少症を除けば、大半の患者はグレード1または2のAEを報告しています。 グレード3または4の好中球減少症と白血球減少は、すべてのCDK阻害剤、特にパルボシクリブとリボシクリブで非常に一般的でしたが、ほとんどは投与の中断や減量で管理されていました。 ベースライン時、最初の2サイクルは2週間ごと、その後の4サイクルの開始時、および骨髄抑制のために臨床的に必要な場合には、患者のCBCをモニターする必要がある。6-8 転倒、筋痙攣、鼻咽頭炎はパルボシクリブに関連するが、ほとんどの場合軽度である10、11、14。 アベマシクリブは、パルボシクリブやリボシクリブと比較して、下痢の発生率が有意に高いことが報告されている。 アベマシクリブは、パルボシクリブやリボシクリブでは報告されていない血清クレアチニン上昇や静脈血栓塞栓事象(ほとんどが軽度)、腹痛の高い発生率と関連していた22-25。 特に、2019年9月、FDAは、CDK4/6阻害剤を投与した患者では稀だが重症、生死に関わる間質性肺疾患(ILD)や肺炎が発生しうることを警告した26。 したがって、患者はILDおよび/または肺炎を示す肺の症状について定期的に監視されるべきである。
結論
近年、パルボシクリブ、リボシクリブ、アベマシクリブが承認され、進行乳がん患者の治療選択肢が拡大した。 いずれも作用機序は同じであるが,有効性と安全性に若干の違いがある。 このレビューで紹介した以外にも、現在進行中の多くの研究で、異なる患者集団や異なる治療法の組み合わせで、これらの阻害剤の研究が続けられています。 これらの薬剤は、CDK4/6阻害剤の使用をHR+、HER2-進行乳がん以外の設定に拡大する可能性があると思われます27
1. Siegel RL, Miller KD, Jemal A. Cancer statistics, 2020. CA Cancer J Clin. 2020;70(1):7-30.
2. Preusser M, De Mattos-Arruda L, Thill M, et al. CDK4/6 inhibitors in the treatment of patients with breast cancer: summary of a multidisciplinary round-table discussion.「乳癌患者の治療におけるCDK4/6阻害剤:集学的円卓会議のまとめ」。 ESMOオープン. 2018;3(5):e000368.
3. Tripathy D, Bardia A, Sellers WR.(トリパシー・ディー、バルディア・アー、セラーズWR. リボシクリブ(LEE011):様々な固形癌におけるこの選択的サイクリン依存性キナーゼ4/6阻害剤の作用機序と臨床的影響。 Clin Cancer Res. 2017;23(13):3251-3262.
4. Portman N, Alexandrou S, Carson E, et al. Overcoming CDK4/6 inhibitor resistance in ER-positive breast cancer.ER陽性乳癌におけるCDK4/6阻害剤耐性の克服. Endocr Relat Cancer. 2019;26(1):R15-R30.
5. Sobhani N, D’Angelo A, Pittacolo M, et al. 乳がんにおけるCDK4/6阻害戦略および併用療法に関する最新情報. Cells. 2019;8(4):E321.
6. イブランス(パルボシクリブ)パッケージインサート. New York, NY: Pfizer Inc; September 2019.
7. Kisqali (ribociclib) パッケージインサート. East Hanover, NJ: Novartis Pharmaceuticals Corp; September 2019.
8. Verzenio(abemaciclib)パッケージインサート。 インディアナポリス、インディアナ州。 Eli Lilly and Co; 2019年9月.
9. Finn RS, Crown JP, Lang I, et al. エストロゲン受容体陽性、HER2陰性、進行乳がんの初回治療としてのサイクリン依存性キナーゼ4/6阻害薬パルボシクリブとレトロゾール併用とレトロゾール単独との比較(PALOMA-1/TRIO-18):無作為化第2相試験.All Rights Reserved. Lancet Oncol. 2015;16(1):25-35.
10. Finn RS, Martin M, Rugo HS, et al.進行乳がんにおけるパルボシクリブとレトロゾールの併用療法.Palbociclib and letrozole in advanced breast cancer. N Engl J Med. 2016;375(20):1925-1936.
11. Rugo HS, Finn RS, Diéras V, et al. エストロゲン受容体陽性/ヒト上皮成長因子受容体2陰性進行乳がんにおける一次治療としてのパルボシクリブ+レトロゾール、経過観察期間延長。 Breast Cancer Res Treat. 2019;174(3):719-729.
12. Turner NC, Ro J, André F, et al. ホルモン受容体陽性進行乳癌におけるパルボシクリブ(Palbociclib)。 N Engl J Med. 2015;373(3):209-219.
13. Cristofanilli M, Turner NC, Bondarenko I, et al. ホルモン受容体陽性、HER2陰性の転移性乳がんで、以前の内分泌療法で進行した場合のフルベストラント+パルボシクリブ対フルベストラント+プラセボ治療(PALOMA-3):多施設、二重盲検、第3相ランダム化比較試験の最終解析.N Engl Med. Lancet Oncol. 2016;17(4):425-439.
14. Turner NC, Slamon DJ, Ro J, et al. 進行乳癌におけるパルボシクリブとフルベストラントの全生存率。 N Engl J Med. 2018;379(20):1926-1936.
15. Hortobagyi GN, Stemmer SM, Burris HA, et al. HR陽性進行乳がんの一次治療としてのリボシクリブ。 N Engl J Med. 2016;375(18):1738-1748.
16. Hortobagyi GN, Stemmer SM, Burris HA, et al. ホルモン受容体陽性、HER2陰性進行乳がんにおけるリボシクリブ+レトロゾールのファーストラインとプラセボ+レトロゾールの第III相試験、MONALEESA-2の更新結果.2016;375(18):17:00-18:00. Ann Oncol. 2018;29(7):1541-1547.
17. Slamon DJ, Neven P, Chia S, et al.ホルモン受容体陽性、ヒト上皮成長因子受容体2陰性の進行乳がんにおけるリボシクリブとフルベストラントの第III相ランダム化試験.Slamon DJ, Neven P, Chia S, et al: MONALEESA-3。 J Clin Oncol. 2018;36(24):2465-2472.
18. Slamon DJ, Neven P, Chia S, et al.進行乳癌におけるリボシクリブ+フルベストラントの全生存率。 N Engl J Med. 2020;382(6):514-524.
19. Tripathy D, Im SA, Colleoni M, et al. ホルモン受容体陽性の進行乳がんの閉経前女性に対するリボシクリブ+内分泌療法(MONALEESA-7):無作為化第3相試験.All Rights Reserved. Lancet Oncol. 2018;19(7):904-915.
20. Im SA, Lu YS, Bardia A, et al.乳がんにおけるリボシクリブ+内分泌療法による全生存率. N Engl J Med. 2019;381(4):307-316.
21. Dickler MN, Tolaney SM, Rugo HS, et al. CDK4およびCDK6阻害剤であるabemaciclibの単剤投与による難治性HR+/HER2-転移性乳がん患者に対する第II相試験、MONARCH 1.の結果。 Clin Cancer Res. 2017;23(17):5218-5224.
22. Sledge GW Jr, Toi M, Neven P, et al. MONARCH 2: Abemaciclib in combination with fulvestrant in women with HR+/HER2- advanced breast cancer that have progressed while receiving endocrine therapy. J Clin Oncol. 2017;35(25):2875-2884.
23. Sledge GW Jr, Toi M, Neven P, et al. 内分泌療法で進行したホルモン受容体陽性、ERBB2陰性乳がんにおけるアベマシクリブ+フルベストラントの全生存率への影響-MONARCH 2: ランダム化臨床試験. JAMA Oncol. 2020;6(1):116-124.
24. Goetz MP, Toi M, Campone M, et al. MONARCH 3:進行乳癌に対する初期治療としてのアベマシクリブ。 J Clin Oncol. 2017;35(32):3638-3646.
25. Johnston S, Martin M, Di Leo A, et al. MONARCH 3 final PFS: 進行性乳がんの初回治療としてのアベマシクリブの無作為化試験. NPJ Breast Cancer. 2019;17(5):5.
26. FDAです。 FDAは、乳がんに対するIbrance、Kisqali、Verzenioによる稀ではあるが重篤な肺炎について警告している。www.fda.gov/drugs/drug-safety-and-availability/fda-warns-about-rare-severe-lung-inflammation-ibrance-kisqali-and-verzenio-breast-cancer. 2020.1.15にアクセスした
27. Shah M, Nunes MR, Stearns V. CDK4/6 inhibitors: game changers in the management of hormone receptor-positive advanced breast cancer? オンコロジー(ウィリストン・パーク). 2018;32(5):216-222.
本記事に含まれる内容は情報提供のみを目的としています。 内容は、専門家のアドバイスに代わるものではありません。 本記事で提供されるいかなる情報への信頼も、あくまで自己責任で行うものとする
。
